Application Note HTRFサイトカインアッセイを細胞生存能に正規化する
- 高感度HTRFテクノロジーでサイトカイン分泌を正確に評価
- 染色せずにMiniMaxサイトメーターでセル播種をモニターする。
- EarlyTox Cell Integrity Assayでアッセイ細胞の生存率をモニタリングすることにより、アッセイの質を確認します。
PDF版(英語)
はじめに
ファビアン・シャリエ=サヴュルナン博士、ファニー・プレニエール、ステファニー・ドゥゾン|シスビオ・バイオアッセイ社
キャロライン・カルドネル博士、ローレンス・モネ|フィールドアプリケーションサイエンティスト|モレキュラー・デバイス
プロおよび抗炎症性サイトカインは、自己免疫、炎症性疾患、感染性疾患において中心的な役割を果たしている。また、代謝性疾患や腫瘍学、特に抗腫瘍免疫反応においても重要な役割を担っています。Cisbio Bioassays 社のホモジニアス時間分解蛍光 (HTRF) は、様々なサイトカインやケモカインを定量するための汎用性の高いプラットフォームを提供します。HTRFは、細胞を用いた実験、特に末梢血単核球(PBMC)のような生理学的モデルにおけるサイトカインやケモカインの放出のモニタリングに最適です。通常、サイトカイン放出の調節は、その分泌を誘導または阻害する薬理学的化合物の使用に依存している。このような薬剤の作用機序をさらに知見するためには、その作用、特に細胞生存率への影響を注意深く解析する必要がある。
このアプリケーションノートでは、SpectraMax® i3x® マルチモードマイクロプレートリーダーとSpectraMax® Minimax® 300イメージングサイトメーターを使用して、細胞生存率とともにサイトカイン分泌の関連解析を行う方法を示します。SpectraMax i3x® Multi-Mode Microplate ReaderとSpectraMax® Minimax® 300 Imaging Cytometerを使用することで、ウェルごと、あるいはセルごとにHTRFと細胞生存率を測定することができ、また細胞の外観をモニターすることでアッセイの質を確認することができます。我々は、(i) 処理したPBMCからサイトカイン分泌を誘導する方法、(ii) HTRFを用いてサイトカインを測定する方法、(iii) Molecular Devices社のEarlyTox™ Cell Integrity Kitを用いてPBMCの生存率を評価する方法、(iv) PBMCの生存率に対するサイトカイン濃度を正規化する方法について述べる。
材料と方法
凍結ヒトPBMCを解凍し、黒壁透明底96ウェルマイクロプレートに、200μLのRPMI+10%ウシ胎児血清(FCS)中で、1ウェル当たり50,000個と100,000個の細胞を播種した。細胞処理に先立ち、PBMCの播種をMiniMaxサイトメーターの透過光チャンネルを用いたイメージングでモニターした。
セル治療
IL6、IL8、TNFα、IL1βの分泌を調節するため、PBMCを、炎症性サイトカインの分泌を低下させることが知られているグルココルチコイドであるデキサメタゾンと、サイトカイン分泌を誘導する0.2μg/mLのLPSで16時間共処理した。IL2およびIFNγの分泌を調節するために、PBMCを高濃度のデキサメタゾン、さらにPMA(0.5ng/mL)およびイオノマイシン(1μg/mL)で16時間共処理した。
HTRFサイトカインアッセイ
一晩のインキュベーション後、各ウェルの上清16μLを384ウェルの低容量マイクロプレート(Greiner #784075)に移し、HTRFサイトカインアッセイを行った。簡単に言うと、各サンプルはそのまま、または各アッセイの直線範囲に収まるように1:10または1:20に希釈して使用した。サイトカイン濃度は、RPMI+10%FCSで希釈した標準品からなる対応する標準曲線から補間した(HTRFサイトカインキット: 62hifngpeg、62hil02peg、62hil1bpeg、62hil06peg、62hil08peg、62htnfapeg)。
SpectraMax i3xリーダーを使用して、SoftMax® Proソフトウェアで事前に設定したプロトコルでHTRFサイトカインアッセイを読み取った。
HTRFサイトカインアッセイを細胞生存率にノーマライズするワークフローは、moleculardevices.com/ htrf-workflowをご覧ください。
EarlyTox細胞完全性アッセイ
その後、上清吸引後の細胞について、EarlyTox™ Cell Integrity Kitを用いて細胞生存率を評価した。EarlyTox Cell Integrity Kit(Molecular Devices社、P/N:R8213)は、2種類のDNA結合色素を使用する:細胞透過性のLive Red Dye(全細胞の核を標識)と細胞不透過性のDead Green Dye(死細胞のみを標識)。細胞生存率は、Minimaxサイトメーターの2色蛍光イメージ(緑:460 nm ex/541 nm em、赤:625 nm ex/713 nm em)とSoftMax® Proソフトウェアの細胞解析機能で評価した。
データ分析
データはSoftMax Proソフトウェアを用いて作成・分析した。
- HTRF比とデータ削減は、Cisbioのガイドラインに従い、事前に設定されたプロトコルで自動的に行われた。(http://www.cisbio.com/usa/drug-discovery/htrf-ratio-and-datareduction)
- 平均値と標準偏差(SD)はグラフ上に表示されている。
- 正規化手順: 正規化[サイトカイン]pg/mL = [サイトカイン]pg/mL ÷ 生細胞数
結果
細胞処理前のPBMC播種のコントロール
細胞処理の前に、ヒトPBMCを透過光チャンネルでイメージングし、適切な播種を確認した。これらの細胞の直径は6 µm未満で、透過光画像で個々にカウントするのは困難です。そこで、ユーザー定義のカスタム解析を実施し、画像あたりの被覆面積のパーセンテージとして細胞密度を計算した。この解析では、ウェルあたり50,000個のPBMCを表す被覆面積が19.7%、ウェルあたり100,000個のセルを表す被覆面積が35.9%と計算され、これは1.82の比率に相当します(データは示さず)。これらの結果は、この新しいカスタムデータ解析が、フィールド解析において対物レンズの同定に成功し、ウェルあたりの正確な面積割合の算出を可能にしたことを裏付けています。
デキサメタゾン投与後のLPSまたはPMA/ionomycinによるサイトカイン放出の変調
予想通り、LPSはIL1β、IL6、IL8、TNFαの分泌を効率的に誘導し(図1)、一方、5 ng/mL PMA + 1 µg/mL ionomycinによる共刺激はIL2とIFNγの最大放出を誘導した。
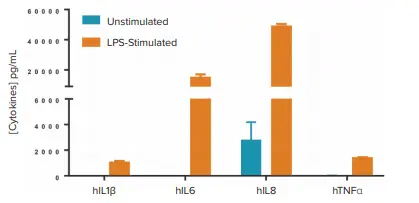
図1. SpectraMax i3xリーダーを用いたHTRFアッセイで測定した、LPS刺激によるサイトカイン分泌。
興味深いことに、IL2とIFNγの両分泌は、2μg/mLのイオノマイシンの存在下で有意に減少した(データは示さず)。
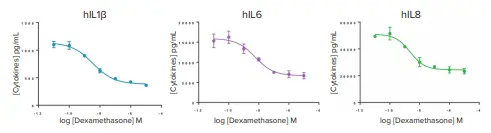
デキサメタゾンは、LPSまたはPMA/イオノマイシン処理によって誘導されたサイトカイン放出を有意に減少させた(図2)。
| IL1β | IL6 | IL8 | TNFα | IL2 | IFNγ | |
|---|---|---|---|---|---|---|
| S/B | 3.0 | 2.4 | 2.1 | 2.4 | 1.5 | 2.0 |
|
IC 50 dexa (M) |
3.491E-09 | 5.824E-09 | 2.304E-09 | 6.048E-09 | 1.456E-08 | 3.282E-08 |
図2. サイトカイン分泌に対するデキサメタゾンの効果。TNFα、IL2およびIFNγの用量反応曲線は示していない。
EarlyTox Cell Integrity Assayでモニターした細胞生存率に対するLPS、デキサメタゾン、PMA/イオノマイシン処理の影響
EarlyToxデータ解析は、赤色チャンネル(サイズと蛍光強度の閾値)を用いたセルカウントと、生細胞集団と死細胞集団の同定に依存した。SoftMax Pro ソフトウェアの分類機能を使用し、核が赤色のみラベル付けされたセルを生細胞、核が赤色と緑色の両方でラベル付けされたセルを死細胞として分類した。同定された対物レンズは、赤色(生細胞)および青色(死細胞)マスクによってソフトウエア上で可視化された(図3および4)。
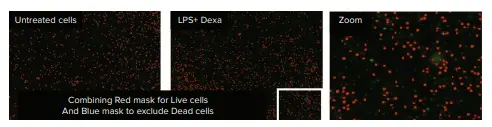
図3. LPS + Dexamethasone処理したPBMC。SoftMax® ProソフトウェアのClassification機能により、セルは生細胞(赤色マスク)として認識されたが、死細胞(青色マスク)は識別されなかった。
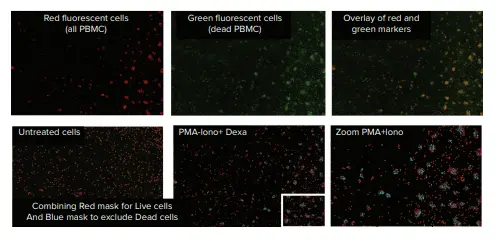
図4. PMA+イオノマイシン処理したPBMC。細胞は、SoftMax® ProソフトウェアのClassification機能を使用して、クラスタリングで生細胞(赤色マスク)または死細胞(青色マスク)として識別された。
LPS+デキサメタゾン処理では、未処理細胞と比較して、細胞生存率にも細胞形態にも顕著な影響は認められなかった(図3)。PMAおよびイオノマイシン刺激処理では、細胞クラスタリングが誘導され、10~13%の死細胞が生じた(図4および表1)。
| 50,000セル/ウェル | 100,000セル/ウェル | |||
|---|---|---|---|---|
| 生細胞数/ウェル | 死んだPBMC | 生細胞数/ウェル | 死んだPBMC | |
| コントロール | 12,133 | 0 | 29,658 | 0 |
| LPS | 15,210 | 0 | 30,600 | 0 |
| PMA(5 ng/mL)/イオノマイシン(1 µg/mL) | 16,794 | 10 | 24,376 | 13 |
表1. LPSまたはPMA/イオノマイシンがPBMC細胞の生存率(死細胞の割合)に及ぼす影響を示すEarlyTox Cell Integrity Assayの結果。
細胞生存率および形態に対するPMA/イオノマイシンの影響についてさらに理解を深めるために、PBMCをPMAおよびイオノマイシンの用量を増やしながら別々に処理した。前述の方法と同じ方法を適用した(画像は示さず)。図5で報告したように、細胞死は2つの化合物の濃度が高くなるにつれて有意に増加し、両薬剤が細胞毒性を媒介することが示された。さらに、我々のデータは、PMAがイオノマイシンのほぼ2倍の細胞毒性を示すことを示した(2μg/mLのイオノマイシンで7%の死細胞に対し、50ng/mLのPMAで15%の死細胞)。
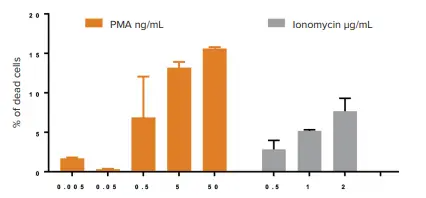
図5. PMAとイオノマイシンを別々に添加した場合の細胞毒性効果。
サイトカイン産生と細胞生存能の正常化
PBMCの生存率とサイトカイン分泌データの統合は、生物学的反応の正確な解析の最終段階を意味する。正規化を行うために、HTRFで決定したサイトカイン濃度をEarlyTox Cell Integrity Assayで決定した生細胞数で割った。
図6では、サイトカイン濃度を生細胞数当たりで表し、薬理学的ウィンドウとIC50を表2に報告した。予想通り、デキサメタゾンは有意な細胞毒性作用を誘導しなかったので、薬理学的結果は正常化の前後で同等であった。
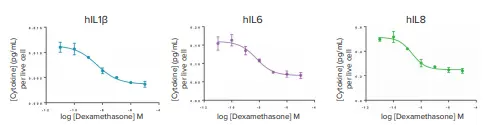
図6. サイトカイン分泌の正常化に対するデキサメタゾンの効果。TNFα、IL2およびIFNγの用量反応曲線は示していない。
| LPS刺激PBMC(生存率100) | PMA/Iono刺激PBMC(生存率85) | |||||
|---|---|---|---|---|---|---|
| IL1β | IL6 | IL8 | TNFα | IL2 | IFNγ | |
| S/B | 3.1 | 2.4 | 2.1 | 2.3 | 1.4 | 1.7 |
|
IC 50 dexa (M) |
3.9 E-09 | 6.0 E-09 | 2.2 E-09 | 5.4 E-09 | 2.8 E-08 | 2.6 E-08 |
表2. 刺激PBMCに対する薬理学的ウィンドウ(SB比)とIC50値。
しかし、PMA/イオノマイシンで刺激されたIL2またはIFNγの分泌を細胞生存能の値で正規化すると、これまで検出されなかったPMAの濃度依存的な効果が明らかになった(図7)。このことは、サイトカイン分泌(または他の生物製剤)を生細胞数に正規化することで、関連する生物学的応答を明らかにできることを強調している。
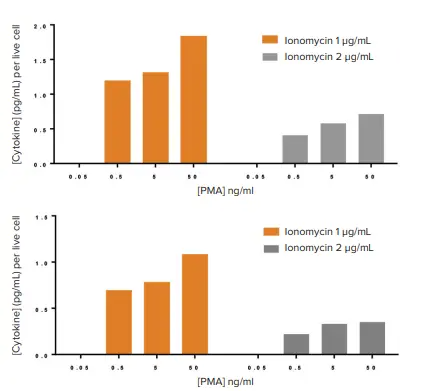
図7. 正規化サイトカイン分泌に対するPMA/イオノマイシンの濃度の違いによる影響。上、hIL2分泌量を生細胞数で正規化。下、生細胞数に対して正規化したhIFNγ分泌量。
結論
この研究は、顕著な細胞毒性を誘導しないデキサメタゾンとは対照的に、PMAとイオノマイシンの細胞毒性効果を明確に立証している。EarlyTox Cell Integrity Kitで得られた細胞生存率の結果は、PMAまたはイオノマイシンの目に見える濃度応答効果を示しています。
Cisbio Bioassaysは、サイトカイン分泌を評価し、PBMCのような懸濁細胞からのサイトカイン放出に対する薬剤の細胞毒性効果を決定するための、使いやすく高感度な方法を提供します。SpectraMax i3x リーダーとMiniMax サイトメーターの機能を組み合わせることで、HTRF サイトカイン定量とEarlyTox Cell Integrity Kitを用いた細胞生存能評価が可能になります。
PDF版(英語)