Application Note β-カテニンモジュレーターの核転座スクリーニングアッセイ
- 再現性のある表現型測定
- 画像品質を損なうことなくハイスループットで取得
- インタラクティブなデータプレビューによる解析セットアップ時間の短縮
- ロバスト性測定のための独自の統計的アプローチ
PDF版(英語)
はじめに
双極性障害(BD)は遺伝性の精神疾患で、世界人口の約1%が罹患している。1949年に躁病の治療に初めて使用されたリチウムは、現在でも双極性障害の最も一般的な治療薬である。しかし、患者の50%はリチウム治療に反応せず、毒性と副作用が重大な問題となっている。
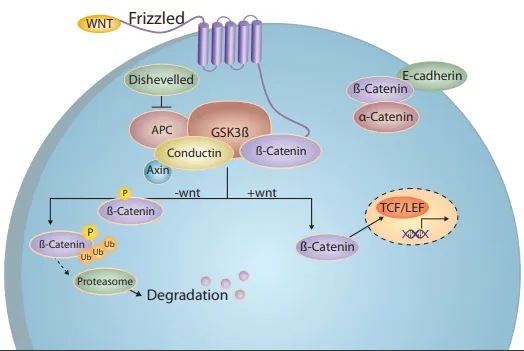
リチウムの作用機序の治療的基盤は完全には解明されていないが、グリコーゲンシンターゼキナーゼ3(GSK-3)の活性を阻害し、Wntシグナル伝達経路を活性化することが知られており、プロテアソームが介在するβ-カテニンの分解を直接的・間接的に低下させる。Wnt/β-カテニンシグナル伝達の新しいタンパク質や薬理学的調節因子は、細胞シグナリングに蓄積されたままのβ-カテニンの量によって測定されるβ-カテニン分解をブロックしたりブロック解除したりする能力に基づいて同定することができる。このような定量は、ハイスループットでシステマティックなイメージングアプローチによって合理化され、検出と解析が改善される。この取り組みを支援するため、Wntシグナル伝達経路の破壊に応答して核内の ß-カテニン蓄積を測定できる細胞ベースのレポーターアッセイでハイコンテントスクリーニングプラットフォームを利用し、1856種類のヒト経験化合物のライブラリーをスクリーニングした。
ハイスループットなワークフローのためのエンドポイントアッセイの準備
強化緑色蛍光タンパク質(EGFP)と融合したヒトß-カテニンを発現するようエンジニアリングしたU2OS細胞を、384ウェルマイクロプレートに1500細胞/ウェルでプレーティングした。細胞を37℃で48時間培養した後、スクリーニング・ライブラリーの化合物を添加した。細胞をさらに24時間培養した後、5μg/mLのHoechst 33342 DNA色素を封じ込めた4%パラホルムアルデヒドを用いて固定した。これらの結果に基づき、スクリーニングライブラリーから1つの活性化合物をさらに評価し、以下に示した。
スピードを損なうことなく、統計的有意性の高い多数の細胞をイメージング
ハイコンテントイメージャーは、ImageXpress® Microシステムを用いて実施した。EGFP蛍光とHoechst核染色を測定するために2つの Wavelengthを用い、10倍の対物レンズでウェルあたり4部位を取得した。10倍の倍率は、各視野で1000以上のセルのデータを取得し、一貫して統計的に有意な解析結果をもたらした。
化合物刺激に対する表現型反応の同定
β-カテニン-EGFP発現細胞株を基礎条件下(コントロール)でイメージングしたところ、β-カテニン-EGFPレポーターのプロテアソームによる分解が恒常的に起こるため、細胞質にも核にもβ-カテニンは見られなかった。その代わりに、細胞膜に残存するカドヘリンのサブ集団との相互作用による、かすかな膜局在シグナルが画像から明らかになった(図2、左)。GSK-3β阻害剤などでWntシグナル伝達経路を阻害すると、ß-カテニン-EGFPレポーターは用量依存的に核に集積した(図2、右)。
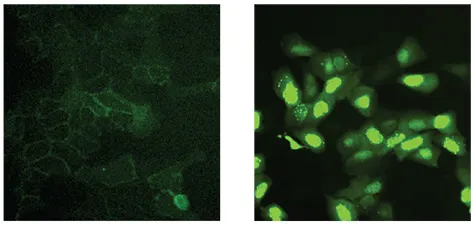
図2. 10倍のPlan Fluor対物レンズを用いて取得した拡大画像。通常のWnt発現に対する反応。蛍光EGFPはかすかに見え、細胞膜に分散しており、細胞核には集積していない(左)。GSK-3β阻害剤で処理すると、Wntシグナル伝達が阻害され、ß-カテニン-EGFPが核内に移動する(右)。
インタラクティブでフレキシブルなソフトウェアを用いたデータ解析
MetaXpress®ソフトウェアのTranslocation-Enhanced Application Moduleを使用して、核を同定し、核に対する細胞内の異なるコンパートメントに存在するß-カテニン-EGFP蛍光の量を定量した(図3)。

図3. Translocation-Enhanced Application Moduleにより、核染色から核コンパートメントが、核マスクから細胞質コンパートメントが生成される(上)。MetaXpress®ソフトウェアは、コンパートメント間の正確なサイズと境界を定義し、細胞を陽性または陰性としてスコアリングするためのカットオフを設定するために、領域の測定値を調整する自由を提供する(下)。
核コンパートメントのセグメンテーションは、Hoechst核色素で染色した領域から作成した。この核マスクを第二の波長(EGFP)と併用し、アッセイの特異性に応じてサイズと幅を調整できるコンパートメントを作成した。これにより、核、細胞質、細胞膜などの各コンパートメント内の蛍光強度を定量化し、解析することができる。インタラクティブなモジュールは、パラメーターが調整されると即座にフィードバックを与えるので、特異性アッセイごとに解析を微調整することができる。
MetaXpress®ソフトウェアトランスロケーションエンハンスドアプリケーションモジュールは、様々なアルゴリズムを使用して、セルがどのようにスコアされるかをカスタマイズすることができます。特定の細胞コンパートメントにおける各Wavelengthの平均強度または合計強度を細胞ごとまたは画像ごとに測定することに加えて、細胞領域全体における2つの染色の強度からピアソンの相関係数を計算することができます。結果として得られる係数は-1(反相関)から1(完全相関)までの範囲となる。この例では、係数が高いほど、より多くのß-カテニン-EGFPが核に転移していることを意味する(図4)。
低い核転座
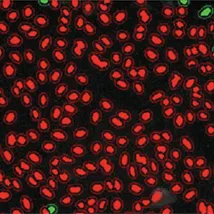
高い核転座
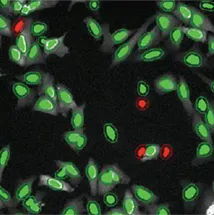
図4:MetaXpress®ソフトウェアでTranslocation-Enhanced Application Moduleを用いてDMSO処理陰性コントロール(左)とMG132処理陽性コントロール(右)の条件で作成したセグメンテーションマスク。上のイメージングでは、ピアソンの相関係数が0.5以上のセルを陽性(緑)、0.5未満のセルを陰性(赤)とした。
その後、核コンパートメント対細胞質平均強度の比をプロットして用量反応曲線を作成した(図5)。アッセイのロバスト性はZ'値を計算して評価した。
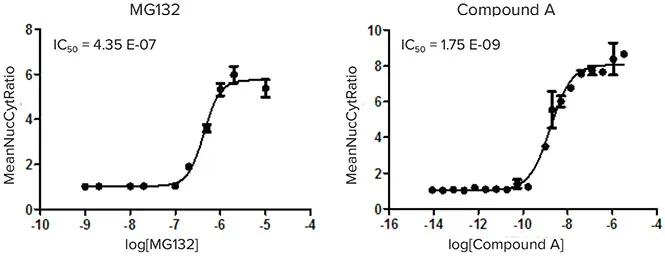
図5:陽性対照化合物MG132(左)とサンプルヒット化合物A(右)の用量反応曲線。核コンパートメント:細胞質平均強度の比をプロットすることにより、IC50値を決定した。陽性対照化合物MG132のZ'値が0.7以上であったことから、本アッセイのロバスト性が証明された。
転座イベントをハイスループットで測定
ß-カテニンのシグナル伝達経路を調節する化合物に反応してß-カテニンの転座を測定するこのアッセイは、細胞内転座イベントを検出するハイスループットなアッセイの一例である。低倍率でも高画質な画像により、化合物の活性を特徴付けるための統計学的に適切な測定値が得られ、アッセイされた多数の化合物から活性のある化合物が明確に同定された。細胞ベースレポータージーンアッセイと当社のハイコンテントスクリーニングフォームを組み合わせることで、ある細胞コンパートメントから別の細胞コンパートメントへのタンパク質のトランスロケーションのスクリーニングキャンペーンを成功させるための完全なソリューションを提供します。
ImageXpress Microについてさらに詳しく >>
PDF版(英語)