Application Note 凍結CHO細胞を用いたFlexStation 3リーダーによる
ムスカリンM3受容体アッセイの最適化
- 幅広い生物学的ターゲットに適用可能な汎用性の高いアッセイ
- ホモジニアスフォーマットによりプレートハンドリングが軽減され、スループットが向上
- マルチチャンネルリキッドハンドリングにより、アゴニストとアンタゴニストの両方の研究が容易にセットアップ可能
PDF版(英語)
はじめに
細胞を用いたアッセイは、困難で時間がかかることが多い。この複雑なプロセスを簡便化し合理化するために、連続的に 培養する細胞の代わりに、事前に培養することなくアッセイ できる凍結細胞が適しており、頻繁に使用されている。凍結細胞は、細胞培養の準備と機能試験を切り離し、生物学的変動性を緩和し、プレート間の一貫性とデータの忠実性を向上させ、アッセイスケジュールの柔軟性を高め、細胞培養コストを大幅に削減するのに役立つ。
FLIPR®Calcium 5 Assay Kit(図1)は、他の "洗浄なし "カルシウム試薬よりも優れた性能を示し、様々な生物学的ターゲットに幅広く適用できます。通常の洗浄工程を省くことで、プレートの取り扱いが軽減され、アッセイのスループットが向上するという大きな利点がある。さらに、最適でないアッセイ条件下では、均一なアッセイを使用することで、データの質が向上し、ウェル間のばらつきが減少する可能性がある。
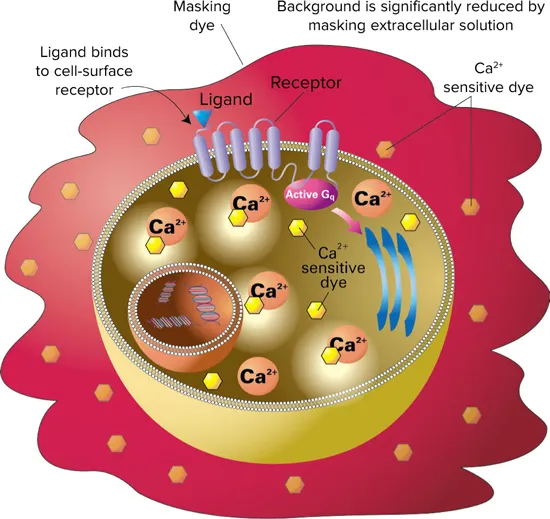
図1. FLIPRカルシウムアッセイキットにはカルシウム感受性色素が含まれており、インキュベーション中に細胞質内に取り込まれる。キットのマスキング色素は細胞外に留まり、バックグラウンドの蛍光を遮断する。リガンドがレセプターに結合すると、カルシウムが細胞質内に放出される。色素は細胞内カルシウムに結合し、蛍光を発する。
FlexStation®3 Multi-Mode Microplate Readerは、ソースプレートから読み取りプレ ートに直接試薬を移動させることにより、ディスペンサーベースの システムよりも柔軟性が増し、試薬や消耗品の消費量が削減されま す。細胞プレートの各カラムに供給する試薬と濃度を個別に設定できるため、1回の実験でより多くのアッセイ条件を検討することができ、アゴニストとアンタゴニストの両方の研究に理想的なシステムとなります。
このアプリケーションノートでは、FlexStation 3readerを利用して、代表的なGq-GPCRアッセイで異なるCa2+指示薬(一波長と二波長の両方)を比較し、均質な「無洗浄」カルシウム試薬を使用する潜在的な利点を強調します。さらに、継続培養中の細胞と凍結試薬から調製した細胞(European Collection of Cell Cultures (ECACC)から入手可能な "Assay Ready "細胞)との間で、アッセイ性能とデータの忠実度を比較した。
材料
- FlexStation 3 マルチモードマイクロプレートリーダー(Molecular Devices社製)
- AquaMax ® 4000マイクロプレート洗浄器(96ウェルセル洗浄ヘッド付き)(Molecular Devices社製
- ImageXpress ® Micro Widefield High Content Screening System(モレキュラーデバイセズ社製)
- FLIPR Calcium5 Assay Explorer Kit(Molecular Devices、カタログ番号R8185)
- Fluo-4 AM(インビトロジェン、Cat. #F-14201)
- Fura-2 AM(インビトロジェン、Cat. #F-1221)
- DAPI 核酸染色 (Invitrogen、Cat. #D-1306)
- ヒトムスカリンM 3レセプターを発現する凍結保存 "Assay Ready "CHO細胞(CHRM3、ECACC、Cat. #10031603)
- 水溶性プロベネシド(Invitrogen, Cat.)
- CHO細胞用培地 Hams F12: DMEM with 10% FBS and 1% pen/strep (Invitrogen, Cat. #31331-093, 16140-071 and 15140-122)
- カルシウムとマグネシウムを含むハンクス平衡塩類溶液 (HBSS)、20mM HEPES(Invitrogen, Cat.)
- セルプレート(黒壁透明底96ウェルCellBINDマイクロプ レート、コーニング、Cat.)
- アセチルコリン、非選択的ムスカリン受容体作動薬(ACh、Sigma、Cat.)
- p-フルオロヘキサヒドロシラジフェニドール塩酸塩、ムスカリン受容体アンタゴニスト(p-F-HHSiD、Sigma、Cat. #H127)
- メタノール(Sigma、カタログ番号179337)
方法
細胞の取り扱いとプレーティング法
- 継続的に培養しているムスカリンM 3レセプター(CHRM3)発現 CHO細胞を、200μLの増殖培地中に30,000個/ウェルでプレーティングし、室温で30分間ベンチに静置した後、37℃、湿度95%、CO2 5%で一晩維持した。
- 「Assay-Ready" 凍結CHRM3細胞を37℃のウォーターバスで急速解凍し、10 mLの温めた増殖培地に静かにピペッティングし、1000 rpmで5分間遠心した。細胞を培地に再懸濁し、200μLの培地中に50,000個/ウェルずつプレーティングし、プレートをベンチ上で30分間室温に放置した後、37℃、湿度95%、CO2 5%で18時間インキュベートした。
- 凍結保存したCHRM3細胞を37℃のウォーターバスで急速解凍し、10 mLの温培地に静かにピペッティングし、1000 rpmで5分間遠心した。細胞を10mLの温かい増殖培地に再懸濁し、CO2インキュベーターに60分間戻した。遠心後、細胞をFLIPRカルシウム5アッセイ試薬に再懸濁し、100 µLのローディングバッファーに75,000個/ウェルでプレーティングした。最後に、細胞プレートを1000 rpm(ブレーキなし)で再度遠心し、CO 2インキュベーターに45分間戻した。
FLIPRカルシウム5アッセイ試薬ローディング
100 µL per well.
色素ローディングバッファーは、20 mL のハンクス平衡塩類溶液(20 mM HEPES、2.5 mM probenecid、pH 7.4に調整)を最終容量として、色素バイアル1本分を完全に溶解して調製した。細胞調製法(1)および(2)で作製した細胞プレートをインキュベーターから取り出し、増殖培地を除去し、各ウェルに100 µLの色素ローディングバッファーを添加した。色素負荷したプレートを37℃、5% CO2で45分間インキュベートし、測定前に15分間室温に平衡化させた。色素負荷後、プレートは洗浄せず、初期アッセイ量は各ウェル100 µLとした。
Fluo-4 AM および Fura-2 AM 染料の負荷
上記の方法(2)に従って調製した細胞を、100 µL/ウェルのFluo-4 AMまたはFura-2 AM(2.5µM、2.5 mM probenecid添加)と共に、増殖培地吸引後、37℃で45分間インキュベートした。その後、96ウェル細胞洗浄ヘッドを装着したAquaMax 4000 Microplate Washerを用い、HBSSバッファー+2.5mMプロベネシドで細胞プレートを洗浄した。洗浄プログラムは、プログラムされた一連の吸引・分注ステップで構成された(表1)
| ステップ | 動作 | 設定 |
|---|---|---|
| 1 | Aspirate | 吸引速度=5、下降速度=高速、滞留時間=2.0秒、プローブ高さ=1.0、2.0、または3.0 mm |
| 2 | Dispense | ディスペンス速度=1または2、容量=300 µL |
| 3 | Aspirate | 吸引(ステップ1と同じ) |
| 4 | Repeat | ステップ2を1回繰り返す |
| 5 | Dispense | ディスペンス速度=1または2、容量=300 µL |
| 6 | Aspirate | 下降速度=高速、滞留時間=2.0秒、プローブ高さ=4.5mm |
表1. CHRM3 細胞を用いたカルシウムフラックスアッセイ用の AquaMax 4000 マイクロプレートウォッシャーパラメーター。
ImageXpress Microシステムによる細胞数の確認
色素比較試験の細胞数とコンフルエンスを検証するため、上記細胞法(2)で調製したプレートをDAPI核酸染色し、ImageXpress MicroWidefield High Content Screening Systemで画像化した。簡単に説明すると、細胞を様々な密度で調製し、37℃、湿度95%、CO2 5%で18時間培養した。増殖培地を除去し、1ウェルあたり100μLの氷冷メタノールで置換した。5分後、メタノールを除去し、1ウェルあたり100μLのDAPI溶液(300nM)に交換した。これを5分間インキュベートした後、HBSSで3回洗浄した。その後、細胞単層を4倍の対物レンズで撮像し、ウェル全体の面積を測定した後、MetaXpress® ソフトウェアのCount Nuclei アプリケーションモジュールを使用して、ウェルあたりの総細胞数を報告した。
細胞最適化アッセイ
3つの異なる細胞処理法を比較するために、アセチルコリン(ACh)アゴニスト応答曲線とp-F-HHSiDアンタゴニスト阻害曲線を定性的および定量的に比較した。色素インキュベーションと温度平衡化の後、カルシウム動員アッセイを室温で行った。アセチルコリン(ACh)の希釈系列をHBSS緩衝液で最終濃度3倍(アッセイ濃度0.03 nM-300 nM)に調製し、96ウェルポリプロピレンプレートに入れ、細胞内Ca2+放出を刺激するために50μL/ウェルを細胞プレートの各ウェルに添加した。
アンタゴニスト研究のために、p-F-HHSiDを3倍濃度で調製し、4倍濃度のACh(EC80)50μLを添加する前にオフラインで15分間添加した。
蛍光測定は、化合物添加前、添加中、添加後の90秒間行った。
カルシウム指示薬比較アッセイ
カルシウムフラックスは、FlexStation 3リーダーを用い、 「Flex」読み取りモードで測定した。FLIPR Calcium5 Assay Kit、Fluo-4 AMまたはFura-2 AMを負荷した細胞に、FlexStation 3リーダーの内蔵8チャンネルピペッターを用いて、様々な濃度のACh(5倍希釈で20 pM~8 µM)を負荷した。蛍光測定は、最適化されたパラメーターを用いて、化合物添加前、添加中、添加後90秒間行った(表2)
| パラメーター | 設定 | ||
|---|---|---|---|
| カルシウム 5 | Fluo-4 AM | Fura-2 AM | |
| 読み取りタイプ | Flex | ||
| 読み取りモード | 蛍光、ボトムリード | ||
| 励起波長 | 485 nm | 485 nm | 340/380 nm |
| 発光波長 | 525 nm | 525 nm | 510 nm |
| カットオフ | 515 nm | 515 nm | なし |
| 稼働時間 | 90秒 | ||
| インターバル | 1.6 秒 | 1.6 秒 | 3.5秒 |
| 化合物の添加 | |||
| 初期容量 | 100 µL | ||
| ピペットの高さ | 65 µL | ||
| 容量 | 50 µL | ||
| レート | 4 (64 µL/s) | ||
| 時点 | 20秒 |
表2. FlexStation 3リーダーを用いたCHRM3細胞のカルシウム色素 比較アッセイ用に最適化されたSoftMax Proソフトウェ アの設定値。
アンタゴニスト研究では、p-F-HHSiDを適切なウェルに手動で加え、プレートをFlexStation 3リーダーにセットする前に15分間平衡化させた。その後、装置のオンボード流体システムを用いてACh(EC80濃度)を50μL/ウェル分注し、蛍光の変化をリアルタイムでモニターした。
データ解析
応答は、ピーク蛍光強度(FLIPR Calcium 5 Assay Kitor Fluo-4 AM)、または Fura-2 AM の最大 340/380 nm 比として測定した。比較を容易にするため、データはベースラインに対する%応答として正規化し、n≧4で平均±s.e.m.として表した。
個々の濃度-効果曲線データは、4パラメータのロジスティックに当てはめた:
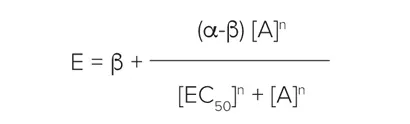
ここで、α、β、EC50、nはそれぞれ上漸近、下漸近、位置(EC50/ IC50)、勾配パラメータである。すべてのカーブフィッティングルーチンは、SoftMax Pro 6ソフトウェアを用いて実施した。
Z´因子は以下の式で計算した:
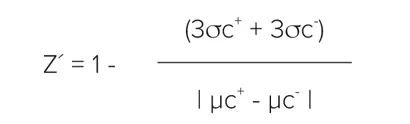
ここでσc+は陽性コントロールの標準偏差を表し、σc-は陰性コントロールの標準偏差を表す。用語|μc+-μc-|は、陽性コントロール信号の平均と陰性コントロール信号の平均との差の絶対値を示す。Z' factor > 0.5は陰性コントロールと陽性コントロールの間の分離帯が大きいことを示し、したがって頑健なアッセイであることを示す1。
試験結果
細胞最適化アッセイ
FLIPRカルシウム5アッセイキットを負荷したCHRM3細胞2は、3種類の細胞調製法のいずれにおいても、ACh塗布に応答して強い蛍光の増加を示した(図2)
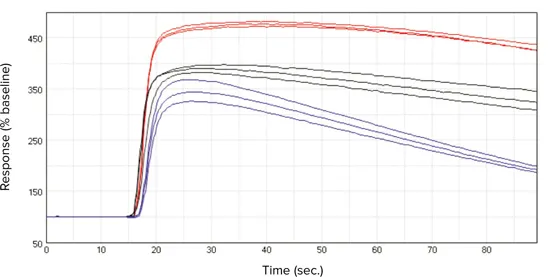
図2. キネティック・トレース
FlexStation 3リーダーでFLIPR Calcium 5 Assay Kitを負荷したCHRM3細胞でACh(300 nM)を測定し、SoftMax Pro 6ソフトウェアからエクスポートした代表的な動態トレース。細胞条件は、(-)連続培養細胞、(-)凍結細胞を解凍後18時間使用、または(-)凍結細胞を使用。プロットは、x軸の時間(秒)に対するベースラインに対する%反応をy軸に示す。
AChに対するEC50値の計算値は、互いに0.5log単位以内であった(表3)が、凍結保存した細胞を直接使用した場合、EC50値に有意な(P < 0.05)左右シフトが見られた(図3)。同様に、p-F-HHSiDのIC50推定値は3つの細胞調製法の間で類似していた。Z'推定値は、継続培養細胞および18時間使用した凍結細胞の方が、凍結細胞を直接使用した場合よりも大きかった。
| 培養細胞 | 18時間後の凍結細胞 | 凍結細胞 | |||||||
|---|---|---|---|---|---|---|---|---|---|
|
EC 50 /IC 50 |
% R/B | Z’ |
EC 50 /IC 50 |
% R/B | Z’ |
EC 50 /IC 50 |
% R/B | Z’ | |
| ACh |
1.9 x 10 -9 M |
378 | 0.61 |
2.5 x 10 -9 M |
501 | 0.78 |
6.3 x 10 -9 M |
352 | 0.41 |
|
p -F-HHSiD |
3.6 x 10 -8 M |
341 | 0.57 |
3.7 x 10 -8 M |
450 | 0.81 |
4.9 x 10 -9 M |
286 | 0.24 |
表3. FLIPR Calcium 5 Assay Kitを負荷したCHRM3細胞について、3つの異なる細胞処理条件下での比較結果
* 注:アゴニストデータのZ'推定値はEC80応答を用いて算出した。ベースラインに対する%応答(%R/B)パラメータは、ベースラインを100%応答として、ベースラインを超えるピーク応答を計算することにより得られた。
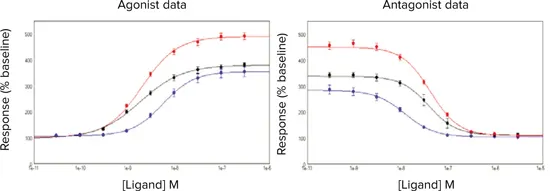
***図3. 活性化/阻害曲線。
AChの活性化/阻害曲線±p
FLIPRカルシウム5アッセイキットを負荷したCHRM3細胞における-F-HHSiD。試験した細胞条件は、(-)継続培養細胞、(-)凍結細胞を解凍後18時間使用、または(-)凍結細胞。
これらの初期研究から得られたEC50推定値、シグナルの大きさ、Z'値の改善、細胞調製が容易であること、消耗品コストが低いことを踏まえ、以降の実験はすべて、プレーティングから18時間後に使用した凍結細胞を用いて実施した(方法2)
ImageXpress Micro システムでの細胞数確認
細胞数とコンフルエンスを経験的に確認するため、細胞調製法(2)に従って代表的な細胞プレートを2枚調製した。翌日、DAPI核酸染色を行った。その後、プレートをImageXpress Micro Widefield High Content Screening Systemで画像化した(図4)

***図4. 細胞密度
ImageXpress MicroWidefield High Content Screening Systemで撮影した代表的な細胞密度画像。元の細胞プレーティング密度は、各代表ウェルの上に数字で示されている。
この一連の実験において、一貫した単層を与える最適な細胞密度は50,000個/ウェルと決定された(表4)。この細胞密度は、その後のすべての実験に用いられた。
| 18時間後の細胞数 | (ウェルあたりの平均細胞数 |
|---|---|
| 80,000 | 71,935 |
| 70,000 | 64,496 |
| 60,000 | 58,209 |
| 50,000 | 53,374 |
| 40,000 | 44,002 |
| 30,000 | 34,348 |
| 20,000 | 24,515 |
| 10,000 | 14,482 |
***表4. DAPIで染色したCHRM3細胞で得られた細胞密度の結果。
データは、Count Nuclei Application Module for MetaXpress Softwareを用いて解析した。
カルシウムインジケータ比較アッセイ
AChは、FLIPR Calcium5 Assay Kit、Fura-2 AMおよびFluo-4 AMをそれぞれ負荷したCHRM3細胞において、濃度依存的に細胞内Ca2+の増加をもたらした(図5)
一元配置分散分析(ANOVA)によると、Fluo-4 AMとFura-2 AMのデータセットのEC50推定値は、互いに有意差はなかった(P値=0.92)
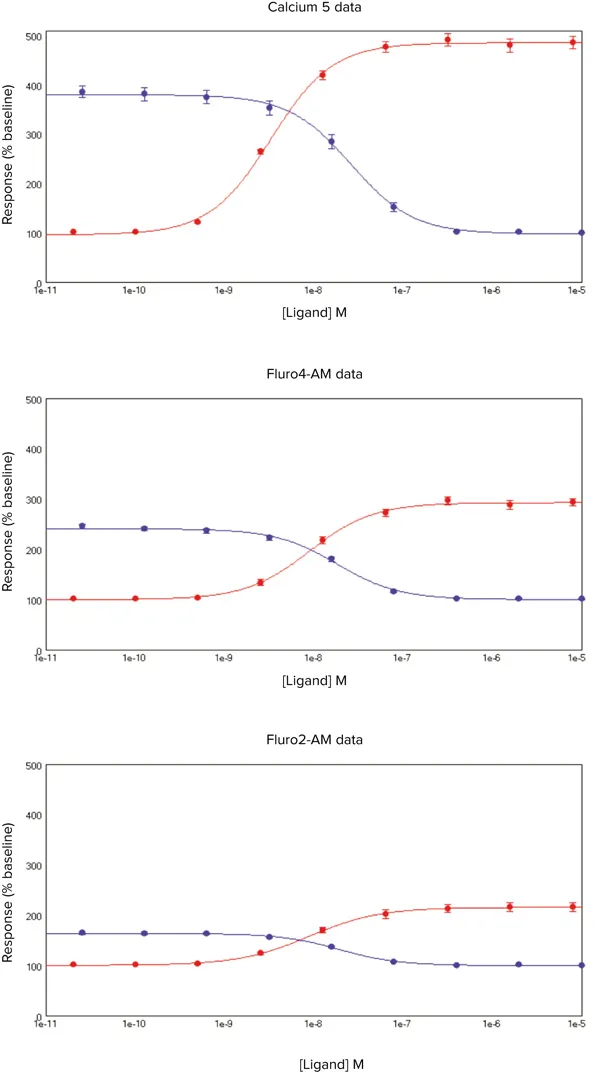
***図5. カルシウム5アッセイキットのデータ
SoftMax 6 Pro ソフトウェアによるプロット
-FLIPRカルシウム5アッセイキット、Fluo-4 AMおよびFura-2 AMを負荷した細胞のシグナル変化率(y軸)に対するACh(-)またはp-F-HHSiD(-)濃度(x軸)のプロット。データは平均値±s.e.m.。
しかし、FLIPR Calcium 5 Assay Kitでは、EC50値の有意な左方シフト(P < 0.05)、より高いZ'値、より大きな応答/ベースライン値(表5)が見られ、この「洗浄なし」アプローチがより最適であることが示唆された。
対照的に、p-F-HHSiDのデータは、計算されたpIC50値の間に無視できるほどの差があることを示唆しており、アンタゴニスト結合が異なるアッセイ調製法によって有意な影響を受けないことを示唆している(表5)。
シグナルのダイナミックレンジとアッセイのデータ変動を反映するスクリーニング係数ウィンドウ(Z'因子)は、緩衝液添加(陰性対照)とAChのEC80濃度(アゴニスト陽性対照)を用いて計算した。3つの色素すべてで得られたZ´因子は0.5以上であった(表5)。このことは、陰性対照と陽性対照の間に大きな分離帯があり、再現性のある高品質なアッセイ法であることを示している。しかしながら、FLIPRカルシウム5アッセイキットのデータは、他の2つのカルシウム指標よりも一貫してZ'値が高く、有意に大きな応答(%R/B)を示した。
| FLIPR カルシウム 5 測定キット | Fluo-4 AM | Fura-2 AM | |||||||
|---|---|---|---|---|---|---|---|---|---|
|
EC 50 /IC 50 |
% R/B | Z’ |
EC 50 /IC 50 |
% R/B | Z’ |
EC 50 /IC 50 |
% R/B | Z’ | |
| Acetylcholine |
3.1 x 10 -9 M |
485 |
0.81 |
7.9 x 10 -9 M |
294 | 0.58 |
3.7 x 10 -9 M |
215 | 0.63 |
|
p -F-HHSiD |
2.3 x 10 -8 M |
377 | 0.87 |
2.0 x 10 -8 M |
290 | 0.72 |
2.1 x 10 -9 M |
174 | 0.78 |
表5. FlexStation 3リーダーによるCHRM3細胞に3つの異なるカ ルシウムインジケーターを負荷した結果(n≧6)
結論
FlexStation 3 リーダーとFLIPR Calcium5 アッ セイキットの組み合わせにより、ムスカリンM3レセプター を発現している "Assay Ready "凍結CHO細胞の細胞内 Ca2+変化を最適に測定できることが示されました。デュアルモノクロメーターは、最適な励起および発光波長の選択を容易にし、単一波長および二波長のレシオメトリックインジケーターを使用することができます。
最近、凍結細胞が実行可能なアッセイ試薬として登場したことで、アッセイ開発とスクリーニングのプロセスがさらに合理化され、我々は、凍結細胞と継続培養細胞とのデータ品質上の利点を実証することに成功した。凍結細胞を使用するその他の利点として、消耗品、増殖培地、FTEリソースの大幅な節約が挙げられる。
細胞を手作業で洗浄していた旧世代のFlexStationリーダーで実施した同様の実験との比較から、AquaMax 4000 Cell Washerの使用がアッセイ品質の向上に寄与することが示唆された。
さらに、FLIPR Calcium 5 Assay Kit のような "洗浄なし "試薬を使用することで、FlexStation 3リーダーでのシンプルなアッセイ最適化とデータ忠実度の向上が可能であることを示した。
参考文献
- Zhang, J-H., Thomas, T.D.Y. and Oldenburg, K. R. (1999). A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J. Biomol. Screen., 4, 67–73.
- Schucht, R., Lydford, S., Andzinski, L., Zauers, J., Cooper, J., Hauser, H., Wirth, D. and May, T. (2011). Rapid Establishment of G-ProteinCoupled Receptor–Expressing Cell Lines by Site-Specific Integration. J Biomol Screen., 16, 323-331.
FlexStation 3マルチモードマイクロプレートリーダーの詳細はこちら>>
PDF版(英語)