Application Note スフェロイドの成長と形態の定量化
- 簡単な画像取得と解析技術で3Dスフェロイドを迅速に評価
- 集団レベルの情報を評価し、化合物の効果をより深く理解する
- 標識不要の技術を用いて生物学的相互作用を最小化
PDF版(英語)
はじめに
アンディ・バッシュフォード博士|フィールドアプリケーションサイエンティスト|モレキュラー・デバイス
マッテオ・カッタネオ博士|フィールドアプリケーションサイエンティスト|モレキュラー・デバイス
三次元(3D)細胞培養を用いてスクリーニングアッセイを開発する傾向が高まっている。一般的なアプローチは、細胞を細胞外マトリックス内で増殖させることで、隣接する細胞との相互作用を高め、より複雑な構造を形成させることである。ここでは、ヒト大腸癌細胞株に対する化学療法剤の細胞毒性を評価する簡便なアッセイについて述べる。この方法は、スフェロイドの増殖と肉眼的形態学的特徴を定量するための簡便かつ迅速なアプローチを提供する。蛍光核染色を用いて構造を検出し、CellReporterXpress® 画像取得・解析ソフトウェアを用いて解析することで、Summaryレベル(ウェルごと)とopulationレベルの情報を評価することができます。標識不要の解析は、アッセイ準備時間を最短にしたり、生細胞環境での増殖をモニターするためにも使用できます。
このアッセイは、ImageXpress® Pico自動細胞イメージングシステムを使用して自動化された方法で3Dスフェロイドを評価する、予備的な生細胞研究で使用される一般的なアプローチを示しています。このタイプのアッセイは、ImageXpress® Micro コンフォーカルハイコンテントイメージングシステム(1-3)のようなコンフォーカルイメージングシステムを使用して完了できる、より複雑なメカニズム研究に情報を提供するために使用することができます。
方法
- HCT 116細胞をマトリゲル中に播種し、96ウェルマイクロプレートに50μLの容積で1ウェルあたり4,000細胞ずつ播種した。ゲルを形成させた後、50μLの培地をゲルの上に加え、細胞を24時間増殖させた。
- セルを最終濃度3μMと100μMのエトポシドで処理し、72時間培養した。
- 培養物をホルムアルデヒドで室温で8時間固定した。
- 培養液をPBSで2回洗浄し、Hoechstで室温で6時間染色した。
- 培養液をPBSで洗浄し、プレートを密封してイメージングに備えた。
- 3D細胞イメージングをImageXpress Picoシステムで行い、DAPIおよび透過光チャンネルを使用した。10X対物レンズを用い、1ウェルあたり2部位を取得した。ハードウェアベースのオートフォーカスを使用して、10μm間隔で2つのz平面を取得した。DAPI画像は、CellReporterXpressソフトウェアを用いてベストフォーカス2Dプロジェクションで解析した。
- 標識不要の画像解析は、MetaXpress® ソフトウェアを使用して完了した。画像をMetaXpress® ソフトウェアにインポートし、カスタムモジュールエディターを用いて解析を設定した。
結果
スフェロイドのサイズと数に対する化合物の影響を評価
Z-スタック機能により、3Dマトリックス全体でスフェロイドを画像取得することができた。10倍の倍率により、視野あたり多数のスフェロイドを撮影することができた。画像は2D最大画像と最良面投影画像に圧縮され、保存スペースと解析時間を削減した。
DAPI核染色を用いて3Dスフェロイドを解析し、平均スフェロイドサイズと数を評価した(図1A)。エトポシドは用量依存的にスフェロイドの平均サイズを縮小させた。スフェロイドのサイズは小さくなったが、処理したウェルでは多数のスフェロイドが観察された(図1B)。高濃度のエトポシドでは、破片や単細胞が大量に発生したため、精度を高めるために、これらを分析から除外し、スフェロイドのみを定量した。
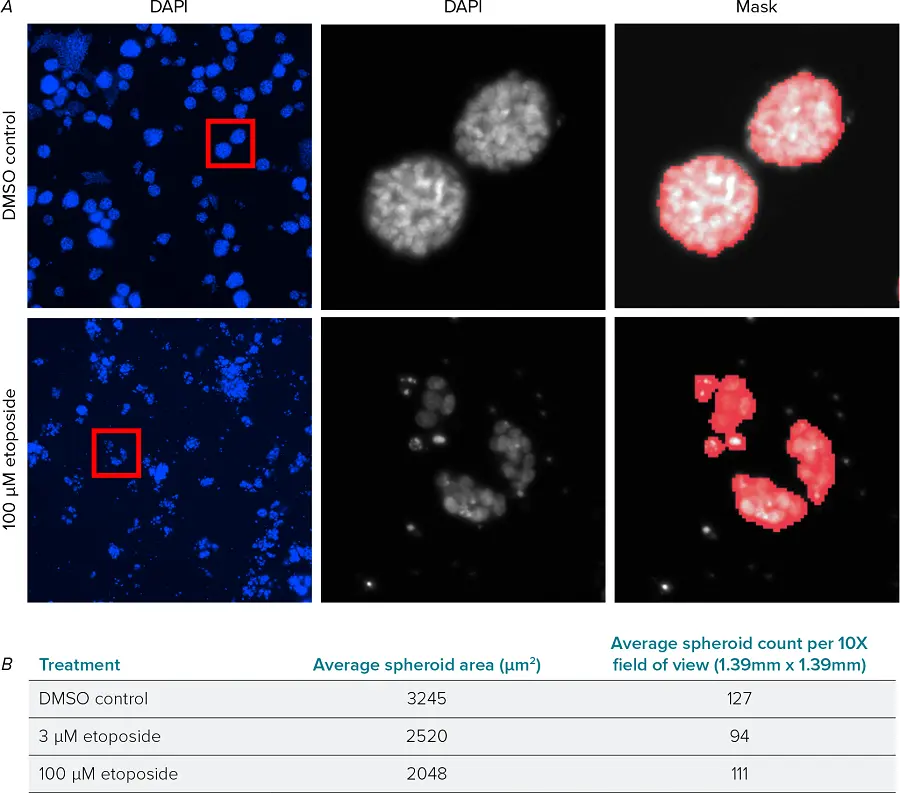
対物レンズデータを用いたスフェロイド集団の評価
スフェロイドごとのデータを、CellReporterXpress ソフトウェアを使ってレビューし、各ウェル内の集団をよりよく理解した。集団レベルの測定データも .csv としてエクスポートし、Microsoft Excel でさらに解析した。箱ひげ図(box plot)としてデータを可視化すると、各条件に、集団の外れ値である大きなスフェロイドがいくつかあることがわかった(図2A)。頻度プロットとしてデータを可視化すると、低濃度エトポシド、高濃度エトポシドともに、2500-5500μm2の大きなスフェロイドの数が減少した(図2B)。興味深いことに、高濃度のエトポシドは500-2000μm2の小さな構造体の数の増加も引き起こした。このことは、成長阻害が大きなスフェロイドサイズの減少に関与している可能性を示唆しているが、高濃度の化合物では細胞死とスフェロイドの完全性の喪失がより大きな役割を果たしている可能性がある。
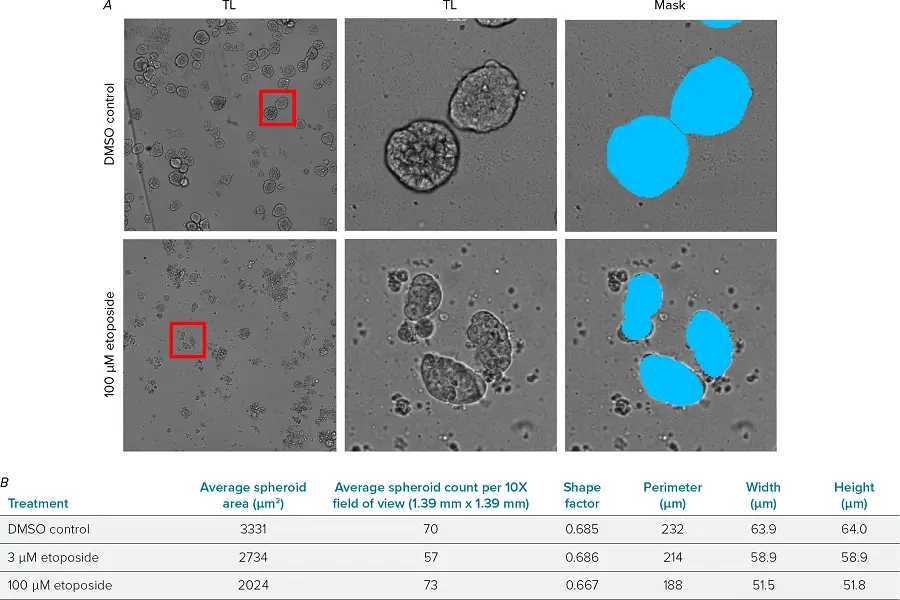
平均スフェロイド面積の測定値は、蛍光マーカー分析を用いて算出した値と非常によく似ていた。低濃度エトポシド(3 µM)は平均スフェロイド面積の減少を引き起こしたが、形状因子はDMSOコントロールと同じであった。高濃度エトポシド(100μM)のスフェロイドは小さく、形状因子の減少もわずかであったことから、スフェロイドの形状がより不規則であることが示された。このような標識不要の分析は、固定と染色の必要性をなくし、実験室でのアッセイを迅速かつ容易にする。また、生細胞培養に用いて、経時的な成長や形態の変化を追跡することも可能である。
結論
蛍光ベースまたは標識不要の分析法を用いて、スフェロイドの成長と形態を評価する簡便な方法を示した。このアッセイは、化合物処理に反応してスフェロイドのサイズが用量依存的に減少することを示した。このイメージング・プロトコールは、マルチウェルプレートでのセットアップと自動化が容易であり、3D細胞培養から迅速かつ簡便な読み出しを必要とする多くの状況に適用できる。また、ライブセル実験で3D培養をモニターするために使用できる標識不要分析の能力も示している。このような研究は、Zスタック、Digital Confocal* 2D on-the-fly deconvolution、"discontinuous time-lapse "などの取得機能を備えたImageXpress Picoシステムで簡単に行うことができます。後者は、ユーザーがシステムからプレーティングを取り外し、ライブセル実験を長時間行うために必要なときだけ戻すことを可能にします。
発表されたデータは、低濃度の化合物による増殖阻害から、高濃度の化合物による細胞死とスフェロイドのインテグリティの喪失への移行を示唆している。作用機序をよりよく理解するためには、ImageXpress® Micro Confocalシステム(1-3)のようなシステムを用いて、体積的3次元構造を解析し、細胞成分を定量化する高度な実験を行うことができる。この2つのシステムを組み合わせることで、ユーザーはアッセイの複雑さを必要なアッセイの出力に合わせることができる。
参考文献
- アプリケーションノート:腫瘍モデルにおける毒性測定のためのマルチパラメーターイメージングアッセイ
- アプリケーションノート:がん治療薬スクリーニングのためのスフェロイドのハイスループット共焦点イメージング
- アプリケーションノート:ヒトiPSC由来神経細胞培養物を用いた3Dマトリックスにおける神経細胞発生の形態学的特性評価のためのハイコンテントアッセイ
補足的な取得と分析方法
スフェロイドの成長と形態の定量化-化合物スクリーニングのための迅速でシンプルなアプローチ
プレーティングセットアップ
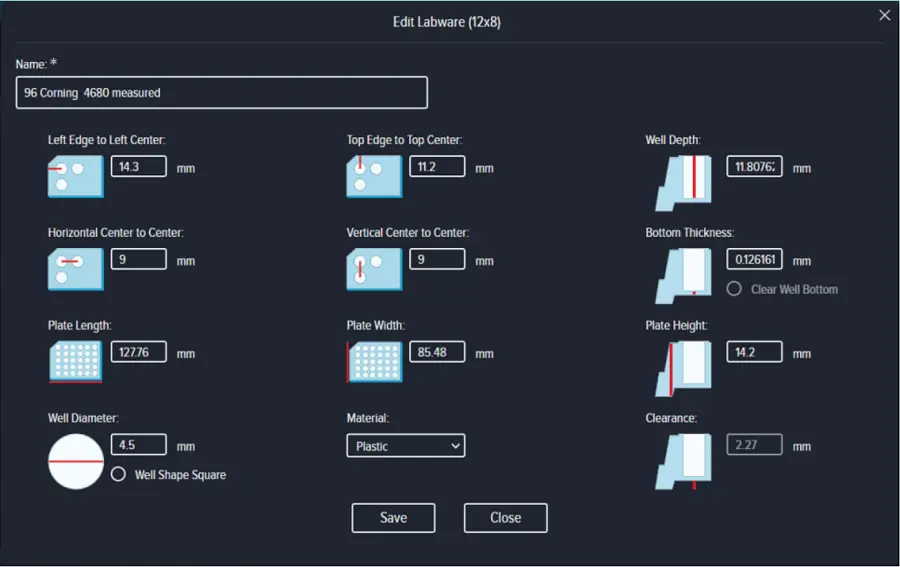
実験開始前に、細胞増殖に使用する同じバッチの空のマイクロウェルをImageXpress Picoシステムに挿入し、Measure Plate Dimensionsオプションを使用してウェル深さ、底厚、プレートクリアランスを設定した。残りのプレート寸法は、製造元の文書に従って記入した(図 S1)。
取得
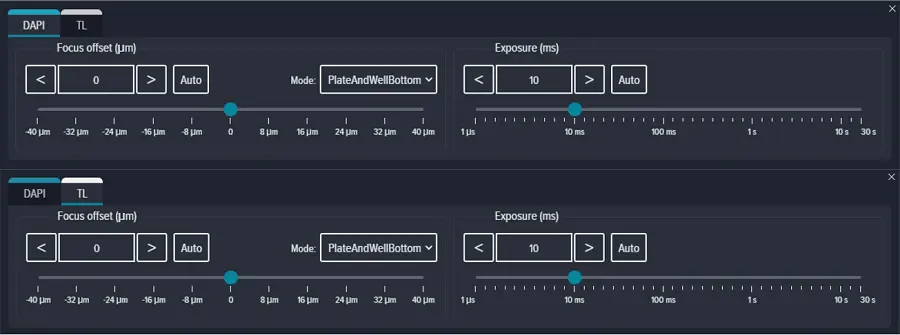
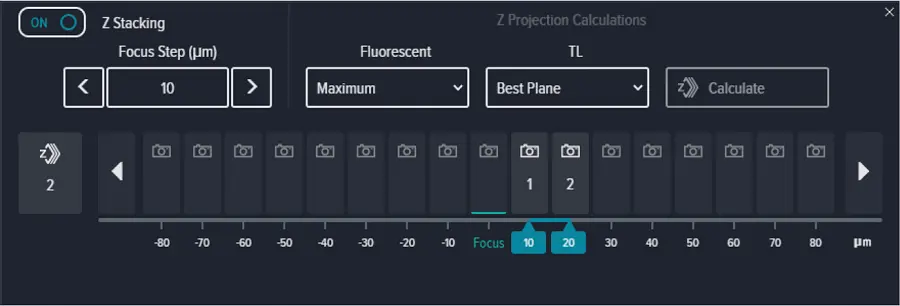
Focus methodを'PlateAndWellBottom'に設定し、Focus offsetを0 μmに設定し、ExposureをDAPIおよび透過光ともに10 msに設定した(図S2)。Zスタック画像取得を有効にし、Focus Stepを10μmに設定した2平面のスタックを、ウェルの底から+10および+20の位置で取得した(図S3)。蛍光チャネルと透過光チャネルには、それぞれ最大投影と最良平面投影を選択した。
CellReporterXpress による分析
まず、Plate Annotation ツールを用いて、プレートに化合物と濃度をアノテーションした。
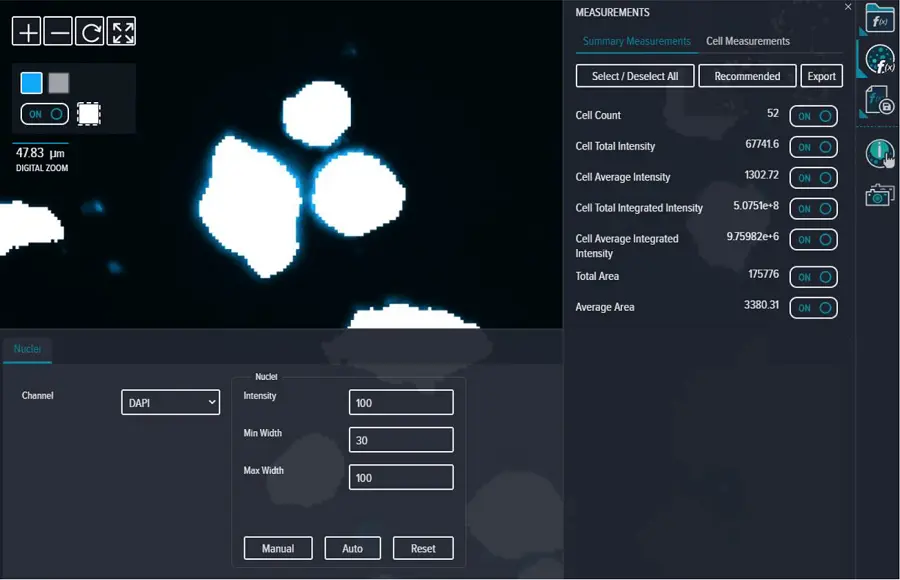
蛍光 DAPI イメージは、CellReporterXpress ソフトウェアの Cell Count 解析(蛍光強度 = 100、最小幅 = 30、最大幅 = 100)を用いて解析した。すべての Summary と Cell Measurements は「ON」に選択した(図 S4)。
分析はプレート全体に対して実行され、対物レンズデータは「.csv」形式でエクスポートされた。このデータをMicrosoft Excelで開き、Box Plotと度数分布を用いて母集団情報を表示した。
MetaXpress解析
Export Experiment Images ツールを用いて、CellReporterXpress ソフトウェアからフルサイズの'.tif' フォーマッ トとして、整理されたフォルダ構造で画像をエクスポートした。
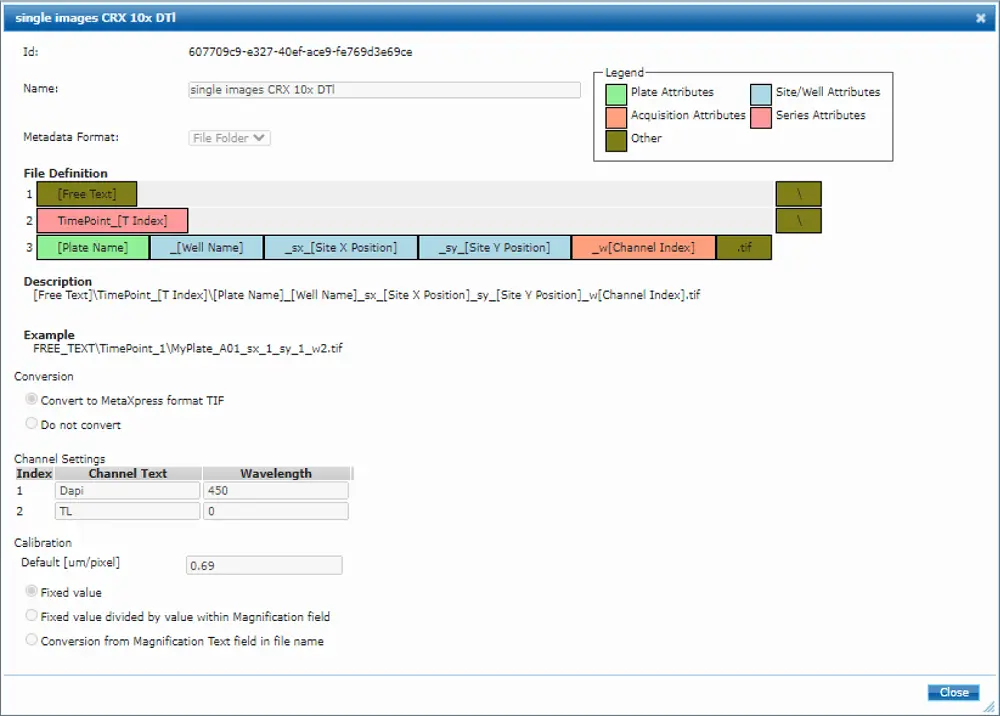
画像は MDCStore Xchange ツールとフォルダ構造と命名規則を認識するテンプレートを使用して、MetaXpress® ソフトウェアにインポートした(図 S5、テンプレートはリクエストに応じて提供可能)。
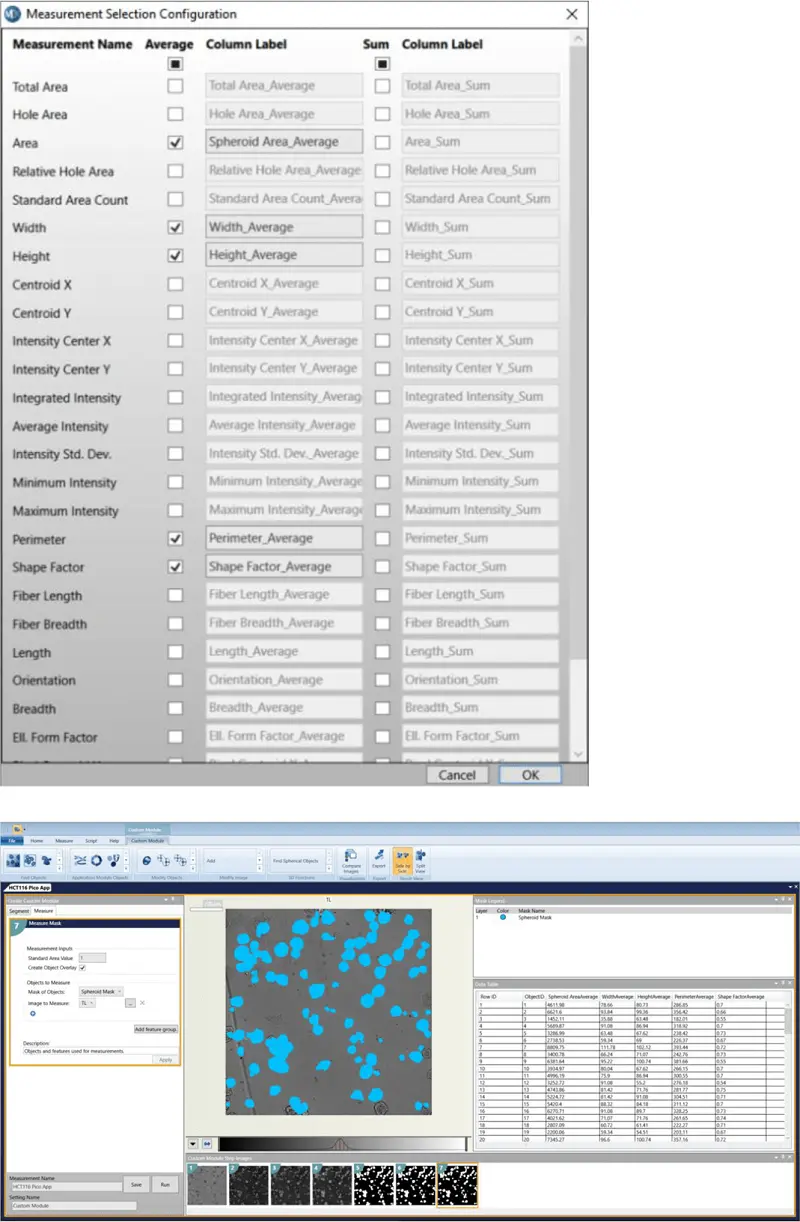
透過光画像をカスタムモジュールエディターで解析した。構造を認識し、エッジに接触しているものを除去するモジュールが設計された(カスタムモジュールのダウンロードリンクは下記を参照)。解析はプレート全体に対して実行された。
カスタムモジュールの手順
- HBasinThreshold = 1800
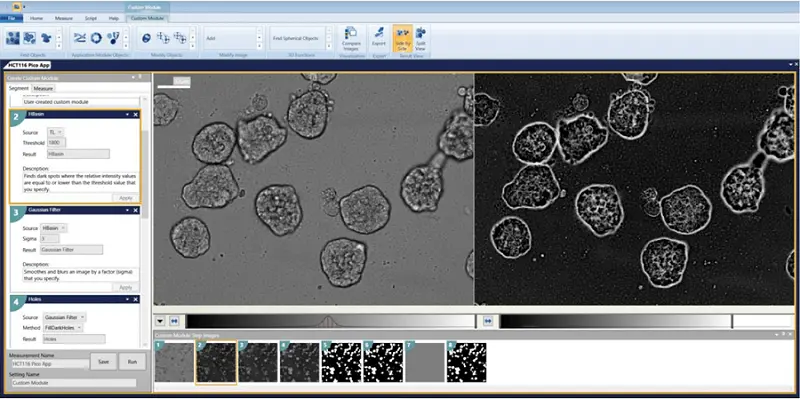
- ガウシアンフィルタ σ = 3
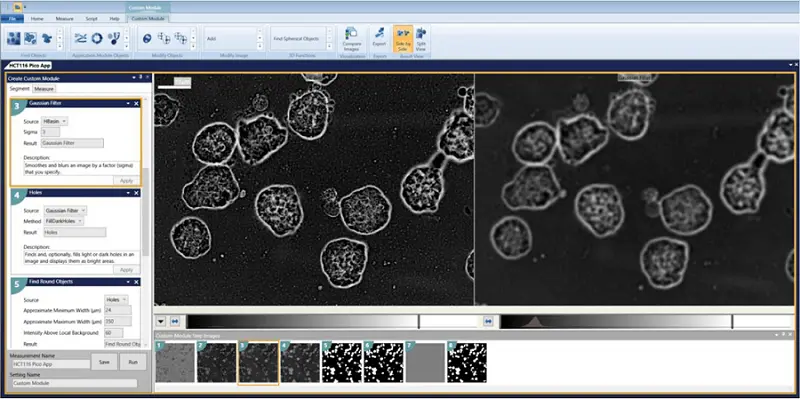
- 穴 = FillDarkHoles
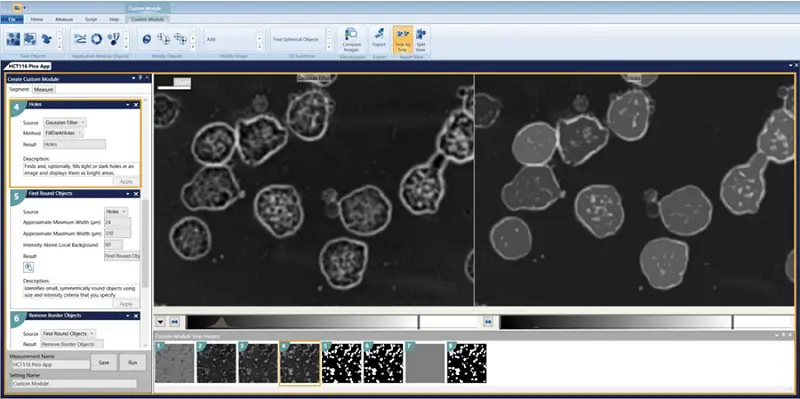
- 真円性レンズの検索 最小幅 = 24 最大幅 = 350 ローカルバックグラウンドより上の強度 = 60
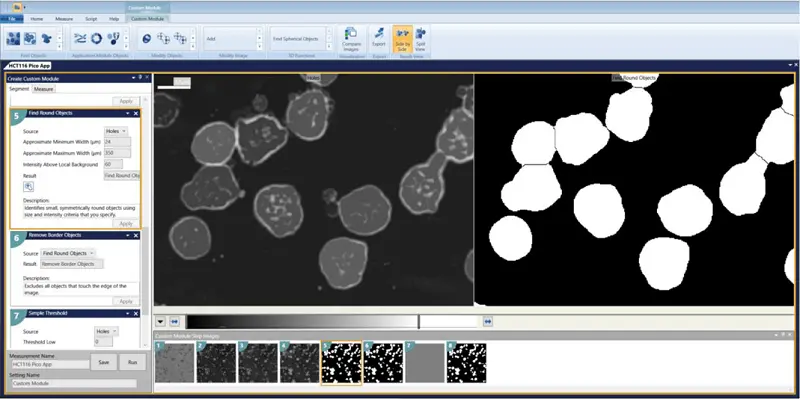
- 対物レンズの除去
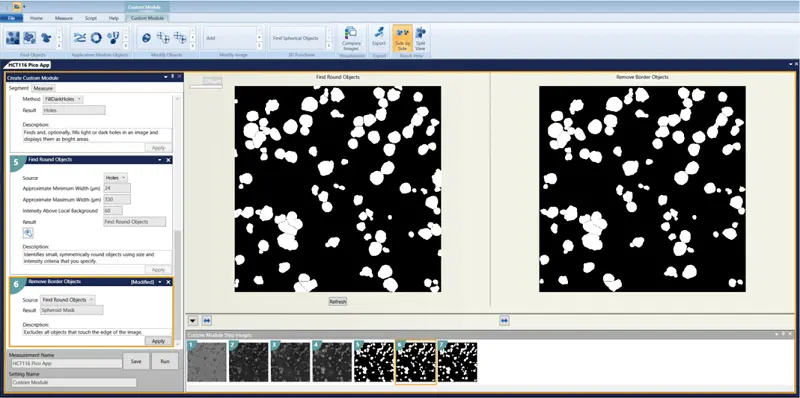
- 選択する寸法: 面積、幅、高さ、周囲長、形状係数
*ImageXpress Picoデジタルコンフォーカルは、AutoQuant 2D リアルタイムデコンボリューションを使用しています。
PDF版(英語)