Application Note 自動化された細胞イメージングと解析を用いて
GPCR活性化を定量化する
PDF版(英語)
はじめに
GPCRはシグナル伝達を行う膜貫通タンパク質の最大のグループであり、タンパク質コードゲノムの約4%を占める。GPCRは、感覚入力(味覚、嗅覚、視覚)への応答から細胞成長、心臓血管や免疫系の調節まで、幅広い生物学的経路において不可欠な役割を果たしている。また、自己免疫疾患、がん、代謝性疾患、心血管疾患、神経疾患など、さまざまな疾患にも関与している。リガンドに対して高い特異性と親和性を示す能力を持つGPCRは、創薬にとって極めて重要な標的である。さらに、相互作用するリガンドがまだ発見されていないGPCRであるオーファン受容体とみなされるGPCRもまだ多く存在する。
自動化されたイメージングと解析は、GPCR研究とスクリーニングのための貴重なツールである。ImageXpress® Nano(IXN)自動イメージングシステムとCellReporterXpress(CRX)自動画像取得・解析ソフトウェアによる高解像度の細胞内・細胞外画像の取得と解析は、粒状性、タンパク質凝集、GPCR活性化の定量化など、実施可能なアッセイの領域を拡大します。一般的にGPCRのスクリーニングは、受容体結合、グアニンヌクレオチド結合、セカンドメッセンジャーアッセイ1が中心で、GPCRと相互作用するGタンパク質(Gs、Gi/o、Gq、G12、Gtransducin)の知識が必要とされる。TransfluorアッセイはGタンパク質に依存しないアッセイで、脱感作の共通経路(図1)を利用して、既知および希少なGPCR、その機能、リガンドをスクリーニングする。このアッセイでは、目的のGPCRの遺伝子を過剰発現させ、蛍光タグを付けたß-アレスチンを発現するように遺伝子工学的に操作したセル株を用いる。
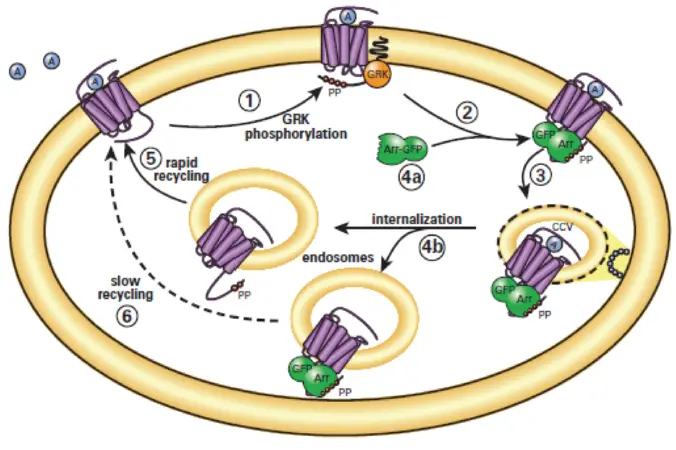
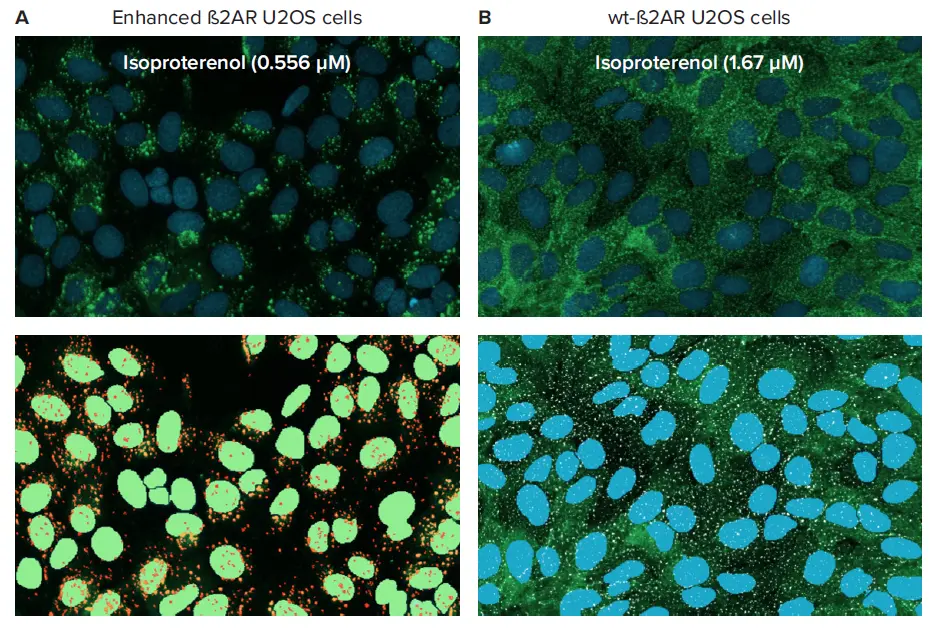
実験では、強化型および野生型(wt)の ß-2-アドレナリン受容体(ß2AR)と ß-アレスチン2-GFP(ßarr2-GFP)を発現する U20S 細胞をモデル系として用いた。wt-β2ARは小さな蛍光ピットを可視化するために用いた。強化された細胞株では、β2AR-βarr2-GFP 複合体は、受容体が形質膜から より大きなクラスリンク小胞に侵入する際に持続する(図 2)。どちらの細胞タイプも、β2ARに選択的なβシンパソミメティックであるイソプロテレノールで処理した。
材料
- Transfluor Assay Kit(Molecular Devices社製); Transfluor® Evaluation kit R8177 または R8178(Molecular Devices社製)
- ß-arrestin 2-GFP (ßarr2-GFP) ß-2-アドレナリン受容体 (ß2AR) 発現 U2OS セル (Molecular Devices)
- U2OS培地 MEM(Gibco Cat.#11095)に10%熱不活性化FBS(Gibco Cat.#10082)、10 µg/mLゲンタマイシン(Gibco Cat.#15710)、10 mM HEPES(GibcoCat.#11344)、0.4 mg/mL Zeocin(GibcoCat.#R250)、および0.4 mg/mL G418(GibcoCat.#10131)を加えたもの
- アッセイ希釈バッファー(飢餓培地): 血清、フェノールレッド、抗生物質を含まないMEM(Gibco Cat.
アスコルビン酸添加アッセイ希釈バッファー:スターベーション培地中のアスコルビン酸(L-アスコルビン酸ナトリウム、Sigma Cat. - イソプロテレノール原液: (-)-イソプロテレノール(+)-酒石酸塩(Sigma Cat. #I2760)の細胞培養グレードDMSO(Sigma Cat. #D2650)中の5 mMストック溶液。
- Hoechst 33342、10 mg/mL(Invitrogen Cat.)
- 塩化カルシウムおよび塩化マグネシウムを含まないDPBS(Sigma Cat.)
- 4%メタノールフリーホルムアルデヒド:16%メタノールフリーホルムアルデヒド(Polysciences Cat.#18814-20)を塩化カルシウムおよび塩化マグネシウムを含むDPBSで希釈したもの(Gibco Cat.)
- ImageXpress Nano自動イメージングシステムとCellReporterXpress自動画像取得・解析ソフトウェア(Molecular Devices社製)。
方法
強化型β2ARと野生型β2ARのU2OS細胞を、384ウェルクリアボトムマイクロプ レートに、50μLのU2OS培地中に1ウェル当たり7,000個プレーティングした。細胞を37℃、5% CO2で一晩培養し、細胞を増殖させ、ウェルの底に接着させた。24時間の培養後、培地をアッセイ希釈バッファー(ADB;MEM培地+10mM HEPES)に交換し、37℃、5%CO2で45~60分間の血清飢餓を行った。セルが血清飢餓状態にある間に、ADB(MEM培地+10mM HEPES、1mg/mLのアスコルビン酸を封入)で2Xイソプロテレノール溶液を調製した。血清飢餓後、細胞をイソプロテレノールの1:3希釈系列で処理し、最終1X濃度は5μMから6.27pMまでとした。その後、セルを37℃、5% CO2で30分間インキュベーターに入れた。10μLの1μL/mL Hoechst 33342溶液を細胞に加え、さらに30分間インキュベーターに戻した。イソプロテレノール処理は60分間続いた。
その後、各ウェルから培地を吸引し、細胞を50μLの4%ホルムアルデヒド溶液で固定した。プレーティングは、暗所、室温で30分間固定液に浸した。
固定後、細胞を50μLのPBSで2回洗浄し、10mMのアスコルビン酸を封じ込め た50μLのPBS中に保存した。プレーティングはImageXpress NanoシステムとCellReporterXpressソフトウェアを用いて画像化した。Vesicles and Pits解析モジュールを用いて、画像取得中に細胞内小胞とピットを定量した。
画像取得と解析を組み合わせることで、アッセイ結果を迅速に得ることができる。
マイクロプレート全体を20X Plan Fluor対物レンズでイメージャーし、蛍光サブセルラー顆粒を可視化した(図2)。小胞は、その大きさと蛍光強度の明るさでピットと区別された。小胞形成が促進された β2AR U2OS 細胞は、1 視野で最大 600 個の細胞を撮影し、小胞の数について統計的に適切な結果が得られたため、1 部位でイメージングした。野生型ピット形成β2AR U2OS細胞は、4つの視野で最大2,600個の細胞をとらえ、ピット計測の統計的精度を高めるため、4つの部位でイメージングした。細胞は2つのイメージングチャンネルでイメージングした。DAPIはHoechstで染色された核を、FITCはGFPを発現するß2AR-ßarr2-GFP小胞とピットをイメージングした。プリセットされたプレート定義とレーザーおよび画像ベースの自動オートフォーカスは、2つのチャンネルのフォーカスオフセットの最小限の調整で、高品質の画像フォーカスを迅速に見つけるのに役立ちました。適度な露光時間(FITCは200ms、DAPIは40ms)により、迅速な画像取得が可能であった。
ピットと小胞を別々に識別するために使用されるサイズと強度のパラメーターは、事前に定義された解析モジュール "Pits and Vesicles "内でインタラクティブに決定されました。小胞とピットの総数と平均数、小胞とピットの総面積、GFPの平均強度と積分強度など、細胞ごとまたはイメージングごとに報告されるユーザー選択可能な定量的出力は、細胞に対するイソプロテレノールの影響を徹底的に評価することを保証した。ユーザーは、画像取得中にその場で画像を解析することも、後で評価するために画像のプレートを取得して保存することもできます。
化合物処理細胞の用量反応曲線の作成
GPCRのリガンド活性化をモニターするTransfluorアッセイの有効性を示すため、βアドレナリン受容体アゴニスト活性を持つエピネフリンの類似体であるイソプロテレノールでenhancedおよびwt-β2AR U2OS 細胞を処理した。イソプロテレノールの濃度が高くなるにつれて小胞とピットの形成が増加し、細胞あたり形成されるピットと小胞の平均数で測定すると、両細胞タイプで明確な用量反応が認められた(図3と4)。用量-反応曲線の4パラメータlog-logカーブフィット処理から算出したイソプロテレノール処理のEC50値は、enhanced ß2AR U2OS細胞では0.002μM、wt-ß2AR U2OS細胞では0.012μMであった。
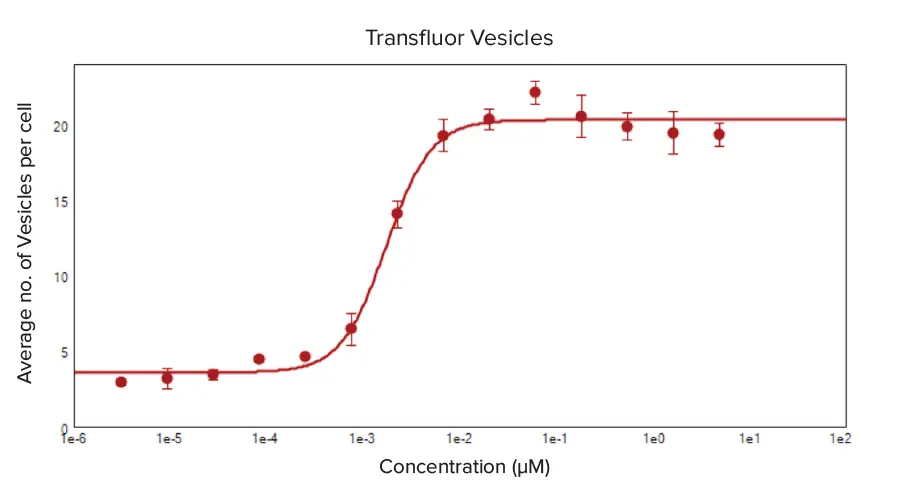
図3. イソプロテレノール処理により細胞あたりに形成された小胞の平均数に対する用量反応曲線。亢進したβ2AR U2OS細胞は、イソプロテレノールの1:3連続希釈液(5μM-6.27pM)で処理すると、β-アレスチン-GFPエンドサイトーシス小胞を形成した。CellReporterXpressソフトウェアのPits and Vesicles解析で、用量依存的な小胞形成を解析した。細胞あたりの平均小胞数の4パラメータカーブフィットをイソプロテレノールの濃度に対してプロットしたところ、EC50値は0.002μMであった。
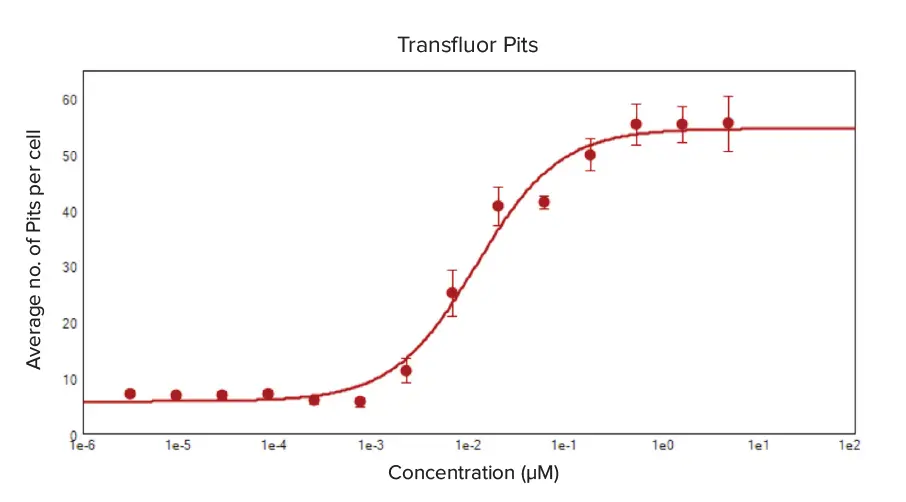
図4. イソプロテレノールで処理した ß2AR-wt U2OS 細胞におけるピット形成の用量反応曲線。野生型β2AR発現U2OS細胞をイソプロテレノールで4重処理し、緑色蛍光のβ2AR-ßarr-2-GFPピットを発現させた。CellReporterXpress の Pits and Vesicles 解析モジュールは、ピットの位置を特定し、カウントするために最適化された。細胞あたりの平均ピット数をソフトウエアの解析アルゴリズ ムで計算し、特異性イソプロテレノール濃度ごとに4重ウェルから 得たデータを平均して4パラメータカーブフィットの用量反応曲線を作 成した。イソプロテレノールのEC50値は0.012μMであった。
結論
ImageXpress Nano自動イメージングシステムとCellReporterXpressソフトウェアにより、Transfluor U2OS細胞の形態学的および表現型の変化に対するβ2ARリガンドの影響を評価することに成功した。高解像度の画像取得と同期したマルチパラメーター画像解析の組み合わせにより、トランスフルオールアッセイの結果を効率的かつ正確に解析した。CellReporterXpressソフトウェアの定義済みPits and Vesicles解析モジュールは、活性化されたβ2AR GPCRへのβ-arrestin-GFPトランスロケーションによって形成されたピットと小胞を明確に同定し、定量化した。非常に有益で生物学的に関連性の高い表現型データを生成することで、自動イメージングシステムとソフトウェアは、リガンドとGPCRの関係の発見を可能にする。
参考文献
- Doucette, Christopher, Kevin Vedvik, Elizabeth Koepnick, Aaron Bergsma, Brian Thomson, and Tammy C. Turek-Etienne. "Tango™ß-アレスチンリクルート技術によるκオピオイド受容体スクリーニングとセカンドメッセンジャーアッセイによるヒットの特性評価" Journal of Biomolecular Screening 14.4 (2009): 381-94. Web.
- Fennell, Myles. Transfluor Assay Development. 16 Sept. 2006. FLIPRユーザーミーティング. http://support.moleculardevices.com/pdfs/Fennell_Wyeth.pdf
PDF版(英語)