Application Note SpectraMax Plus 384マイクロプレートリーダーを使用したワイン中の残糖測定
- ワインサンプル中の分析物を直接定量
- 従来のシングルチューブ法に比べてスループットが向上
- SoftMax Proソフトウェアによる結果の自動計算
PDF版(英語)
はじめに
リンゴ酸、残糖、揮発性酸度、アンモニアの分析は、ワイン生産中の品質管理において非常に重要である。マイクロプレートフォーマットで実施される酵素アッセイは定量的であり、時間と労力の点でハイスループットを達成するのに役立つ。残糖アッセイでは、分析物が酵素的に変換され、副産物としてNADPHが得られます。340nmの吸光度を測定してNADPH生成を測定することで、ワインサンプル中の分析物を直接定量することができます。ここでは、Molecular Devices SpectraMax® Plus 384マイクロプレートリーダーとSoftMax® Proソフトウェアを使用して、ワイン中の残糖の酵素測定のデータを効率的に収集および解析する方法について説明します。
SpectraMax Plus 384マイクロプレートリーダーのユニークな機能の一部を紹介します:
- 波長範囲: 190-1000 nm、1 nm刻み、フィルター不要。
- 測定速度:96ウェル:9秒
- 384ウェル:29秒
- 温度 周囲温度より4℃高い温度から45℃まで
- キュベットポート: 標準キュベットおよび12 x 75 mm試験管を収納可能
- OD範囲 0-4 OD
ワイン中の残糖(RS)の酵素測定
酵素反応
(1) グルコース + ATP
![]()
グルコース-6-リン酸+ADP
(2)フルクトース+ATP
![]()
フルクトース-6-リン酸+ADP
(3)フルクトース-6-リン酸
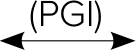
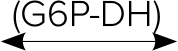
グルコース酸-6-リン酸 + NADPH + H+
HK:ヘキソキナーゼ
PGI ホスホグルコースイソメラーゼ
G6P-DH:グルコース-6-リン酸
デヒドロゲナーゼ
反応ダイナミクス
このアッセイは、ワイン中の2つの主要な糖、グルコースとフルクトースを測定する。NADPHの生成はグルコース-6-リン酸の酸化と化学量論的に関連しているので、グルコース+フルクトースの測定は340 nmにおけるNADPHの吸光度によって決定することができる。
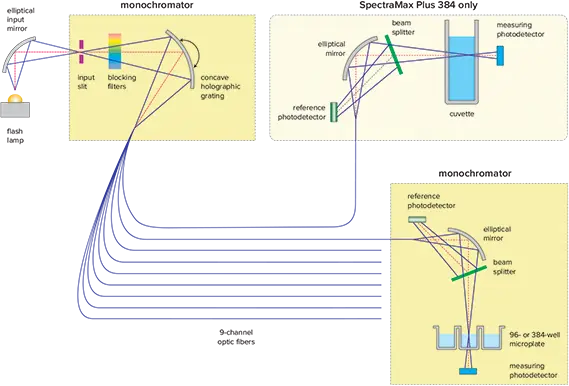
図1. SpectraMax® Plus 384光学系。
PathCheck®センサー
PathCheck®センサーは、マイクロプレートウェル内のサンプルの光路長を測定する、Molecular Devicesの温度に依存しない機能です。マイクロプレートウェルの吸光度を1cmキュベットの吸光度に正規化する画期的な方法です。
ランベルト・ベールの法則では、吸光度 = E * C * Lとなります。
ここで
E = 吸光度(消衰係数)
C = 濃度
L = 光路長
キュベットの場合、光路は水平なので、光路長は固定され、1cm に等しい。しかしマイクロプレートの場合、光路は垂直である。したがって、図2に示すように、光路長は試料の体積に依存する。

図2. キュベットとマイクロプレートでは経路長が異なる。
SoftMax® Proソフトウェア
このソフトウェアは、インストゥルメンテーションの制御、データの収集、完全なデータ解析を行います。適切なインストゥルメンテーション設定と計算を含むカスタムプロトコルを事前に作成し、保存することができます。エンドユーザーは、設定済みのプロトコルを開くだけで、プロトコルのセットアップに時間をかけることなく、完全な結果と解析を得ることができます。

図3. ワイン中の残糖(RS)の測定。
材料
- SpectraMax Plus 384 マイクロプレートリーダー(Molecular Devices 社、商品番号 PLUS 384)
- UV透過96ウェルマイクロプレート(Corning cat.)
- トランスファーペットマイクロピペット(Drummond Scientific cat. #Drummond Digital Microdispenser cat. #3-000-510)
- マイクロピペット用マイクロチップ (Eppendorf cat. # epT.I.P.S. Reloads 022491539, 022491512, 022491547)
- マイクロフュージチューブ用遠心機(Eppendorf cat.)
- 容量1.5mLのマイクロフュージチューブ(Eppendorf cat.)
- D-フルクトース(フィッシャーサイエンティフィック社製 cat.)
- ヘキソキナーゼ/グルコース-6-リン酸デヒドロゲナーゼ 30 mg(10 mL、Roche cat.)
- ホスホグルコースイソメラーゼ 10 mg/mL (Roche cat. #10128139001)
- ポリビニルピロリドン (Fisher Scientific cat. #BP431-100)
- TRIS (アムレスコ社製 cat. #0497-500G)
- MgSO4 - 7H2O (フィッシャーサイエンティフィック cat. #M63-500)
- ATP(Boehringer Mannheimのcat. #10519987001)
- NADP(Boehringer Mannheimのcat. #10240354001)
- 1.0M塩酸(フィッシャーサイエンティフィック社、商品番号SA431-500)
フルクトース標準物質の調製
試薬を溶解するまで撹拌した。決定係数(R)=1.000 の標準曲線が得られる標準品は、1.5 mL の凍結チューブに入れ、-4℃で保存した。試薬が古すぎると理想的な標準曲線が得られない場合があります。
| 濃度 | 0.1 g/100 mL | 0.2 g/100 mL | 0.4 g/100 mL |
|---|---|---|---|
|
DI H 2 O |
95 mL | 95 mL | 95 mL |
|
D-フルクトース |
0.1 g | 0.2 g | 0.4 g |
|
ボリュームをもたらす |
100 mL | 100 mL | 100 mL |
表1. フルクトース標準物質の調製
RS緩衝液の調製
ポリビニルピロリドン(PVP)2.0 g、TRIS 3.0 gおよびMgSO4 - 7H2O 0.5 gを400 mLビーカー中の350 mLの脱イオン(DI)H2Oに加えた。この溶液のpHを1.0 M HCl(≈36 mL)で7.6に調整した。さらに、この溶液にATP 0.15 gとNADP 0.175 gを加え、メスフラスコで500 mLに調整した。緩衝液は4℃で保存した。
RS測定用ワインサンプルの処理
必要に応じて、表2に従ってワインサンプルを純水で希釈した。濁ったサンプルは、希釈前または希釈後、分析前に遠心分離またはフィルタリングした。純水1:10で希釈したサンプルには、1:10で希釈した4.0 g/100 mLの標準物質を添加した。純水1:100で希釈した試料には、1:100で希釈した10.0 g/100 mLの標準液を添付した。
| 測定限界 | 希釈 | サンプル量 |
|---|---|---|
| 0.01~0.4 g/100 mL | 希釈不要 | 5 µL |
| 0.4-1.0 g/100 mL | 希釈不要 | 5 µL |
| 1.0-4.0 g/100 mL | 1:10 希釈 | 5 µL |
| 4.0-40.0 g/100 mL | 1:100 希釈 | 5 µL |
表2. RS測定用ワインサンプルの処理。
方法
ステップ1:ブランク、標準品、サンプルを二重測定した。
| 試薬ブランク | バッファー 300 µL | 純水 5 µL |
|---|---|---|
| スタンダード | バッファー 300 µL | スタンダード 5 µL |
| サンプル | バッファー 300 µL | サンプル 5 µL |
ステップ2:D-フルクトース標準物質を冷凍庫から取り出し、室温まで温めた。
ステップ3:標準品とサンプルの分析に必要な量の緩衝液を専用の「RS」ビーカーに計り取り、室温に温めた。このステップは、理想的な決定係数を得るために必要である。
ステップ4:ホスホグルコースイソメラーゼ(PGI)酵素を、表3の値に従って緩衝液に添加した。PGIは、酵素を変性させないように穏やかに、しかし十分にバッファーに混合した。
| 必要バッファー量 | PGI添加量 |
|---|---|
| 10 µL | 14 µL |
| 50 µL | 28 µL |
| 100 µL | 56 µL |
| 150 µL | 84 µL |
| 200 µL | 112 µL |
表3. 反応バッファー量あたりのホスホグルコースイソメラーゼ必要量の計算。
ステップ5:300μLのマルチチャンネルピペットを用いて、各ウェルに300μLのバッファーを分注した。
ステップ6:5µLのDI H2O、標準品またはサンプルを適切なウェルに分注した。
ステップ7:試薬を上下にピペッティングして混合した(トリチュレーション)。
ステップ8:プレートを30秒間ボルテックスして混合し、吸光マイクロプレートリーダーで最初の吸光度を測定した。
ステップ9:最初の読み取り値の直後に、1~20 µLのマルチチャンネルピペットを用いて各ウェルに5 µLのHK/G6P-DHを分注した。
ステップ10: プレートを30秒間ボルテックスして混合し、室温で21分間インキュベートした。
ステップ11:21分間のインキュベーション後、マイクロプレートリーダーの同じインストゥルメンテーション設定で「最終」読み取りを行った。
インストゥルメンテーションのセットアップ
インストゥルメンテーションはSoftMax Proソフトウェアでプログラムした。設定はソフトウェアのプレートセクションで調整した(図4)。表4にRSアッセイに使用したインストゥルメンテーション設定を示す。図4は波長設定と "PathCheck "選択のスクリーンショットである。
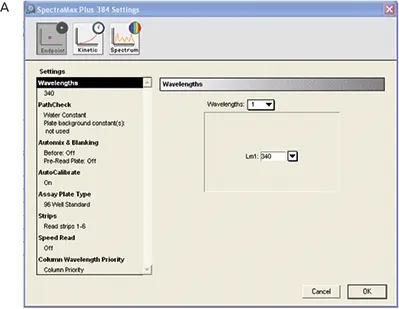
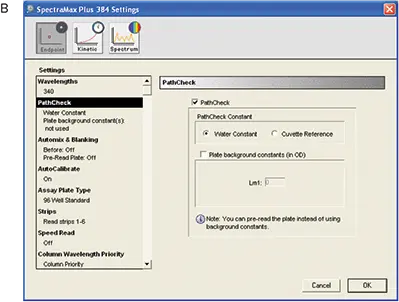
図4. RS アッセイ用のインストゥルメンテーション設定。A:全体的な設定、B:PathCheck®センサーの設定。
| パラメータ | 設定 |
|---|---|
| 読み取りタイプ | エンドポイント測定 |
| 波長 | 340 nm |
| PathCheck | PathCheck選択、Water Constant(プレートバックグラウンド定数なし) |
| オートミックス&ブランキング | オフ |
| オートキャリブレーション | オン |
| アッセイプレートタイプ | 96ウェルスタンダード |
| ストリップス | 必要に応じて選択 |
表 4. RSアッセイインストゥルメンテーションの設定
同じプレートセクションを2つ作成した。最初のプレートセクションは、すべての試薬を含むが酵素を含まないプレートの読み取りを行った。2番目のプレートセクションは、酵素を用いた実際の反応である。最初のプレートセクションから読み取った光学濃度は、還元設定により2番目のプレートセクションの光学濃度から差し引かれた。
RS測定用テンプレートのセットアップ
標準品とサンプルをマイクロプレートのウェルに配置するためのテンプレートがソフトウェアで設定されました。テンプレートのレイアウトはフレキシブルなので、サンプルやレプリカを簡単に追加することができます。最初のプレートにはテンプレートを設定しませんでした。最終プレートでは、標準品と未知検体が割り当てられました。各標準物質の濃度は、ウェルをクリックしてボックスに適切な濃度を入力することで割り当てた。範囲は0-0.4 g/100 mLであった(図5)。
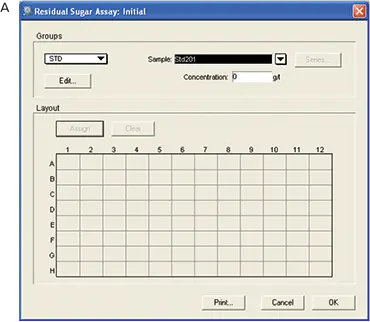
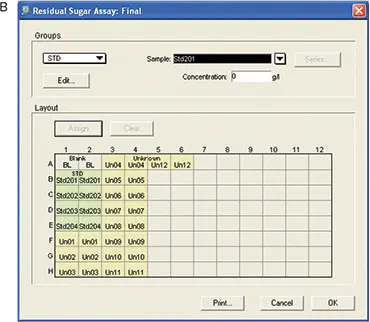
図5. RSアッセイ用テンプレートのセットアップ。A: 初期プレート-テンプレートはセットされていない。B: 最終プレート-プレート、標準品、未知検体を含むテンプレート。
還元反応のセットアップ
最終プレートでは、実際に酵素を反応させた。初期プレートの光学濃度測定値は、還元設定により最終プレートの光学濃度測定値から差し引かれた(図6)。したがって、プレートブランクは使用しなかった。プレートブランクは品質管理のために実験に組み込まれた。
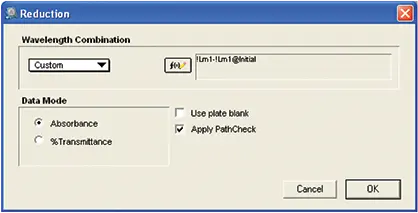
図6. データの削減。最終プレートの同じウェルの光学濃度から初期プレートの各ウェルの光学濃度を差し引くために使用されるカスタム式を示す縮小セットアップ。計算にはPathCheck®センサーの値が適用された。
結果
実験は「材料と方法」のセクションに記載されているように実施した。酵素を除く反応混合物の全成分を封じ込めたプレートで、ベースラインの読み取りを行った(図7、パネルA)。反応混合物に酵素を添加した後、プレートを室温で 21 分間インキュベートし、最終的な読み取りを行った(図 7、パネル B)。
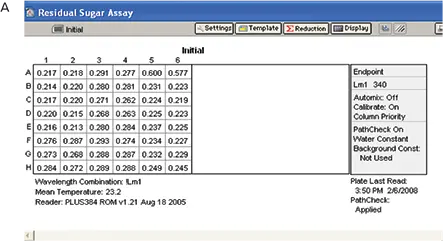
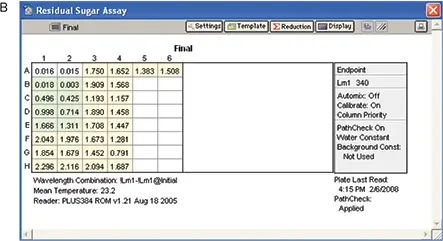
図7. RSアッセイの結果。A: すべての試薬を添加し、酵素を添加しなかったプレーティング。B:酵素を添加し、インキュベートした後のプレーティング。
SoftMax® Proソフトウェアは、標準物質の平均、標準偏差、%CVを自動的に計算し、結果をグループセクションに表 示しました(図8)。
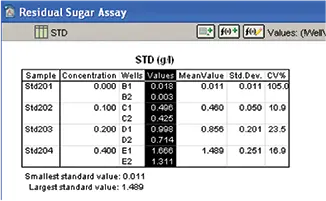
図8. 標準の計算。平均、標準偏差、%CV の計算を伴うグループセクション標準。
標準曲線
グループセクション "STD "の情報を用いて、X軸に濃度、Y軸に反復試料の平均OD値をとり、標準曲線を作成した(図9)。標準偏差はエラーバーとして使用され、線形カーブフィット処理がプロットに割り当てられた。この標準曲線は、"Unknown "と表示されたワインサンプルの残糖濃度の測定に使用された。
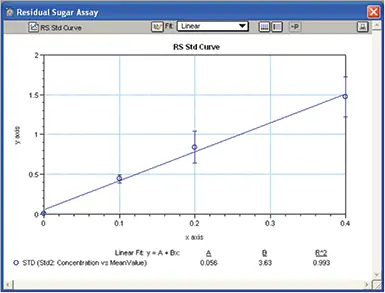
図9. RS測定標準曲線。標準曲線をプロットし、ワインサンプル中の残糖濃度の算出に使用。
不明」と指定されたグループセクションには、テンプレートで「不明」と指定された検体からのデータが自動的に入力された。
各サンプルの残留糖分は、標準曲線を用いてソフトウェアで計算された(図10および11)。
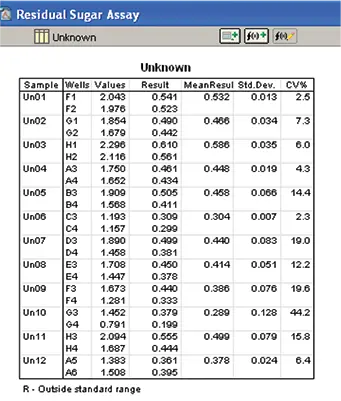
図10. ワイン試料中の残糖濃度の算出。標準曲線を用いてワイン試料中の残糖濃度を算出した。
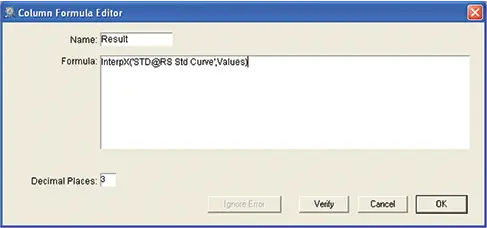
図11. 標準曲線を補間するためのカスタム式。標準曲線から内挿法でワインサンプルの残留糖分を自動計算した「結果」列の計算式。
結論
SpectraMax Plus 384マイクロプレートリーダーは、ワイン中の残糖(RS)お よびリンゴ酸(ML)の酵素的定量測定に最適です。
以下のような利点があります:
- ワインサンプル中の分析物を直接定量
- 従来のシングルチューブ法に比べてスループットが向上
- SoftMax Proソフトウェアによる結果の自動計算
- コスト効率と時間効率が高い。
- SpectraMax Plus 384リーダーのチューナビリティとPectraCheck®センサー機能は、より高い精度と正確性を達成するのに役立ちます。
- SoftMax Proソフトウェアは、複雑で大規模なデータセットの解析や計算に便利なツールです。あらかじめ書き込まれたすぐに使用できるプロトコル、カスタムプロトコル、適切なグラフオプションを提供します。
- 吸光度検出モードを備えた他のMolecular Devices製リーダー(SpectraMax i3x マルチモードマイクロプレートリーダーなど)も、このアプリケーションに使用できます。
- スループットの向上が必要な場合は、Molecular Devices StakMax®マイクロプレート処理システムをSpectraMaxマイクロプレートリーダーと統合することで、20、40、50マイクロプレートのバッチ処理を自動化できます。
SpectraMax Plus 384マイクロプレートリーダーについて詳しくはこちら >>
PDF版(英語)