Application Note Quant-iT PicoGreen dsDNAアッセイキットによる
DNAの高感度蛍光定量
- 50pg/mLまでのDNAを高感度に蛍光定量
- 4桁以上のリニアダイナミックレンジ
- SoftMax Proソフトウェアの設定済みプロトコルで結果を簡単に解析
PDF版(英語)
はじめに
Joyce Itatani | Application Scientist | Molecular Devices
Cathy Olsen | Sr. Application Scientist | Molecular Devices
二本鎖DNAは通常、吸光マイクロプレートリーダーでDNA溶液の吸光度を260 nmで測定することにより定量される。しかし、この方法では、一般的な吸光マイクロプレートリーダーでは約250 ng/mLまでしか測定できない。次世代シーケンシングやDNA増幅産物の定量など、少量のサンプルを含む生物製剤のアプリケーションでは、より高感度な方法が必要とされる。サーモフィッシャーサイエンティフィック社のQuant-iT PicoGreen dsDNAアッセイキットはDNAに対する特異性が高く、従来の吸光度法の約1000倍の感度があります。製品マニュアルに記載されているように、マイクロプレートフォーマットでのこのアッセイのダイナミックレンジは、単一の色素濃度で250 pg/mLから1000 ng/mLです。ここでは、Molecular Devices SpectraMax®マイクロプレートリーダーとQuant-iT PicoGreenアッセイを用いることで、50 pg/mLという低濃度の二本鎖DNAを確実に測定できることを実証します。
アッセイの感度を最大にするためには、最適なExcitation波長とEmission波長を使用する必要があります。フィルターベースのプレートリーダーとは異なり、SpectraMax iD5 マルチモードマイクロプレートリーダーやその他のSpectraMaxリーダーのデュアルモノクロメーターでは、リーダーの指定範囲内で任意の波長を選択できます。フィルターベースプレートリー ダーやキットマニュアルで推奨されている波長とは多少異なる場合があるため、アッセイに最適な感度とダイナミックレンジを提供する励起および発光波長を決定することが重要です。
材料
- Quant-iT PicoGreen dsDNAアッセイキット(サーモフィッシャーサイエンティフィック社、商品番号P7589)
- 黒色96ウェルマイクロプレート(Greiner Bio-One cat.)
- ライトセーフブラックマイクロチューブ(Argos cat.)
- マイクロプレートリーダー(注:ここに記載されていないSpectraMaxリーダーもPicoGreenアッセイに同様の性能があります。)
⚪︎SpectraMax Miniマルチモードマイクロプレートリーダー(Molecular Devices P/N SMAX MINI AF)、蛍光フィルターキューブFL-535付き(Molecular Devices P/N 5089097)
⚪︎SpectraMax® iD5マルチモードマイクロプレートリーダー(Molecular Devices P/N #iD5)。
⚪︎pectraMax® i3x マルチモードマイクロプレートリーダー(Molecular Devices P/N #i3x)
⚪︎SpectraMax® M5マルチモードマイクロプレートリーダー(Molecular Devices P/N #M5)
⚪︎SpectraMax® Gemini™ EMマイクロプレートリーダー(Molecular Devices P/N #EM)
方法
インストゥルメンテーションとプロトコルのセットアップ
- マイクロプレートリーダーの電源を入れます。
- SoftMax® Proソフトウェアを起動し、ProtocolsドロップダウンメニューからPicoGreen蛍光プロトコルを開きます。
使用するSpectraMaxリーダーによっては、アッセイに最適な設定を入力する必要があります(表1を参照)。 - Settings(設定)]をクリックし、画面左側のオプションから[Wells to Read(読み取るウェル)]と[Assay Plate Type(アッセイプレートタイプ)]を選択します。
- Template(テンプレート)ボタンをクリックしてウィンドウを開き、マイクロプレートのウェル をあらかじめ設定されたテンプレートグループに割り当てることができます。ドロップダウンメニューを使用して、適切なテンプレートグループを選択します。PicoGreen 蛍光プロトコールには、Standards、Unknowns、Unknowns_NoDiln(希釈していないサンプルに使用)などのテンプレートグループがあらかじめ設定されています。あらかじめ設定されたテンプレートグループにウェルを割り当てることで、プロトコルのグループテーブルにマイクロプレート読み取り時に取得される対応するデータが入力されます。
アッセイの準備
このアッセイの方法は、QuantiT PicoGreen dsDNA 試薬とキットの製品情報シートに記載されている手順に従いますが、96ウェルマイクロプレートフォーマットに適合するようにアッセイ容量を2.0mLから200μLに減らします。
- TEバッファー中の濃縮DMSO溶液を200倍に希釈して、Quant-iT PicoGreen試薬の水性作業溶液を調製する(上記で調製)。
- 試薬がガラス表面に吸着する可能性があるため、ガラスではなくプラスチック容器での調製を推奨する。茶色または黒色のチューブを使用するか、ホイルで覆うなどして、溶液を光から保護する。この溶液は調製後数時間以内に使用する。
- DNA 標準曲線: dsDNAの2μg/mLストック溶液をTEで調製する。キットに付属のλDNAスタンダードをTEで50倍に希釈して2μg/mL溶液とする。
注:場合によっては、アッセイするDNAの種類に類似したDNAを用いてスタンダードカーブを作成することが望ましい場合があります。
| パラメータ | SpectraMax iD5/iD3 | SpectraMax i3x |
SpectraMax M5/M5e/M4/M3/M2/M2e |
SpectraMax Gemini EM/XPS |
SpectraMax Mini |
|---|---|---|---|---|---|
| 読み取りモード | 蛍光(FL) | 蛍光(FL) | 蛍光(FL) | 蛍光(FL) | 蛍光(FL) |
| 読み取りタイプ | エンドポイント | エンドポイント | エンドポイント | エンドポイント | エンドポイント |
| 波長 | 励起:485 nm 発光:535 nm |
励起: 490 nm バンド幅9 nm 発光:525 nm、 バンド幅15 nm |
励起: 490 nm 発光:525 nm、 Emission cutoff: 515 nm |
Excitation: 490 nm, Emission: 525 nm, bandwidth 15 nm: 490 nm |
蛍光フィルターキューブ: FL-535 (励起485 nm 、発光535 nm、 ダイクロイック508 nm) |
| プレーティングタイプと読み取り領域 | マイクロプレートと使用ウェルに基づいて選択 | マイクロプレートとウェルに基づいて選択 | 使用するマイクロプレートとウェルに応じて選択 | 使用するマイクロプレートとウェルに応じて選択 | 使用するマイクロプレートとウェルに応じて選択 |
| PMTと光学系 | PMTゲイン: 自動 積分時間: 200 ms リードハイト 使用されるマイクロプレートのために最大限に活用しなさい |
PMTゲイン: 該当なし 読み取りごとのフラッシュ数:10 リードハイト 使用されるマイクロプレートのために最大限に活用しなさい |
PMTゲイン: 自動 読み取りごとのフラッシュ数:10 |
PMTゲイン: 自動 読み取りごとのフラッシュ数:10 |
PMTゲイン: 自動 積分時間 400ミリ秒 リードハイト 使用されるマイクロプレートのために最大限に活用しなさい |
表1. SpectraMaxリーダーのインストゥルメンテーション設定。SpectraMax iD5、i3x、Miniリーダーの場合、リードハイト設定は使用するマイクロ プレートに合わせて最適化する必要があります。注:同様の性能を持つ他のリーダーもリストアップされています。
- 必要であれば、1ng/mLから1μg/mLまでのハイレンジ標準曲線を作成してもよいし、25pg/mLから25ng/mLまでのローレンジ標準曲線を作成してもよい。ハイレンジ曲線またはローレンジ曲線では、1:10希釈液を使用することができます。低レンジ曲線では、2 μg/mL の溶液を 40 倍に希釈し、50 ng/mL の出発溶液を調製する。
- このアプリケーションノートでは、50 pg/mL から 1 μg/mL までの一連の標準液を 1:3 希釈系列として設定しました。
標準液を黒色96ウェルマイクロプレートに1ウェル当たり100μLずつ、できればトリプリケートでピペッティングする。TEのみを封じ込めた(DNAを封じ込めなかった)バッファーブランクウエルも必ず含める。 - 各ウェルにQuantiT PicoGreen試薬の水溶液を100μLずつ加える(この結果、ウェル内の標準液を1:2に希釈することになります)。トリチュレーションまたはプレートシェーカーでよく混ぜ、遮光して室温で 2~5 分間インキュベートする。
マイクロプレートを読み取る
- SpectraMax Mシリーズリーダーを使用する場合は、紫色のプレートアダプターが マイクロプレートリーダーの引き出しにあることを確認します。マイクロプレートをドロワーにセットします。
- SoftMax® ProソフトウェアのReadボタンをクリックします。
データの分析
- マイクロプレートの読み取りが完了すると、相対蛍光単位(RFU)がPlateセクションに表示されます。データは、テンプレートのセットアップ時に作成されたグループテーブルで分析されます。Group Tableの代表的なデータの例については、Table 2を参照してください。
- テンプレートで割り当てられた(したがってStandardsグループテーブルに表示された)標準物質は、プロトコルのStandard Curveセクションに自動的にプロットされます。デフォルトでは線形カーブフィットが適用されますが、広いダイナミックレンジの標準曲線をプロットする場合はlog-logフィットを使用することもできます。カーブフィット処理は、グラフセクションのドロップダウン・フィットメニューから選択します。
| サンプル | DNA濃度(ng/mL) | 平均RFU | 標準偏差 | パーセントCV |
|---|---|---|---|---|
| 1 | 1000.00 | 54893498 | 611149.3 | 1.1 |
| 2 | 333.333 | 17114392 | 685401.0 | 4.0 |
| 3 | 111.111 | 5884808 | 249140.5 | 4.2 |
| 4 | 37.037 | 1938706 | 21246.0 | 1.1 |
| 5 | 12.346 | 667849 | 10336.2 | 1.5 |
| 6 | 4.115 | 231812 | 9389.3 | 4.1 |
| 7 | 1.372 | 74577 | 4324.4 | 5.8 |
| 8 | 0.457 | 25963 | 2403.5 | 9.3 |
| 9 | 0.152 | 8981 | 1422.3 | 15.8 |
| 10 | 0.051 | 2441 | 1205.6 | 49.4 |
表2. DNAスタンダード。
結果
Quant-iT PicoGreen dsDNAアッセイキットとSpectraMaxリーダーを用いて、50 pg/mL~1 μg/mLのDNAスタンダードを検出した(SpectraMax iD5リーダーのデータを示すが、他のSpectraMaxリーダーでも同様の結果が得られた)。SoftMax® Proソフトウェアは、標準反復の各セットの平均RFU、標準偏差、%CVを自動的に算出した。SoftMax Proソフトウェアのlog-logカーブフィットを用いて標準曲線をプロットした(図1)。96ウェルマイクロプレートフォーマットで50 pg/mLまでの感度が観察され、標準検出限界はブランクの標準偏差の3倍であった。これはQuant-iT PicoGreenアッセイの製品添付文書に記載されている検出下限250pg/mLを大きく下回っています。図2はハイレンジ(A)とローレンジ(B)の標準曲線を示しています。直線性は、標準物質の範囲全体にわたって優れていました(各曲線についてr2≥0.99)。
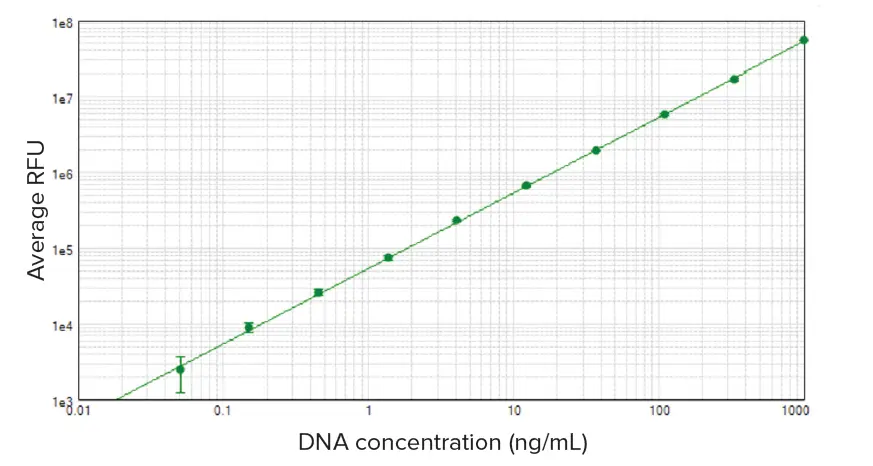
図1. DNAスタンダードカーブ。50pg/mLから1000ng/mLまでのDNAスタンダードをQuant-iT PicoGreen dsDNAアッセイキットを用いてSpectraMax iD5リーダーでアッセイした。標準曲線はSoftMax Proソフトウェアのlog-logカーブフィット処理を用いてプロットした(r2 = 1.00)。
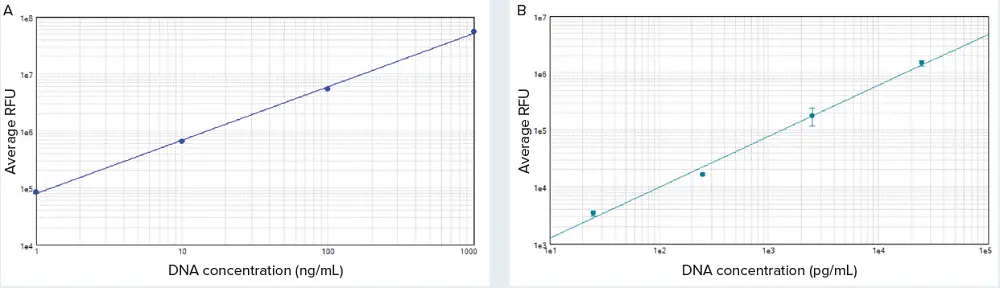
図2. ハイレンジ(A)とローレンジ(B)の標準曲線。曲線はSoftMax® Proソフトウェアのlog-logカーブフィットを用いてプロットした(両曲線、r2 = 0.99)。
結論
Quant-iT PicoGreen dsDNAアッセイキットをSpectraMaxマイクロプレートリーダーとSoftMax Proソフトウェアで実行すると、二本鎖DNAを迅速かつ高感度に検出できます。ソフトウェアの分析機能により、読みやすく、ユーザーがカスタマイズ可能なレポート形式で定量を行うことができます。ソフトウェアには設定済みのプロトコールが用意されており、迅速なアッセイセットアップが可能です。
PDF版(英語)