Application Note Spectramax® Gemini XS分光蛍光光度計を用いた安定で高感度な
蛍光ベースの環状AMP測定法
PDF版(英語)
はじめに
アビー・エスターマン、ジェイン・ヘズレー、アン・T・ファーガソン Molecular Devices Corporation
アデノシン3´, 5´-環状一リン酸(環状AMP、cAMP)は、細胞表面レセプターによって検出される細胞外環境の変化を核内の変化に結びつけ、遺伝子発現パターンの変化をもたらす普遍的な二次メッセンジャーである。バクテリア、粘菌、ミバエ、ヒトなど多様な生物において、細胞内および細胞間のシグナル伝達に関与している。環状AMPはアデニル酸シクラーゼ(AC)という酵素によってATPから産生され、環状AMPホスホジエステラーゼによって加水分解される。これらの酵素の活性化により、細胞内のcAMPレベルを厳密に制御することができる。
哺乳類では、ペプチドホルモンや神経伝達物質などの細胞外リガンドは、G共役受容体(GPCR)と呼ばれる膜貫通タンパク質と相互作用する。リガンドの結合は受容体の構造変化を引き起こし、GTP結合制御タンパク質(Gタンパク質)との結合を可能にする。G共役型受容体は、刺激型Gタンパク質であるGsと結合するとACを活性化し、抑制型Gタンパク質であるGiと結合すると酵素を阻害する。Gs共役型受容体が活性化するとcAMPの産生が増加し、環状AMP依存性プロテインキナーゼまたはPKAが活性化される。この酵素は様々なタンパク質をリン酸化し、最終的に転写因子の活性を調節し、遺伝子発現に影響を与える。PKAの標的には、他の酵素、イオンチャネル、転写調節因子などが含まれる1。1 さらに、cAMPは転写因子であるcAMP-responsive element-binding protein(CREB)、すなわちcAMP誘導性遺伝子の発現を調節する役割を果たすタンパク質と結合し、その活性を増強することによって、転写に直接的な役割を果たす。2
細胞の種類にもよりますが、このシグナル伝達経路は、神経や免疫応答、代謝、有糸分裂、卵子の成熟、ミバエの嗅覚、植物の受精や種子形成、その他多くの重要な機能を担っている可能性があります1-7。したがって、cAMPのレベルをモニターすることは、シグナル伝達経路の上流成分の作用機序の理解に役立ち、シグナル伝達経路を活性化または阻害する薬剤のスクリーニングとして使用することができます。
このアプリケーションノートでは、ヒト胚性腎臓細胞株 HEK 293 を用いて、フォルスコリンおよびイソプロテレノールによって誘導される細胞内 cAMP レベルの変化を調べるための、Molecular Devices 社製 SpectraMax® GEMINI XS 蛍光マイクロプレートリーダーの使用について説明します。これらの細胞は、新しい競合イムノアッセイであるCatchPoint™環状AMP蛍光アッセイキットの性能を調べるためのモデル系である。キットには、ヤギ抗ウサギIgG抗体でコートされた384ウェルマイクロプレートが2枚付属している(図1、ステップ1)。cAMP、cAMPキャリブレーター(標準品)または陰性対照を含む検体を、一次抗体およびcAMP-ホースラディッシュ・ペルオキシダーゼ(cAMP-HRP)結合体とインキュベートし、特異的な結合相互作用が起こるようにします(図1、ステップ2)。サンプルまたは標準品中の環状AMPはウサギ抗cAMP抗体と結合する際、cAMP-HRPコンジュゲートと競合します。
サンプル中のcAMP量が増加すると、マイクロプレートウェルの底に結合するcAMP-HRP結合体の量は減少します。未結合の結合体は、1回の洗浄操作でウェルから除去されます(図 1、ステップ2)。手順の最後のステップは、ウェルの内容物をStoplight Red™ 基質とインキュベートすることです。一次抗体に結合した cAMP が多ければ多いほど、ウェルに残る cAMP-HRP 結合体の量は少なくなり、SpectraMax Gemini XS 分光蛍光光度計で検出されるストップライト・レッドの蛍光シグナルは低くなります(図 1、ステップ 3)。これにより、図 3 の cAMP キャリブレーターに見られるような用量反応曲線が生成されます。
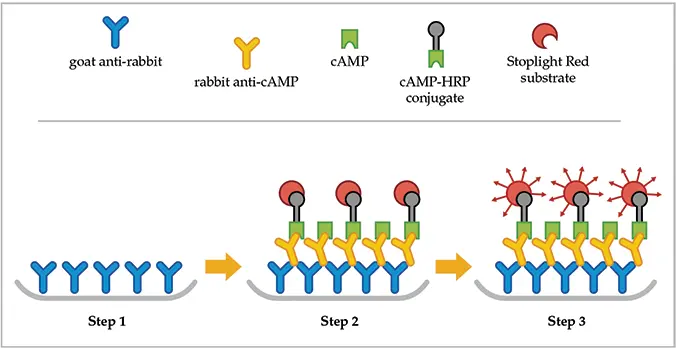
図1:CatchPoint環状AMP蛍光アッセイの原理。キットには、ヤギ抗ウサギIgG二次抗体がコートされたウェルを持つ384ウェルマイクロプレートが2枚付属している(ステップ1)。cAMPを含む細胞溶解液を作製し、マイクロプレートウエル中でウサギ抗cAMP抗体およびcAMP-HRPコンジュゲートとインキュベートし、すべての結合相互作用が液相で起こるようにする(ステップ2)。この基質は、HRPの存在下で過酸化水素により酸化され、適切な波長で励起されると赤色の蛍光を発する(ステップ3)。
材料
- セル HEK 293細胞(アデノウイルスE1Aタンパク質を安定的に過剰発現するヒト胚性腎臓細胞)。
- 試薬 凍結乾燥cAMPキャリブレーター、ウサギ抗cAMP抗体、HRP-cAMP結合体、Stoplight Red™基質を含むCatchPoint環状AMP蛍光アッセイキット(Molecular Devices, cat #R8044, Tel: 1-800-635-5577)。DMSO、低含水(Sigma、cat #D2650、Tel: 1-800-325-3010)、炭酸水素ナトリウム(Sigma, cat #S5761)、フォルスコリン(Sigma, cat #F6886)およびイソプロテレノール(Sigma, cat #I5627)を含むcAMPアゴニスト、ホスホジエステラーゼ阻害剤、3-イソブチル-1-メチルキサンチンまたはIBMX(Sigma, cat #I7018)および30%過酸化水素(H2O2)溶液(Sigma, cat #H0904)。
- マイクロプレート:コーティングされた384ウェル、黒色固形アッセイマイクロプレート(キットに付属)、384ウェル、透明、非滅菌ポリスチレンマイクロプレート(Greiner cat #78101、USA Scientificより供給、Tel: 1-800-522-8477)。
- 培地とバッファー Dulbecco's modified Eagles medium, DMEM (Irvine Scientific, cat #9031, Tel: 1-800-577-6097), 0.526 mM EDTA in PBS (Irvine Scientific, cat #9314), phosphate buffered saline, PBS (Invitrogen™ Life Technologies, cat #10010-023), Krebs-Ringer bicarbonate buffer (KRBG buffer) (Sigma, cat #K4002). Cell Lysis Buffer pH 7.3、cAMP Assay Buffer pH 5.8、10X Wash Solution はすべてキットに付属しています。
- Fetal bovine serum: (FBS) heat inactivated (Irvine Scientific cat #3003)。
試薬の調製
- セル増殖培地: 10%FBS添加DMEM
- KRGBバッファー: シグマ社の製品情報シートに、このバッ ファーの詳しい調製方法が記載されている。
- 800 mM IBMX:100mgのIBMXを563μLのDMSOに溶解する。20℃で保存する。IBMX は cAMP ホスホジエステラーゼによる cAMP の分解を阻害します。
- プレ刺激バッファー:KRGBバッファー10 mLに800 mM IBMX 9.4 µLを加える。IBMXが完全に溶解するように激しくボルテックスする。このバッファー は実験当日に新しく調製する。
- 10 mM イソプロテレノール:24.8 mg を 10 mL の蒸留水に溶解する。20℃で保存する。希釈液はPBSを用いて調製する。
- 10 mM フォルスコリン:10 mg を 2.4 mL の DMSO に溶かす。20℃で乾燥保存する。希釈液はPBSを用いて調製する。
- cAMPキャリブレーター:凍結乾燥キャリブレーター1バイアルを1.25mLのPBSに再溶解する。表2に示すように、cAMPアッセイバッファーでさらに希釈する。よく混ぜて溶解させる。氷上または4℃で2週間まで保存する。
- 凍結乾燥ウサギ抗cAMP抗体およびHRP-cAMPコンジュゲート: 凍結乾燥抗体およびコンジュゲート1バイアルを10mLのcAMPアッセイバッファーに溶解し、よく混和し、氷上または4℃で2週間保存する。
- 3% H2O2:30%H2O2溶液を脱イオン水で10倍に希釈する。
- 1X洗浄液:10X洗浄液を脱イオン水で10倍に希釈する。
- Stoplight Red溶液:22 mLのSubstrate Bufferに25 µLの3% H2O2を加えてStoplight Red溶液を調製する。よく混合し、220 µL の 100X Stoplight Red 基質を加えてStoplight Red溶液とする。この溶液はプレーティング直前に調製することが重要です。
方法
細胞の調製
HEK 293細胞をT-75フラスコ中、10%ウシ胎児血清添加DMEM中、37℃、5% CO2で約80%コンフルエンスまで増殖させた。
ステップ1 T-75フラスコ1本のセルをPBSで1回洗浄した後、PBS中0.526mM EDTA 3mLで37℃、5~10分間処理した。
ステップ2 剥離したセルをトリチュレートして単一細胞懸濁液とし、10% FBSを含む培地7 mLを封じ込めたチューブに移した。ヘマサイトメーターを用いて細胞をカウントするためにアリコートを取り出し、実験に利用可能な総細胞数を決定した。
ステップ3 細胞を卓上遠心機で1100rpm、5分間回転させ、KRBGバッファーで1回洗浄した。その後、細胞をPrestimulation Bufferに1 x 106 cells/mLの濃度で再懸濁した。
ステップ4 cAMPキャリブレーター標準曲線用に、384ウェル透明ポリスチレ ン製マイクロプレートの1ウェルを用意した。これらのウェルに7.5マイクロリットルの刺激前バッファーを加えた。他のウェルには、7.5μL/ウェル(7.5×103個/ウェル)の 容量でセルを播種した。
ステップ5 384ウェルマイクロプレートを室温で10分間インキュベートした。
アッセイ手順
ステップ1 cAMPキャリブレーターとアゴニストの希釈液を表1および表2に従って調製した。細胞を刺激してcAMPを産生させるため、7.5 µLの細胞を封じ込めたマイクロプレートのウェルに、15 µL量のアゴニスト(フォルスコリンまたはイソプロテレノール)またはPBS(陰性対照)を添加した。環状AMPキャリブレーター希釈液を、刺激前バッファーだけを含むウェルに加えた。各サンプルは8反復で行った。サンプルは穏やかに混合され、37℃で15分間、5% CO2でインキュベートされた。
| アゴニスト | 原液(pmol/mL) | 濃度(pmol/mL)1 |
|---|---|---|
| フォルスコリンまたは イソプロテレノール | 1,500,000 | 1,000,000 |
| 500,000 | 333,333 | |
| 50,000 | 33,333 | |
| 16,667 | 11,111 | |
| 5,555 | 3,704 | |
| 1,852 | 1,234 | |
| 617 | 411 | |
| 206 | 137 | |
| 20.5 | 13.7 | |
| 2.05 | 1.37 | |
| 0.205 | 0.137 | |
| 陰性コントロール(PBS) | 1X | |
表1: 細胞を用いた実験に使用したアゴニストの用量。1 細胞とアゴニストのみを封じ込めた22.5 µL容量中のアゴニストの濃度
| cAMPキャリブレーター | 原液(pmol/mL) | 濃度(pmol/mL)1 |
|---|---|---|
| 60,000 | 3333 | |
| 600 | 33 | |
| 200 | 11 | |
| 66.6 | 3.7 | |
| 22.2 | 1.2 | |
| 7.3 | 0.41 | |
| 2.4 | 0.14 | |
| 0.85 | 0.047 | |
| 0.29 | 0.016 | |
| 0.091 | 0.005 | |
| 陰性コントロール(PBS) | 1X |
表2: 標準用量反応曲線の作成に使用したcAMPキャリブレーターの用量。1 60µLアッセイ容量中の最終濃度。
ステップ2 細胞を溶解するため、7.5µLのCell Lysis Bufferをすべてのウェルに添加し、プレートシェーカーを用いてマイクロプレートを室温で10分間撹拌した。
ステップ3 マルチチャンネルピペッターを用いて、各ウェルから20µLずつ分注し、384ウェル黒色固形アッセイマイクロプ レートの別々のウェルに移した。アッセイプレートウェルのレジストレーションはポリスチレンプレートと同じにした。
ステップ4 再構成したウサギ抗cAMP抗体20μlをすべてのウェルに添加した。マイクロプレートをプレートシェーカーで5分間静かに撹拌し、適切なプレーティングを確保した。
ステップ5 再構成したHRP-cAMPコンジュゲート20μlをマイクロプレートの全ウェルに添加し、穏やかに混合した。その後、室温で2時間インキュベートした。
ステップ 6 インキュベーションが完了したら、アッセイマイクロプレートを 80μL/well の 1X Wash Buffer で 4 回洗浄しました。
ステップ7 Stoplight Red溶液を調製した。50μLのStoplight Red溶液をマイクロプレートの各ウェルにできるだけ速やかに添加した。マイクロプレートに蓋をし、遮光した。
ステップ8 10分後と60分後に、以下の設定で蛍光強度を測定した:
| モード | 蛍光 |
|---|---|
| 励起波長 | 530 nm |
| 発光波長 | 590 nm |
| 発光カットオフフィルター | 570 nm |
| 読み取り | 6 |
| PMT | オート |
表3:CatchPoint環状AMPアッセイ用のSpectraMax Gemini XS分光蛍光光度計の設定。
結果
励起およびエミッション波長の最適化
PBSで希釈したStoplight Red基質のサンプルで励起および発光スペクトルスキャンを行い、PBS単独で得られた蛍光シグナルと比較した。この手順を用いて、環状AMP蛍光アッセイに最適な励起・発光波長とカットオフフィルターを決定した(図2)。
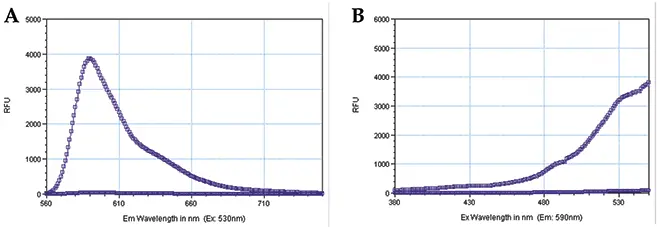
図2:Stoplight Redの励起および発光スペクトルスキャン。PMTを "auto"、キャリブレーションを "on"、ウェルスキャンあたり20リードに設定してスキャンを行った。四角のプロットはストップライト・レッドの溶液を表し、丸のプロットはPBSを表す。(A)励起波長を530 nmに固定し、発光波長のスペクトルスキャンを行った。観測された発光ピークは590nmであった。(B)発光波長を590nmのピークに固定し、励起波長のスペクトルスキャンを行った。約530nmに発生する大きなバックグラウンドピークの直前にこぶがあった。発光カットオフフィルターをテストした結果、570 nmのカットオフフィルターが最適であり、SB比は400であった。
アッセイ性能
環状AMPキャリブレーター曲線
cAMPキャリブレーターを封じ込めた試料から得られたデー タを解析した結果、図3に示すプロットが得られた。データは4パラメータカーブにフィット処理されました。この場合、C値(図3Aでは2.4 pmol/mL、図3Bでは3.7 pmol/mL)が曲線の中点、つまりEC50値となった。注目すべきは、10分後と60分後に読み取られたEC50値が同程度であったことで、蛍光シグナルが経時的に相対的に安定していることが示された。さらに、これらの値は、別の蛍光マイクロプレートリーダーAnalyst AD(3.4±0.6pmol/mL、製品添付文書参照)を用いて以前このキットで得られた値と一致していた。この実験を別の日に行ったところ、得られたEC50値は3.4 pmol/mLであり、このアッセイが再現性に関して高品質であることが改めて示された。SB比(キャリブレーターなし)は240で、検出限界(ゼロcAMPキャリブレーター対照からの3標準偏差差と定義)は0.1pmol/mL cAMPであった。アッセイの最適性能範囲は、検出可能なシグナルの最大値と最小値の間に位置する。これは0.14~33pmol/mLと決定された。
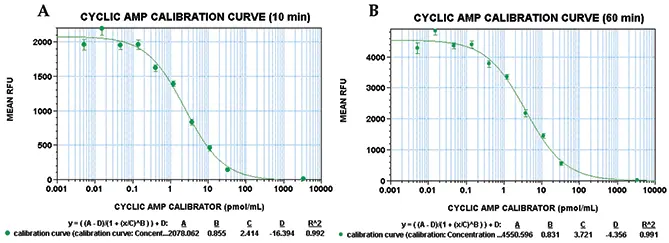
図3:cAMPキャリブレーターの用量反応曲線。StoplightRed基質添加後、(A)10分後、(B)60分後の用量反応を示す。用量反応曲線上の各ポイントは、8反復サンプルの平均を示す。エラーバーは平均からの標準偏差を示す。4パラメータカーブフィットのR2値は0.99であった。これらの実験で得られたcAMPキャリブレーターのEC50値は、10分および60分のインキュベーションでそれぞれ約2.4pmol/mLおよび3.7pmol/mLであった。RFUは相対蛍光単位を示す。
Z´因子の決定
Z´ファクター値を決定するために実験を行った。Z´ファクターの値が0.5~1.0であれば、スクリーニング目的に適した高品質でロバスト性の高いアッセイであることを示す8:
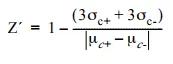
σc+は陽性対照の標準偏差、σcdenは陰性対照の標準偏差を表す。μc+-μc-|という用語は、陽性対照の平均値と陰性対照の平均値の差の絶対値を示す。この場合、最大阻害を達成したcAMPキャリブレーター濃度(33pmol/mL)を陽性対照とし、最小阻害を達成したcAMPキャリブレーター濃度(0.14pmol/mL)を陰性対照とした。分光蛍光光度計 SpectraMax Gemini XS を用いた CatchPoint cAMP 蛍光測定キットの Z´ factor は 0.84 であった。
フォルスコリンおよびイソプロテレノールに対するHEK 293細胞の反応
HEK 293細胞は、アデニル酸シクラーゼ活性の内因性レベルが低いため、cAMPの制御を研究するのに適したモデル系である9。HEK 293細胞を、0~1 mMの範囲のフォルスコリンまたはイソプロテレノールで処理した(図4、5)。イソプロテレノールはβアドレナリン受容体アゴニストである9-10。フォルスコリンで得られたEC50値は13μMで、これは他の製品で得られた値と同じである(NEN/Perkin Elmerの[FP]2™キット、ウェブサイト製品情報)。
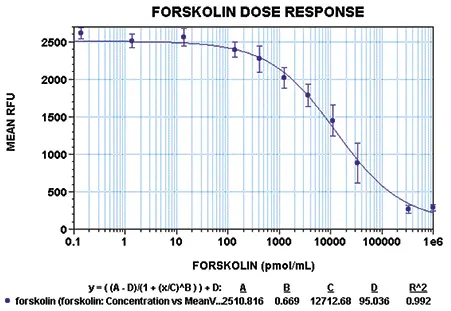
図4:フォルスコリン処理HEK 293細胞の用量反応曲線。用量反応曲線上の各ポイントは、活性化剤の1濃度に対する8反復サンプルの平均RFUを表す。このデータセットを読み取る前に、プレートをStoplight Red基質とともに60分間インキュベートした。エラーバーは平均からの標準偏差を示す。4パラメータカーブフィットを用いた実験のR2値は0.99であった。アデニル酸シクラーゼ活性化物質フォルスコリンの用量応答は、13μMのEC50値となった。
イソプロテレノールで得られたEC50値は82 nMであり、これは別の細胞株で得られた値と一致した(図5A10)。同じEC50値が、Stoplight Red基質と10分間インキュベートしただけで得られた(データは示さず)。ここでもまた、このアッセイの蛍光シグナルの安定性が裏付けられた。SOFTmax PRO®ソフトウェアを用いて、図3に示した標準曲線に対してデータを補間し、図5Bのグラフを得た。
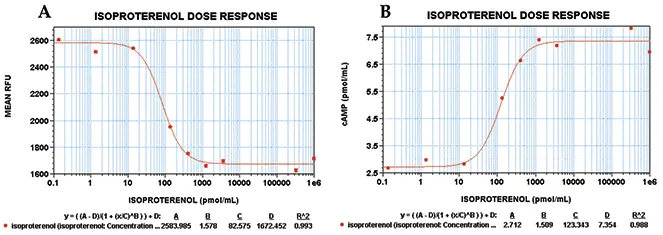
図5:イソプロテレノール処理HEK 293細胞の用量反応曲線。用量反応曲線上の各ポイントは、1濃度のアゴニストに対する8反復サンプルの平均RFUを表す。エラーバーは変動係数のパーセントを示す。両実験とも4パラメータカーブフィットのR2値は0.99であった。A)の用量反応曲線は、サンプルをStoplight Red基質とともに60分間インキュベートした後に得られた。(B)の曲線は、(A)のデータを図3に示す標準曲線で補間して得た。結果をRFUとcAMP濃度で比較すると、EC50値はそれぞれ82 nMと123 nMであった。
結論
Molecular Devices社のCatchPoint環状AMP蛍光アッセイキットとSpectraMax Gemini XS分光蛍光光度計は、基礎研究および医薬品開発を目的として細胞内cAMPの変化をモニターするための補完的なツールセットを提供します。シンチレーション・プロキシミティ・アッセイ(SPA)やラジオイムノアッセイ(RIA)のようなcAMP検出のための放射性メソッドと比較して、この蛍光ベースのアッセイは高速で、コストのかかる廃棄物のクリーンアップや除去が不要であり、少なくとも10倍の高感度である。具体的には、SPAの典型的な感度は非アセチル化型cAMPで2 pmol/mLであるのに対し、CatchPointアッセイキットでは0.1 pmol/mLである。さらに、CatchPointアッセイキットは蛍光偏光法によるcAMP測定(1.25pmol/mL)よりも約10倍感度が高い。
アッセイ完了のスピードと感度の点で、発光アッセイキットはCatchPoint環状AMP蛍光アッセイキットの4倍感度が低く、シグナル検出のための特別なインストゥルメンテーションも必要である。最後に、安定したシグナルに到達するのに必要なインキュベーション時間が短い(10分から24時間)ため、CatchPointアッセイキットはハイスループットスクリーニングに最適である(図3およびイソプロテレノールのデータ)。注目すべきことに、このキットは、繰り返し試験した際に得られたcAMPキャリブレーターのEC50値のZ´因子と再現性によって示されるように、高品質のスクリーニングアッセイを提供する。結論として、CatchPoint環状AMP蛍光アッセイキットは、簡便な手 順で、現在市販されている細胞内cAMP測定試薬の中で最も高 感度なものの一つである。
参考文献
- Weiner, R. I. and Charles, A. (2001). 環状AMPシグナル伝達経路によるゴナドトロピン放出ホルモン放出の制御。Growth Horm. IGF Res. 11: S9-S15.
- Mayr, B. M., Canettieri, G., and Montminy M. R. (2001). CREB結合リクルートメントに対するcAMPシグナルとマイトジェニックシグナルの異なる効果は、CREBを介した標的遺伝子活性化に特異性を与える。Proc. Natl. Acad. USA 98: 10936-10941.
- Monneret, G., Gravel, S., Diamond, M., Rokach, J., and Powell, W. S. (2001). プロスタグランジンD(2)は、新規DPレセプターを介して作用するヒト好酸球の強力な化学誘引物質である。Blood 98: 1942-1948.
- Zalatan, F., Krause, J. A., and Blask, D. E. (2001). 生理的メラトニンによるin vitroでのラット鼠径部脂肪細胞におけるイソプロテレノリン誘導性脂肪分解の、受容体を介したメカニズムによる阻害。Endocrinology 142: 3783-3790.
- Etgen, A. M., Ansonoff, M. A., and Quesada, A. (2001). 視床下部におけるノルエピネフリン受容体を介したシグナル伝達の卵巣ステロイド制御機構:女性の生殖生理学への示唆。Horm. Behav. 40: 169-177.
- cAMP伝達経路に影響を及ぼす変異がショウジョウバエの嗅覚を修飾する。(2001). J. Comp. Physiol. 187: 359-370.
- 花粉管の成長と方向転換において、cAMPは二次メッセンジャーとして働く。Proc. Natl. Acad. USA 98: 10481-10486.
- Zhang, J-H., Thomas, T.D.Y., and Oldenburg, K. R. (1999). ハイループットスクリーニングアッセイの評価とバリデーションに使用するシンプルな統計パラメータ。J. Biomol. Screening 4: 67-73.
- Hanoune, J., Pouille, Y., Tzavara, E. Shen, T. Lipskaya, L., Miyamoto, N., Suzuki, Y., and Defer, N. (1997). アデニル酸シクラーゼ:酵素スーパーファミリーの構造、制御および機能。Mol. Cell. Endocrinol. 128: 179-194.
- Cary, D. A., and Mendelsohn, F. A. O. (1987). 培養ウシ内皮細胞によるアンジオテンション変換酵素および環状AMP産生に対するフォルスコリン、イソプロテレノールおよびIBMXの効果。Mol. セル。Endocrinol. 53: 103-109.
Gemini XPS マイクロプレートリーダーについてさらに詳しく >>
PDF版(英語)