Application Note 蛍光を利用した安定で高感度な環状GMP測定法
PDF版(英語)
はじめに
Janet Daijo1 , Anne T. Ferguson1 and David Morton2* 1Molecular Devices Corporation, Sunnyvale, CA, USA. 2 オレゴン健康科学大学、オレゴン州ポートランド Email: mortonda@ohsu.edu
3´, 5´環状グアノシン一リン酸(cGMP)は、シグナル伝達経路における二次メッセンジャーであり、酵素グアニリルシクラーゼ(GC)によって産生される。環状GMPシグナル伝達は、平滑筋の弛緩、陰茎の勃起、腎機能、炎症反応など多くの生理的反応において重要である1, 2, 3。また、脊椎動物と無脊椎動物の光伝達には、グアニル酸シクラーゼ活性を制御するシグナル伝達経路が関与している4, 5。
本報告では、新しいcGMPアッセイ(CatchPoint™ cGMP蛍光アッセイ)を用いて、2つのモデル系でGC活性を測定した結果を示す。最初のモデル系は、心房性ナトリウム利尿ペプチド(ANP)6, 7というポリペプチドホルモンによるGCの活性化である。このホルモンは脊椎動物の多くの種に見られ、血圧上昇に反応して放出される。ANPは、腎臓からのナトリウムと水分の排泄を促し、血管平滑筋を弛緩させることによって血圧を下げる。我々は、ラット肺線維芽細胞株RFL-6におけるANPの活性を研究している。
二つ目のモデル系では、タバコの角虫Manduca sexta 8-10の中枢神経系に局在する新規GC、MsGC-β3の活性を研究している。NOによるヘテロ二量体形成と活性化を必要とする他の可溶性GCとは異なり、MsGC-β3は、COS-7細胞で単独発現させると高い基礎活性を示し、一酸化窒素存在下ではわずかな刺激しか示さないという点でユニークである9。
これら2つのモデル系でcGMPを測定するために使用されるcGMPアッセイは、Molecular Devices社のCatchPoint cAMP蛍光アッセイキット(cat #R 8044, R 8053、Molecular Devices社のウェブサイトのMaxLine製品ファミリーの文献ページ(www.moleculardevices.com/pages/literature.html)からダウンロード可能なMaxLineアプリケーションノート46も参照)と同じ原理に基づく競合イムノアッセイである。つまり、サンプル中のcGMP量が増加すると、蛍光シグナル出力は減少する。本レポートでは、本アッセイの高感度、高信頼性、簡便性を示す。
材料
- セル RFL-6ラット肺線維芽細胞(ATCC cat #CCL-192)は、20%ウシ胎児血清、グルタミン(2 mM)、ペニシリン(50 U/mL)およびストレプトマイシン(10 mg/mL)を添加したHam's F-12培地で増殖させた。COS-7サル腎臓細胞(ATCC cat #CRL-1651)は、10%FCS添加DMEMで培養した。
- 試薬 凍結乾燥cGMPキャリブレーター、ウサギ抗cGMP抗体、HRP-cGMPコンジュゲートおよびStoplight Red™基質を含むCatchPoint環状GMP蛍光アッセイキット(Molecular Devices、cat #R8074、96ウェルアッセイキット Tel: 1-800-636-5577)、炭酸水素ナトリウム(Sigma, cat #S5761)、ヒトANP(Sigma cat #A-1663)、ウシ血清アルブミン、BSA30%(Sigma cat #A9576)、ホスホジエステラーゼ阻害剤、3-イソブチル-1-メチルキサンチンまたはIBMX(Sigma, cat #I7018)、EDTAを含まない完全プロテアーゼ阻害剤(Roche Applied Science, cat #1836170、Tel: 1-800262-1640)および30%過酸化水素(H202)溶液(Sigma, cat #H0904)。
- マイクロプレート。コート済み黒壁透明底96ウェルマイクロプレート(キットに付属)、12ウェル透明組織培養処理マイクロプレート(VWR cat #29442-040、Tel:1-800-932-5000)。
- 培地とバッファー Ham's F-12 medium (Irvine Scientific, cat #9058, Tel: 1- 800-577-6097), DMEM (Irvine Scientific, cat #9031), fetal bovine serum (Irvine Scientific, cat #3000), glutamine pen-strep solution (Irvine Scientific, cat #9316), Krebs-Ringer bicarbonate buffer (KRGB buffer) (Sigma, cat #K4002), M-PER mammalian cell extraction reagent (Pierce, cat #78501, Tel: 1-800-874-3723)、リン酸緩衝生理食塩水、PBS(Invitrogen™ Life Technologies, cat #10010-023)。Cell Lysis Buffer (pH 7.3)、cGMP Assay Buffer (pH 5.8)、10X Wash Solution はすべてキットに付属している。
試薬の調製
| cGMP キャリブレーター | 3x 原液(nM) | 最終濃度(nM) 1 |
|---|---|---|
| 10,000 | 3333 | |
| 100 | 33 | |
| 33 | 11 | |
| 11 | 3.7 | |
| 3.7 | 1.2 | |
| 1.2 | 0.41 | |
| 0.4 | 0.14 | |
| 陰性コントロール(PBS) | 0 | 0 |
表1: 標準用量反応曲線の作成に使用したcGMPキャリブレーターの用量。1アッセイ容量120 µL中の最終濃度。
| ANP | 3x 原液(nM) | 最終濃度(nM) 1 |
|---|---|---|
| 9,000 | 3000 | |
| 3000 | 1000 | |
| 900 | 300 | |
| 300 | 100 | |
| 90 | 30 | |
| 30 | 10 | |
| 9 | 3 | |
| 3 | 1 | |
| 0.9 | 0.3 | |
| 0.3 | 0.1 | |
| 0.09 | 0.03 | |
| 陰性コントロール(PBS) | 0 | 0 |
表2: 細胞を用いた実験に使用したANPの用量。1アッセイ容量600μL中の最終濃度。
- KRGB バッファー。シグマ社では、製品情報シートにこのバッ ファーの詳しい調製方法を記載しています。
- 800 mM IBMX。100 mg の IBMX を 563 µL の DMSO に溶かす。20℃で保存する。IBMXはcGMP-ホスホジエステラーゼによるcGMPの分解を阻害する。
- 刺激前バッファー。800mMのIBMX 9.4μLをKRGBバッファー10mLに加える。IMBXが完全に溶解するように激しくボルテックスする。この緩衝液は実験当日に新しく調製する。
- cGMP キャリブレーター。凍結乾燥キャリブレーター 1 バイアルを PBS 5 mL に溶解する。この結果、cGMPキャリブレーター濃度は30µMとなります。内容物がすべて溶解するようによく混ぜる。氷上または4℃で保管してください。表1に示すように、cGMPアッセイバッファーでさらに希釈する。
- 60 µM ANP。100 µg ANP を 0.1% BSA 添加滅菌 PBS 541 µL に溶解する。分注し、-20℃で保存する。表 2 に示すように、0.1% BSA を含む PBS でさらに希釈する。
- 再構成ウサギ抗cGMP抗体およびHRP-cGMPコンジュゲート。cGMPアッセイバッファーを10mLずつ2つのバイアルに加え、よく混ぜて内容物を溶かし、氷上または4℃で2週間まで保存する。
- ストップライトレッド基質溶液。この溶液は使用前に新しく調製し、調製後1時間以内に加える。100XストックStoplight Red基質150 µLを基質バッファー15 mLに希釈し、3%過酸化水素17 µLを加える。溶液は遮光してください。
方法
cGMP キャリブレーターを用いた CatchPoint サイクリック GMP アッセイ キット(Molecular Devices 社、cat #R8074)の使用法の詳細は、キットに添付されている製品 添付文書、または弊社ウェブサイト(www.moleculardevices.com/pages/reagents.html)に記載されています。
RFL-6細胞研究のためのセル調製
ステップ1 RFL-6細胞を1mL中7.5 x 104 cells/mLで12ウェル組織培養処理マイクロプレートのウェルに播種した。細胞を5%CO2中、37℃で一晩培養した。
ステップ2 翌日、細胞を封じ込めたウェルを静かに吸引し、400μLの刺激前バッファーで10分間インキュベートした。200μLのANPストック溶液またはPBS(表2参照)を細胞を封じ込めたウェルに加え、37℃で15分間インキュベートした。
ステップ3 細胞を溶解するために、200μLのセル溶解バッファーを各ウェルに加え、プレートシェーカーを用いてマイクロプレートを室温で10分間撹拌した。
ステップ4 マルチチャンネルピペッターを用いて、各ウェルから40µLずつ取り出し、96ウェルプレートの別々のウェルに移した。12ウェルプレートの各ウェルは、96ウェルアッセイマイクロプレートの4重反復に使用した。
COS-7細胞研究のためのセル調製
ステップ1 コントロールpcDNA3.1プラスミド(Invitrogen)またはpcDNA3.1にクローニングされたMsGC-β3コード配列で、COS-7細胞をトランスフェクトした8。
ステップ2 トランスフェクションの3日後、細胞を回収し、EDTAフリーのCompleteプロテアーゼ阻害剤を含むM-PER抽出試薬中でホモジニアス化した。
ステップ3 COS-7細胞抽出物を、50mM MOPS-KOH(pH7.5)、60mM KCl、8mM NaCl、4mM MgCl2または4mM MnCl2、cGMPホスホジエステラーゼ阻害剤ジピリダモールとザプリナスト各10mM、および1mM GTPを封じ込めたバッファー中で30分間インキュベートした。
ステップ4 反応を0.2M酢酸亜鉛で停止し、過剰のGTPを0.2M Na2CO3で沈殿させた。サンプルを遠心分離し、上清を CatchPoint Assay Buffer で希釈した(1:40 希釈)。
ステップ 5 マルチチャンネルピペッターを用いて、各ウェルから 40 µL ずつ取り出し、96 ウエルプレートの別々のウエルに移し、各サンプルを重複してアッセイしました。サンプルはTK CatchPointアッセイを用い、比色分析アッセイも並行して実施した11。
CatchPoint cGMPアッセイ法の手順
ステップ 1 再構成したウサギ抗cGMP抗体40マイクロリットルを全てのウェルに添加した。マイクロプレートをプレートシェーカーで 5 分間静かに撹拌し、適切にプレーティングする。
ステップ2 再構成したHRP-cGMPコンジュゲート40マイクロリットルをマイクロプレートの全ウェルに添加し、穏やかに混合した。その後、プレートを室温で2時間インキュベートした。
ステップ3 インキュベーションが完了したら、アッセイマイクロプレートを1回につき300μLの洗浄バッファーで4回洗浄した。
ステップ4 100μLのStoplight Red基質溶液を各ウェルにできるだけ速やかに添加した。マイクロプレートは蓋をして遮光した。
ステップ 5 60 分後、CatchPoint cGMP 製品添付文書に記載されている設定で蛍光強度を測定した。蛍光はAnalyst™ AD、FLEXstation™ またはGemini XSシステムを用いて測定しました。
測定結果
アッセイ性能
環状GMPキャリブレーター
最初にcGMPキャリブレーターを用いてアッセイ性能を調べた。cGMPキャリブレーターの各濃度は4重反復で行った。3回以上の実験の代表的な結果を図1に示す。3種類の蛍光マイクロプレートリーダーをすべて使用して 得られたEC50値の範囲は、1.7~2.8 nMであった。SB比の範囲は、ゼロキャリブレーター濃度と3333 nMキャリブレーター濃度を用いて計算した。Analystで得られた値は300から340の間、Gemini XSで得られた値は420から430の間、FLEXstationで得られた値は400から480の間であった。
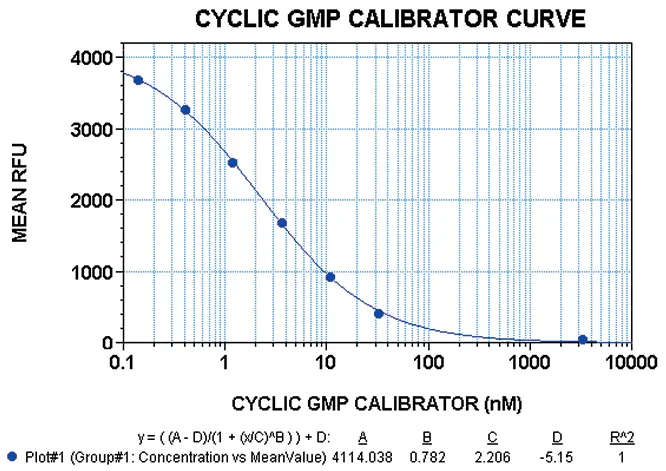
図1:FLEXstationを用いたcGMPキャリブレーターの用量反応曲線。データはStoplight Red基質添加の60分後に得られた。グラフの各ポイントは4レプリケートサンプルの平均を示す。エラーバーは平均からの標準偏差を示す。R2値は4パラメータカーブフィット処理で1.0である。この実験では、cGMPキャリブレーターのEC50値は2.2 nMであった。RFUは相対蛍光単位を示す。
Z´ファクターは、キャリブレーター濃度ゼロとキャリブレーター濃度3333 nMの16反復を用いて決定した。3つの蛍光マイクロプレートリーダーすべてで得られたZ´ファクターの値の範囲は0.89から0.95の間であった。
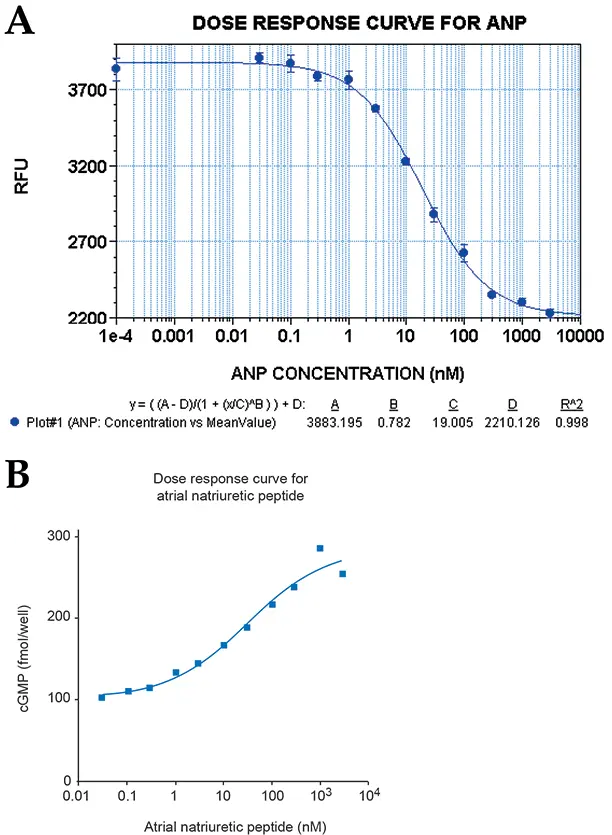
図2:ANP処理RFL-6細胞の用量反応曲線。用量反応曲線上の各ポイントは、活性化剤の1濃度に対する4レプリケートサンプルの平均を表す。データセットを読み取る前に、プレートをStoplight Red基質とともに60分間インキュベートした。(A)の用量反応はGemini XSとSoftMax® Proを、(B)はGraphPad Prism®ソフトウェアを用いてAnalyst ADで得られたデータを示す。両方のインストゥルメンテーションで繰り返し実験して得られたEC50値は、11~19 nMであった。
ラット肺線維芽細胞株RFL-6を用いて、ペプチドホルモンANPによるGCの活性化を研究した。図2に示すように、Gemini XSまたはAnalyst ADを用いた再現性実験から得られたEC50値は11~19 nMであった。SB比はGemini XSで400から450、Analystで300から350、FLEXstationで425から500の範囲であった。Z´因子は、使用したすべてのインストゥルメンテーションで0.5から0.73の範囲であった。
比色分析法との比較
次に、CatchPoint cGMP アッセイと他の市販の cGMP アッセイとの比較を行いました。CatchPoint アッセイを用いたキャリブレーター曲線の結果を、American Qualex社(カリフォルニア州サンクレメンテ)の試薬を用いた比色分析法と比較した11。比色分析法では、一次抗体、HRP-cGMPコンジュゲート(コンピテント)、cGMP含有サンプルを一晩インキュベートする必要がある。一方、CatchPointキットは2時間のインキュベーションで済む。この2つのアッセイ法は、最適なインキュベーション時間 で使用した場合、同じEC50値( \~250 fmol)を示す(図3参照)。
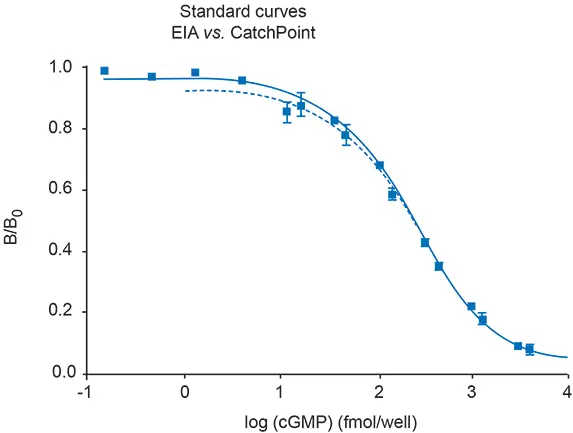
図3:各アッセイの最適培養時間で得られたEC50値の比較。比色分析(EIA、実線の四角)の完了時間は約18時間で、CatchPointアッセイ(破線)の時間は3時間であった。どちらのアッセイでも、キャリブレーターのEC50値はほぼ同じであった。
しかし、比色分析で2時間のインキュベーション時間を用いると、EC50値は著しく低下した(表3参照)。さらに、CatchPointアッセイのシグナル対ノイズ比は比色分析アッセイの22倍であった。
| キットメーカー |
EC 50 値 |
シグナル対ノイズ比 |
|---|---|---|
| アメリカンクオレックス | 948 | 4.9 |
| モレキュラー・デバイス | 230 | 110 |
表3:比色分析(American Qualex社)と蛍光(Molecular Devices社)のcGMPアッセイの比較。SN比は、3.7 nMキャリブレーターをシグナル、3333 nMキャリブレーターをノイズとして計算した。
新規GC酵素を過剰発現したCOS-7細胞におけるサイクリックGMPレベル
サル腎臓細胞株COS-7を用いて、MsGC-β3と名付けられた新規GCの活性を研究した。このGCは、NOに影響されない高い基礎活性を持つ。MsGC-β3をCOS-7細胞に一過性にトランスフェクトし、72時間後、この酵素の2つの異なるトランスフェクタント、Mg2+とMn2+の存在下で、細胞のGC活性をアッセイした。グアニル酸シクラーゼは、MnとMgの存在下で異なるレベルの活性を示すことが示されている13。特異性では、他のあるNO非感受性GCは、Mg2+よりもMn2+の存在下で高い活性レベルを示した(13)。その結果を図4に示す。
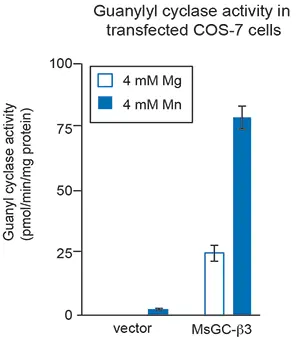
図4:GC過剰発現COS-7細胞におけるグアニリルシクラーゼ活性。セルには、ベクター(ネガティブコントロール)または高い基底活性を持つGC変異体であるMsGC-β3をトランスフェクトした。二価陽イオンのマグネシウムとマンガンは、MsGC-β3活性に必要な補因子である。
結論
本報告では、精製cGMP(キャリブレーター)およびcGMPを封じ込めた細胞溶解液を使用した場合、CatchPoint cGMPアッセイが高いSB比(直接比較で22:1)およびZファクター値を示す高感度アッセイであることを示した。cGMPの測定には、2つの異なる細胞系を使用した。まず、ペプチドホルモン誘導性cGMPレベルを測定し、次にユニークGCを一過性にトランスフェクトした細胞から産生されるcGMPレベルを測定した。どちらのシステムでも、アッセイは信頼性が高く、高感度であることが実証された。
CatchPointアッセイと比色分析アッセイを比較したところ、それぞれが最適な条件で使用された場合、2つのアッセイは非常によく似た結果を示した。しかし、CatchPointアッセイの処理時間は3時間であったのに対し、比色分析では18時間を要した。さらに、比色分析法には必須の終了ステップ(酢酸の添加)があり、シグナルは長時間安定しない。また、一定時間内に反応を終了させないと、コントロールを含むすべてのサンプルが飽和してしまい、値が無意味になってしまう。対照的に、CatchPointアッセイで使用されるStoplight Red基質から生成されるシグナルは、24時間まで安定である。注目すべきは、一晩のインキュベーションではなく、2時間のインキュベーションで比色分析を比較した場合、キャリブレーターのEC50値は4倍以上増加したことである。これら2つの特徴、ワンステッププロセス不要と処理時間短縮は、ハイスループット研究室が必要とする利便性を提供する。
参考文献
- Wedel, B. and Garbers, D. 2001. Y2Kにおけるグアニリルシクラーゼファミリー。Annu. Physiol.
- Mateo, O. A. and de Artinano, A. A. 2000. 一酸化窒素の反応性とその生物学的作用に関与するメカニズム。Pharmacol. 42: 421-427.
- Patel, M. J., Wypij, D. M., Dudley, A., Rimele, T. J. and Wiseman, J. S. 1995. 培養上皮細胞株および線維芽細胞株による一酸化窒素に応答したサイクリックGMPの分泌。J. Pharm. Exp. Therap. 273: 16-25.
- Dizhoor, A. M. and Hurley, J. B. 1999. グアニリルシクラーゼ活性化タンパク質による光受容体膜グアニリルシクラーゼの制御。Methods 10: 521-531.
- Pugh, E. N., Duda, T., Sitaramayya, A. and Sharma, R. K. 1997. 光受容体グアニル酸シクラーゼ:総説。Biosci. 17: 429-473.
- Vesely, D. L. 2002. 心房性ナトリウム利尿ペプチドプロホルモン遺伝子発現:その発現をアップレギュレートするホルモンと疾患。IUBMB生命53: 153- 159.
- Azizo, V. A. and Muradova, S. R. 2001. 心房性ナトリウム利尿ペプチドと心臓血管系。Anadolu Kardiyol. Derg. 2001. 1: 297-300.
- Morton, D. B. 1996. Neuropeptide-stimulated cyclic guanosine monophosphate immunoreactivity in the neurosecretory terminal of a neurohemal organ. J. Neurobiol. 29: 341-353.
- Nighorn, A. Byrnes, K. A., and Morton, D. B. 1999. 可溶性グアニリルシクラーゼの新規サブユニットの同定と特徴付け。このサブユニットは、第二のサブユニットが存在しない場合に活性を示し、一酸化窒素には比較的鈍感である。J. Biol. Chem. 274: 2525-2531.
- Morton, D. B. and Hudson, M. L. 2002. 昆虫におけるサイクリックGMPの制御と機能。Advances in Insect Physiol.
- Kingan, T. G., Gray, W. Zitnan, D. and Adams, M. E. 1997. 脱皮ホルモンによる脱皮誘発ホルモン放出の制御。J. Exp. Biol.
- Tremblay, J., Gerzer, R. and Hamlet, P. 1988. 細胞機能におけるサイクリックGMP。アドバンスセカンドメッセンジャーホスホタンパク研究 22: 319-383.
- Simpson, P. J., Nighorn, A. and Morton, D. B. 1999. 受容体グアニリルシクラーゼに関連するが、細胞外ドメインと膜貫通ドメインを欠く新規グアニリルシクラーゼの同定。J. Biol. Chem. 274: 4440-4466.
PDF版(英語)