Application Note 人工多能性幹細胞由来細胞を用いた
毒性アッセイ
- 96ウェルまたは384ウェルフォーマットで、ウェル面積のパーセンテージを使用して、簡単かつ迅速に毒性のスクリーニングを行う。
- 使い慣れたマイクロプレートリーダーのワークフローに従う
- セルが可視化されるため、データ出力に確信が持てる。
PDF版(英語)
はじめに
薬剤による臓器毒性は、医薬品候補が上市に至らない重要な原因である。従って、安全性と有効性を試験するための予測性の高いアッセイは、医薬品開発を改善し、医薬品候補の減少を抑えるために極めて重要である。ヒト人工多能性幹細胞(iPSC)由来の肝細胞やニューロンは、成熟細胞の典型的な特徴や代謝を示し、医薬品開発の初期段階におけるハイコンテントスクリーニングに理想的である。
発光マイクロプレートリーダーで発光や蛍光の出力を用いて標準的な細胞毒性アッセイを行うプロトコールはよく知られているが、イメージングサイトメーターを用いて実際に細胞を観察することで、さらに多くの情報を得ることができる。
標準的な生存率アッセイからより多くの情報を得る
カルセインAMのような生存率色素は、生細胞における総体的な化合物毒性に対処するために用いることができる。カルセインAMは、機能的エステラーゼ活性を示す生細胞の内部でのみ緑色に蛍光を発する。iPSC由来のヒト肝細胞をまず様々な化合物で24時間処理し、その後カルセインAMで染色した。SpectraMax® i3 Multi-Mode Detection PlatformのアップグレードオプションであるSpectraMax® MiniMax™ Imaging Cytometerを用いて生細胞の画像を取得した。SoftMax® ProソフトウェアのCell Proliferation Protocolを用いて生細胞の緑色細胞質領域を同定し(図1および2)、同ソフトウェアのカーブフィット処理機能を用いてIC50値を決定した(図3)。
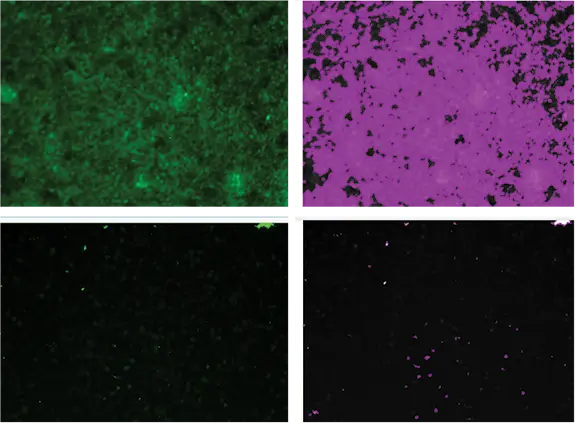
図1. 生存率色素による生細胞測定。Calcein AMで染色された生細胞は、SoftMax ProソフトウェアCell Proliferation Protocolで同定されます。このアッセイは、生細胞で覆われたウェルのパーセンテージを計算するために使用される。右側の紫色のマスクは、左側の画像に見える生細胞のセグメンテーションを示す。
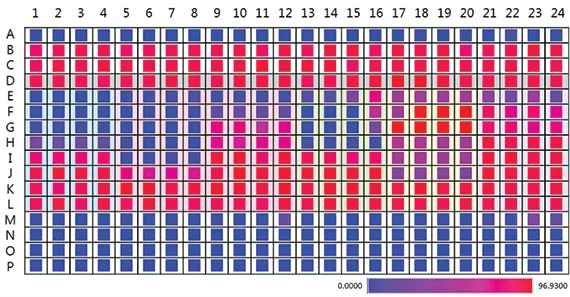
図2. 生細胞のコンフルエンスが一目でわかる。肝毒性実験では、結果のヒートマップにより、どの化合物に毒性があるかを素早く判断できる。赤いウェルが最もコンフルエントで、青いウェルが最もコンフルエントでないことを示し、E-H行で最も高い毒性を、A, M-P行で空のウェルを示している。
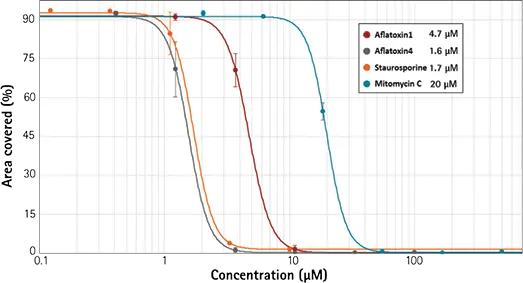
図3. カーブフィット処理から求めた化合物のIC50値。SoftMax® Proソフトウェアのカーブフィット処理機能を用いて、4種類の化合物のIIC50値を決定した。
ニューロン
神経細胞における毒性は、細胞数や生存率に影響を与えなくとも、神経突起伸長の数や長さの減少という形で現れることがある。イメージングアッセイは、細胞体だけでなく、各細胞に関連する軸索や樹状突起も検出することで、このような追加情報を提供することができる。ヒトiPSC由来ニューロンを384ウェルマイクロプレートに5,000セル/ウェルでプレーティングした。を用いて、化合物であるレチノイン酸の1:2希釈液で24時間処理する前に、4重反復ウェルで1:2希釈液で試験し、5日間増殖させた。処理終了時にセルを固定し、AlexaFluor 488で直接標識した ß-チューブリン抗体で染色した。ウェルの約30%をカバーする1視野で2,000個以上のセルが可視化される。SoftMax ProソフトウェアのCell Countプロトコルを用いてセルを分析した(図4)。
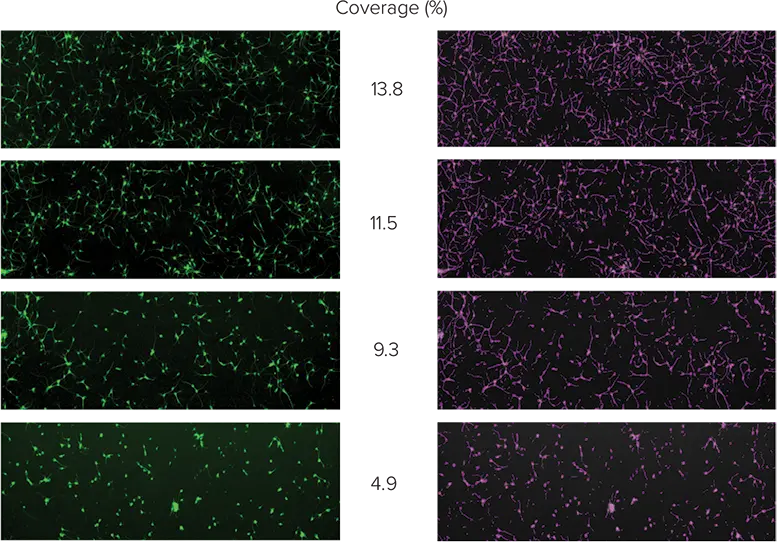
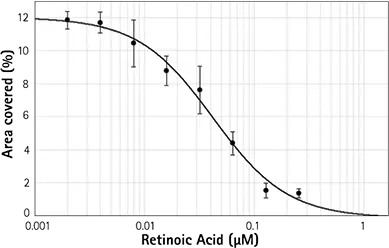
図4. レチノイン酸は用量依存的に神経突起伸長を阻害する。上段:レチノイン酸の濃度が高くなるにつれて(上から下へ;上段=コントロール)、神経突起伸長の量は減少する。紫色のマスク(右列)はセルボディとアウトグロースを識別する。
右図: レチノイン酸濃度の関数としてのマスク領域のプロット。
毒性アッセイからより多くの情報を
SpectraMax MiniMaxイメージングサイトメーターは、プレートリーダーでの強度測定値を補う可視化および形態学的情報を提供します。細胞数や細胞密度などの追加パラメータは、iPSC由来の肝細胞や神経細胞を用いて化合物の毒性作用を判定する際に有用です。
PDF版(英語)