Application Note 透過光画像解析による
細胞カウントと細胞毒性効果の評価
- 透過光イメージングによる対物レンズのセグメンテーションとカウント
- 透過光で細胞増殖をモニターする
- 色素を使用しない細胞毒性効果の評価
- 抗増殖および細胞毒性化合物の効果を評価する
PDF版(英語)
はじめに
オクサナ・シレンコ|研究員|モレキュラー・デバイス
数多くの生物製剤アプリケーションでは、蛍光マーカーやその他のラベルを用いずに、複数の時点における細胞数、細胞の健康状態、コンフルエンス、増殖のモニタリングが必要とされている。特に、透過光(TL)イメージングで細胞をモニタリングする際に、様々な細胞応答を評価するための信頼性が高く効率的な細胞計数法の必要性が高まっている。
材料
- CHO細胞(ATCC P/N CRL-1985)
- HeLa細胞(ATCC P/N CCL-2)
- HeLa培地(ギブコ、サーモフィッシャーサイエンティフィック)
- ヘキスト(サーモフィッシャーサイエンティフィック)
- 96ウェルマイクロプレート (Greiner Bio-One International)
- ImageXpress® Nano自動イメージングシステムとCellReporterXpress自動画像取得・解析ソフトウェア(Molecular Devices)
透過光を使った対物レンズの分割とカウント
CellReporterXpressソフトウェアには、透過光画像を用いて対象物をセグメンテーションし、カウントする機能がある。本研究では、増殖と細胞毒性効果の評価における透過光細胞解析の可能性を探ることで、標識不要細胞計数の精度を評価した。
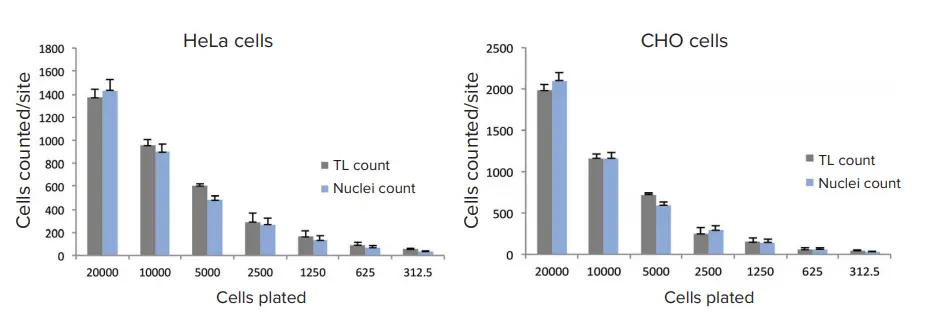
連続希釈法を用いて透過光でカウントした細胞の精度を評価し、核カウンターステインを用いてカウントした細胞の値と比較した。CHOおよびHeLa細胞を、適切な培地を用いて96ウェルプレートにプレーティングした(HeLa培地: MEM+10%FBS+1%pen/strep;CHO培地: CHO培地:Ham's F12 + 10% FBS + 1% pen/strep)。20,000セル/ウェルを最上段にプレーティングし、50%連続希釈をプレート全体に適用した。プレーティングから24時間後、セルをHoechst核色素で染色し、4%パラホルムアルデヒドで固定し、PBSで洗浄した。ImageXpressナノシステムを用い、10倍または4倍の対物レンズで個々のウェルの画像を取得した。384ウェルプレートの1ウェルにつき、10倍の画像を1枚撮影した。10x 対物レンズは十分な解像度を提供しながら、比較的多くの細胞(1画像あたり500~1,000細胞)をイメージングし、ウェル全体の面積の約1/4を捉えます。1枚の4x画像は384ウェルプレート全体をカバーする(96ウェルプレートの1ウェルの1/8に相当)。画像取り込み後、すべての画像解析はCellReporterXpressソフトウエアを用いて行った。このソフトウエアには、透過光で細胞数を定量化するための、あらかじめ定義された画像解析プロトコルが封入されている。様々な形態の細胞に対して、いくつかの解析プロトコールが利用可能である。画像処理の一例として、図1にHeLa細胞とCHO細胞の代表的な拡大画像と適切な解析マスクを示す。
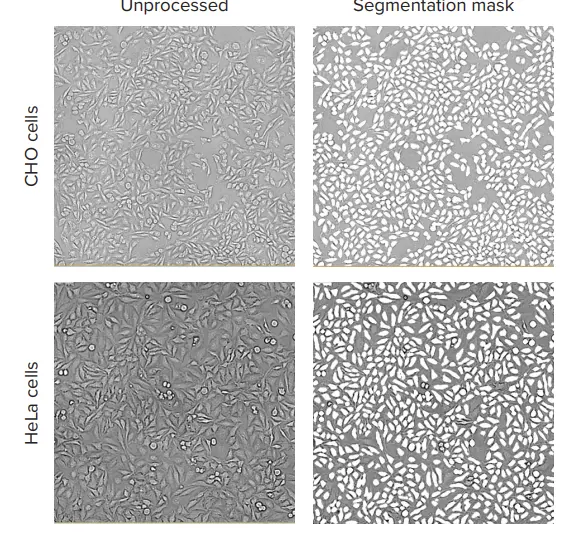
10倍または4倍の対物レンズを用いたTLイメージングの典型的な露光時間は10~20msであった。より良い結果を得るために、フォーカスオフセットは画像ベースのオートフォーカスより-5~-8μmの範囲に設定した。定義済みの "TL Cell Count, General "解析プロトコールは、HeLaとCHOの両細胞株について、異なる細胞密度の細胞を正確にセグメンテーションした(図1)。TLイメージングと解析によって得られたセルカウントを、核染色を用いた標準的なセルカウントと比較した。TLと蛍光核マーカーを用いたこれら2つの異なる方法による細胞計数の結果は、良好な一致を示した(図2)。
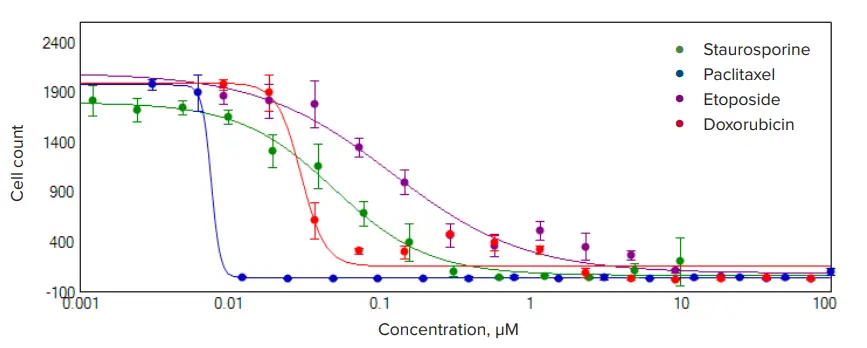
細胞を蛍光標識することなく細胞毒性効果を評価することができる。
HeLa細胞を、384ウェルプレートで6段階の濃度範囲にわたって、抗がん化合物マイトマイシンC、エトポシド、パクリタキセル、ドキソルビシンで72時間処理した(図3)。生細胞を透過光でイメージングし、「TL Cell Count, General」解析プロトコルを用いて解析した。細胞増殖と細胞死に対する影響は、細胞数を測定することで評価した。標記化合物で処理した細胞数は有意に減少した。濃度反応はHillモデルを用いて評価し、EC50濃度値を導出した。抗がん化合物で処理したセルは、化合物濃度の上昇に伴い、細胞数の明らかな減少を示した(図3)。
結論
この方法は、TL分析が細胞数の正確な評価に使用できること、また様々な化合物の抗増殖作用や細胞毒性作用の測定に使用できることを示している。
PDF版(英語)