Application Note NanoOrangeタンパク質キットを
SpectraMaxマイクロプレートリーダーで使用する場合
- 吸光度法よりも感度が大幅に向上
- 10ng/mLから10μg/mLまでの広いダイナミックレンジ
- SoftMax Proソフトウェアプロトコルの設定により、データ収集・解析が容易
PDF版(英語)
はじめに
このアプリケーションノートでは、Life Technologies 社の NanoOrange® Protein Quantitation Kit を SpectraMax® マイクロプレートリーダー(蛍光検出モード付き)および Molecular Devices 社の SoftMax® Pro ソフトウェアで使用する方法について説明します。このアッセイは、吸光度280、BCA、ブラッドフォード、ローリーアッセイなどの従来の光度計による方法よりもはるかに高感度です。マイクロプレートフォーマットでのこのアッセイのダイナミックレンジは10 ng/mL~10 μg/mLです。このアプリケーションノートに記載されたデータは、NanoOrange Kit(MP 06666)のマニュアルに記載されたダイナミックレンジと検出下限を確認するものです。
資料
- Life Technologies 社製 NanoOrangeタンパク質定量キット(カタログ番号 N-6666)
- 標準曲線用タンパク質(BSA はキットに付属しています)
- 蒸留水
- 90~96℃の加熱ブロック
- プラスチックチューブ(1mLマイクロフュージチューブ)
- ソリッドブラックマイクロプレート
- Gemini XPSマイクロプレートリーダー(または蛍光検出モードを備えた他のSpectraMaxリーダー)
- SoftMax Proソフトウェア
方法
インストゥルメンテーションとソフトウェアのセットアップ
ステップ1:マイクロプレートリーダーの電源を入れます。
ステップ2: SoftMax Proソフトウェアを起動します。Protocol Libraryを開き、'Protein Quant'フォルダを探し、設定済みのプロトコル'NanoOrange'を開きます。
ステップ3: "Settings "をクリックすると画面が表示されます(図1)。最初にRead Mode 'FL'とRead Type 'Endpoint'を選択し、次に波長を選択します: Excitation 485 nm, Emission Cutoff 570 nm, Emission 590 nm。Settings(設定)ウィンドウの左側にあるCategory(カテゴリー)パネルに進み、アッセイプレートタイプや読み取るウェルなどに適したパラメータを選択します。PMT と光学系については、Automatic PMT Gain を推奨します。読み取りあたりのフラッシュ回数は少なくとも20回に設定します(フラッシュ回数が多いほど精度は高くなりますが、読み取り時間が長くなります)。
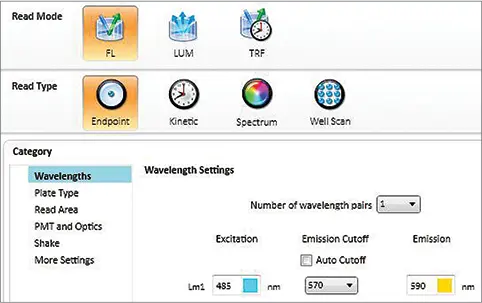
図 1. ナノオレンジアッセイ用のプレートリーダーの設定。蛍光検出モードの SpectraMax リーダーの典型的な設定を示す。
ステップ 4:Template Editor を用いてウェルを'Standards'および'Unknowns'グループに分けます(図 2)。これにより、標準曲線がプロットされ、SoftMax Pro ソフトウェアで検体濃度が自動計算されます。必ずプレートブランクを含めてください。
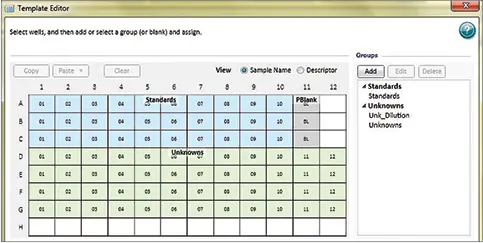
図2. テンプレートのセットアップ。Template Editorでウェルを'Standards' および 'Unknowns' グループに割り当てると、標準曲線の自動プロットやデータ解析が可能になります。
アッセイの準備
このアッセイ法は NanoOrange の製品情報シートに記載されている手順に従いますが、96 ウエルマイクロプレートフォーマッ トに適合させるためにアッセイ容量を 2.0 mL から 180 μL に減らしています。
ステップ 1: 濃縮 B 液(NanoOrange タンパク質定量希釈液)を蒸留水で 1:10 に希釈する(B 液 1: 蒸留水 9)。
ステップ 2: 濃縮した A 液(ナノオレンジタンパク質定量試薬)を作業濃度(1x)のナノオレンジタンパク質定量希釈液で 1:500 に希釈し、ナノオレンジ作業溶液とする。
注意:この作業は実験の直前に行う(作業溶液は調製後数時間以内に使用する)。NanoOrange 溶液はアッセイの検体数(標準品、未知検体、ブランク検体、その他コントロール検体を含む)分のみ調製して下さい。
作業溶液は遮光瓶に入れるか、遮光していない容器にアルミホイルで包むか、暗い戸棚や引き出しに入れて光から保護してください。試薬の光分解を防ぐため、作業溶液を光から保護することが重要です。
ステップ 3: 2 mg/mL の BSA を NanoOrange の作業溶液で希釈し、10 μg/mL と 1 μg/mL のストック溶液を調製する。
ステップ 4: 標準曲線と未知検体は NanoOrange を用いて調製します。このアプリケーションノートに示した標準曲線は BSA の 10 μg/mL と 1 μg/mL のストックを用いて作成しました。この表に示した量は各濃度の 5 レプリケート調製に十分な量です。実施したい反復数に応じて、容量を調整するとよいでしょう。適切な BSA と NanoOrange 溶液を 11 本の茶色(遮光用)のマイクロフュージ管に表 1 のように混ぜる。
| 最終BSA濃度 (μg/μL)アッセイ中 |
BSA体積 | ナノオレンジ 溶液(μL) |
|---|---|---|
| 10 | 1000 μL of 10 μg/mL | 0 |
| 6 | 600 μL of 10 μg/mL | 400 |
| 3 | 300 μL of 10 μg/mL | 700 |
| 1 | 100 μL of 10 μg/mL | 900 |
| 0.6 | 60 μL of 10 μg/mL | 940 |
| 0.3 | 30 μL of 10 μg/mL | 970 |
| 0.1 | 10 μL of 10 μg/mL | 990 |
| 0.06 | 60 μL of 1 μg/mL | 940 |
| 0.03 | 30 μL of 1 μg/mL | 970 |
| 0.01 | 30 μL of 1 μg/mL | 990 |
| 0(空白) | 0 | 1000 |
表1. BSA標準物質の調製。
ステップ5:サンプルを95℃で10分間インキュベートし(遮光)、その後室温まで冷却します(約20分間)。
ステップ6:各サンプル180μLをマイクロプレートの適切なウェルに移します。
このアッセイプレートには、各BSA濃度のトリプリケートを作製した。
マイクロプレートの読み取り
ステップ1:マイクロプレートをリーダーにセットします。
ステップ2: SoftMax® ProソフトウェアのReadボタンをクリックします。マイクロプレートリーダーがプレートを読み取り、相対蛍光単位がPlateセクションに表示されます。
データの分析
ステップ1: マイクロプレートの読み取りが完了すると、RFUがPlateセクションに表示されます。このデータは、テンプレートのセットアップ中に作成したグループテーブルで分析されます(本書の前のセクション「インストゥルメンテーションとソフトウェアのセットアップ」を参照)。
ステップ2:設定済みのプロトコルを使用し、適切なウェルがTemplate EditorのStandardsグループに割り当てられていれば、標準曲線が自動的にプロットされます。グラフセクションのツールバーにあるドロップダウンカーブフィットメニューから、適切なカーブフィット処理を選択します。図 3 の標準曲線をプロットする場合は、線形カーブフィットを使用しました。
結果
図 3 は NanoOrange タンパク質定量キットに付属の BSA 標準品を用いて得られた標準曲線です。標準曲線のローエンドを Figure 4 に示す。蛍光検出モードの他の SpectraMax リーダーを用いても同様のデータと曲線が得られます(データは示さない)。
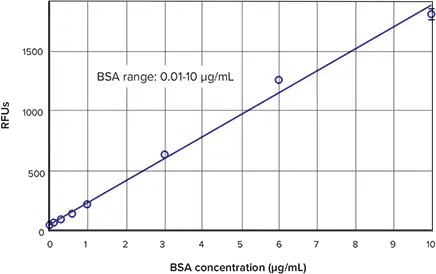
図3. ナノオレンジ標準曲線。BSA標準物質と線形カーブフィット処理により得られた標準曲線。
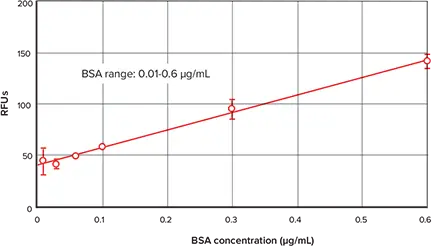
図4. 標準曲線下端の詳細。図3に示した標準曲線の下端の詳細。
結論
NanoOrange アッセイは、Gemini XPS マイクロプレートリーダーやその他のSpectraMax 蛍光マイクロプレートリーダーと SoftMax Pro ソフトウェアを組み合わせて使用することで、タンパク質の迅速かつ高感度な検出法となります。SoftMax Pro ソフトウェアの分析機能により、読みやすく、ユーザーカスタマイズ可能なレポートフォーマットで定量を行うことができます。
PDF版(英語)