Application Note 神経細胞におけるオートファジーを定量化するための細胞内小胞の可視化
- 非標識神経突起の正確なセグメンテーションを作成する
- 神経変性疾患のメカニズムに関する深い洞察の獲得
- 類似した細胞内構造をより正確に識別する
- 1つのウェルで複数の生物製剤を測定し、豊富なデータを生成する
PDF版(英語)
治療介入の可能な領域としてのオートファジー
ジェイン・ヘスレー博士|Sr.アプリケーションサイエンティスト|モレキュラーデバイス
オートファジーは細胞内の異化プロセスであり、不良と認識された、あるいは単に細胞にとって不要となったタンパク質や小器官を隔離し、分解する。オートファジーは、侵入してきた微生物や、誤って折り畳まれたタンパク質、分解された細胞小器官を除去する "ハウスキーピング "機能を果たすことで、正常な細胞プロセスを支えている。オートファジーは細胞の恒常性維持に不可欠であり、細胞内物質の代謝機構としての役割に加え、エネルギー消費と物質再利用の速度を調整することにより、飢餓などの課題に対する生物の応答をサポートする。
がん、感染症、糖尿病、神経変性疾患などにおいて、オートファジーの有益な役割と有害な役割の両方が発見されている。オートファジーの役割は、神経細胞の研究において特に興味深いものである。オートファジーは、長い軸索の距離にわたってタンパク質の構造と機能を維持するのに役立っている。他の組織のセルとは異なり、ニューロンの細胞質内容物は有糸分裂によって日常的に希釈されることはない。アルツハイマー病、パーキンソン病、その他の神経疾患では、オートファジーの異常と細胞毒素の蓄積が見られる2。このような観察から、治療介入の可能性のある領域として、オートファジーの様々なメカニズムが検討されるようになった。このプロセスに対する実験変数の影響を定量化することは、オートファジーを標的とした安全で効果的な治療法の開発につながる可能性のある研究に不可欠な要素である。
材料
- CYTO-ID ® オートファジー試薬(エンゾライフサイエンス社製)
- 蛍光リソソーム色素
- iCell ® ヒト多能性幹細胞由来ニューロン(セルラー・ダイナミクス・インターナショナル社製)
- ラットPC-12細胞(ATCC、猫番号CRL-1721)
- ImageXpress®マイクロハイコンテントイメージャーシステム(Molecular Devices社製)
- MetaXpress®ハイコンテント画像取得・解析ソフトウェア(Molecular Devices社製)
蛍光イメージャーを用いたオートファジーの可視化
オートファジーは、容易に入手可能な試薬を用いて、不均一性の細胞集団においても可視化し、特徴付けることができる。
CYTO-ID オートファジー試薬は、ファゴフォア、オートファゴソーム、オートリソソームの膜を選択的に染色します。また、オートファゴソームタンパク質LC3-IIと共局在化することが示されている。蛍光励起/発光プロファイルは495/519 nmで、標準的なFITCフィルターセットと組み合わせて使用できる。
破壊的なオートファゴソームとリソソームの融合は、リソソーム特異性蛍光可視化の助けを借りて検出することができる(図1)。以下の実施例では、リソソーム活性を特徴付けるために、励起/Emission波長647/668 nmの蛍光リソソーム色素を用いた。標準的なCy5フィルターセットを用いて、深紅色のリソソーム色素からのEmissionを検出することができる。
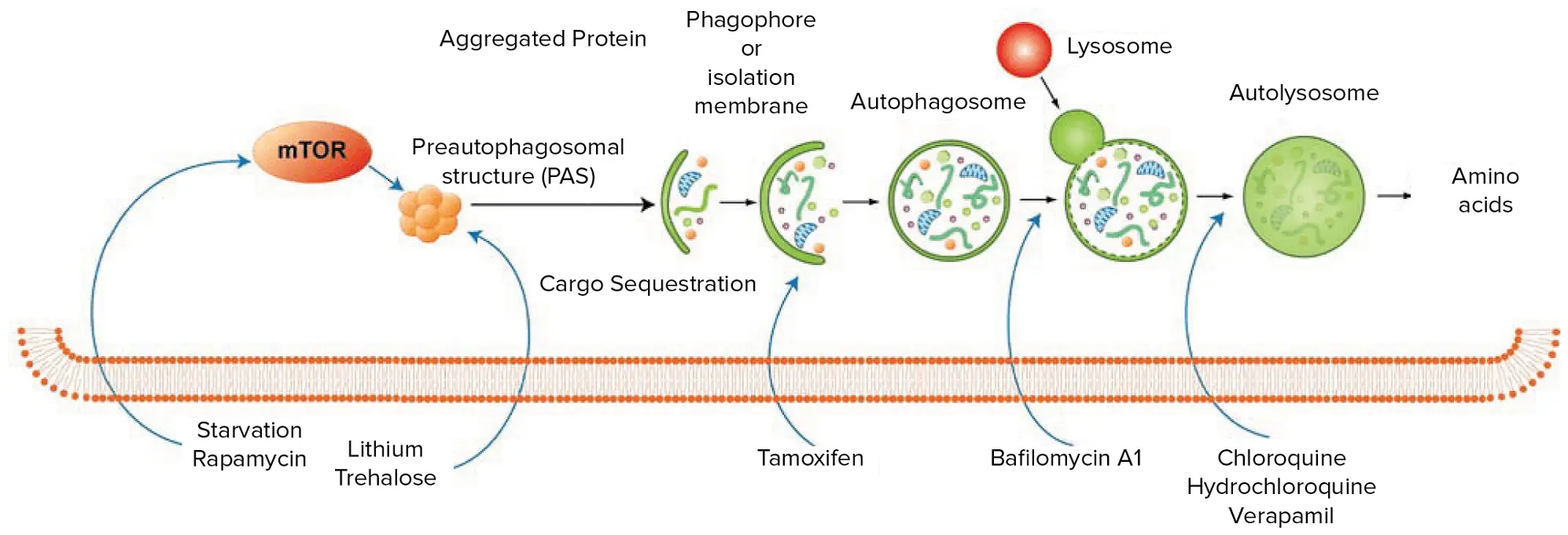
図1:オートファジーのプロセスは、内部または外部からのシグナルによって、球状の二重膜で封じ込められた構造体であるファゴフォアの形成が促進されることから始まる。微小管関連タンパク質1軽鎖3α(LC3)がファゴフォアの伸長を促し、細胞質の標的を飲み込み始める。オートファジー関連(ATG)タンパク質が仲介するプロセスで、ファゴフォアは標的の周りを閉じてオートファゴソームになる。その後、オートファゴソームはリソソームと融合し、その内容物と自身の膜を加水分解酵素による分解にさらす1。
表現型変化の同時解析が可能
生細胞におけるオートファゴソームのCYTO-ID Green染色とリソソーム染色のレベルは、化合物によるオートファジー経路の刺激または阻害のメカニズムに関する情報を提供する。これは、固定または生細胞、組織、小生物をワイドフィールド蛍光または明視野イメージングするハイコンテントイメージングシステムであるImageXpress Microシステムを用いて達成された(図2)。

図2. 自動イメージングを用いた簡便な定量ワークフロー。シンプルで自動化されたワークフローはハイスループットスクリーニングに適しており、プレーティングからエンドエンドエンドまで数日かかるような実験であっても、必要な作業時間を最小限に抑えることができる。
MetaXpress®ソフトウェアは、表現型の変化を特徴付け、特異性を出力するために、事前に設定されたアプリケーションまたはカスタマイズされたモジュールを使用して画像を解析した。カスタムモジュールは、核、オートファゴソーム、リソソームなどの複数の染色体の同時検出、測定、面積の合計を可能にした。測定値は、経時的に、あるいは薬剤濃度の範囲などの実験条件に対してプロットされた。
オートファゴソーム量の増加は、細胞の苦痛を示す
iCellヒトiPS細胞(人工多能性幹細胞)由来ニューロンおよびラットPC-12細胞を用いて、384ウェルマイクロプレートの各ウェルで複数の細胞反応を調べる有用性を実証した。
ヒト神経細胞
ニューロンを5,000セル/ウェルでプレーティングし、メーカーの推奨に従って増殖させた。5日後、細胞を維持培地で調製した化合物の希釈系列で処理した。24時間の化合物インキュベーション後、リソソーム、核、オートファゴソームの染色を行い、チャンバーを37℃に加温したImageXpress Microシステムを用いて生細胞イメージングを行った。画像は、60X Plan Fluorまたは40X Plan Apo対物レンズを用い、1ウェルあたり2~4部位から取得した(図3A)。画像解析はMetaXpressソフトウェア® を用いて、濃度範囲にわたる実験化合物への曝露の影響を定量化した(図3B)。例示の画像は説明のために60倍の倍率でセルを示しているが、図3-6のグラフのデータは同じ実験から得られたもので、40倍の倍率を利用している。倍率が低いほど、細胞内小胞の測定に十分な画質の画像が得られると同時に、各視野内でより多くの細胞を捉えることができるという利点がある。
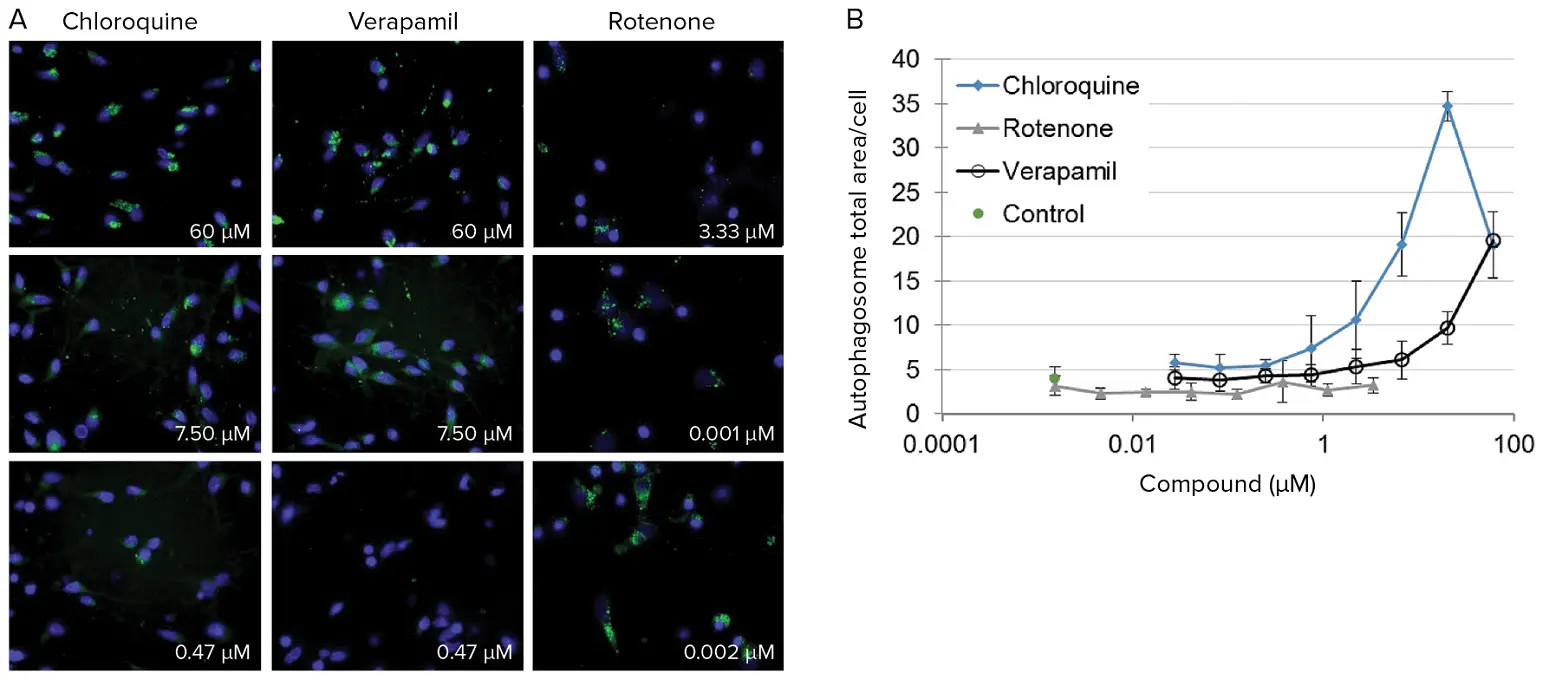
***図3. *ヒト神経細胞に対する実験化合物曝露の影響の定量化。(A)3種類の化合物を3種類の濃度で曝露した後のヒト神経細胞の代表的な60倍拡大画像。オートファゴソーム(緑)は用量依存的にセル処理に反応している。(B)ヒト神経細胞における凝集オートファゴソーム面積に対するクロロキン、ロテノン、ベラパミルの用量反応効果。オートファゴソームは化合物曝露によって阻害または刺激される可能性がある。
ラットPC-12細胞
PC-12細胞を2,000細胞/ウェルでプレーティングし、完全培地で調製した化合物の希釈系列で処理する前に一晩培養した。24時間後、リソソーム、核、オートファゴソームの染色を行い、37℃で生細胞イメージングを行った。画像は1ウェルあたり2-4部位から40倍の倍率で取得した。画像解析はMetaXpress®ソフトウェアを用いて行い、濃度範囲にわたる実験化合物への曝露の影響を定量化した(図4)。
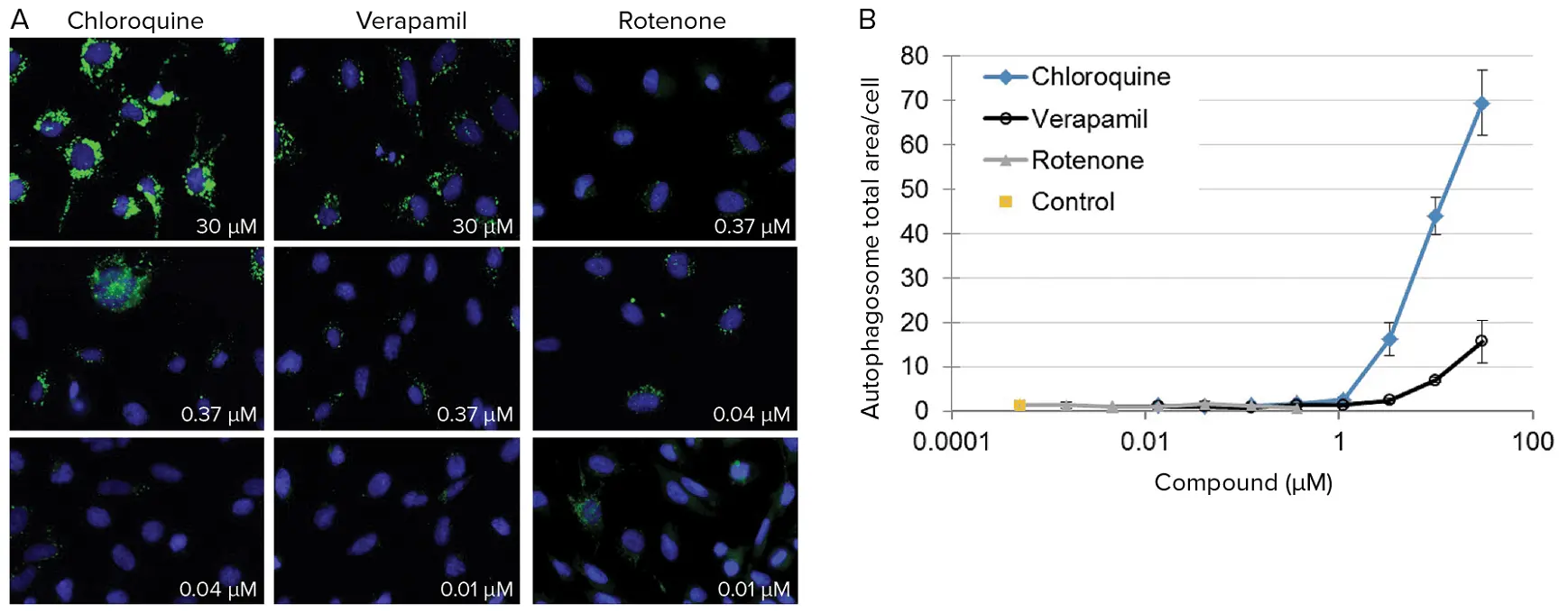
***図4. *ラットPC-12細胞に対する実験化合物への曝露の影響の定量。(A)3種類の化合物に3種類の濃度で暴露したラットPC-12細胞の代表的な60倍拡大イメージング。オートファゴソーム(緑)が明確に可視化され、測定できる。(B)ラットPC-12細胞における凝集オートファゴソーム面積に対するクロロキン、ロテノン、ベラパミルの用量反応効果。オートファゴソームは化合物曝露によって阻害または刺激される。
リソソーム反応はオートファジー経路の破壊を示す
ヒト神経細胞
リソソームのアッセイは、前述と同じウェルで同じ手順で行ったが、リソソーム色素を添加した(図5)。
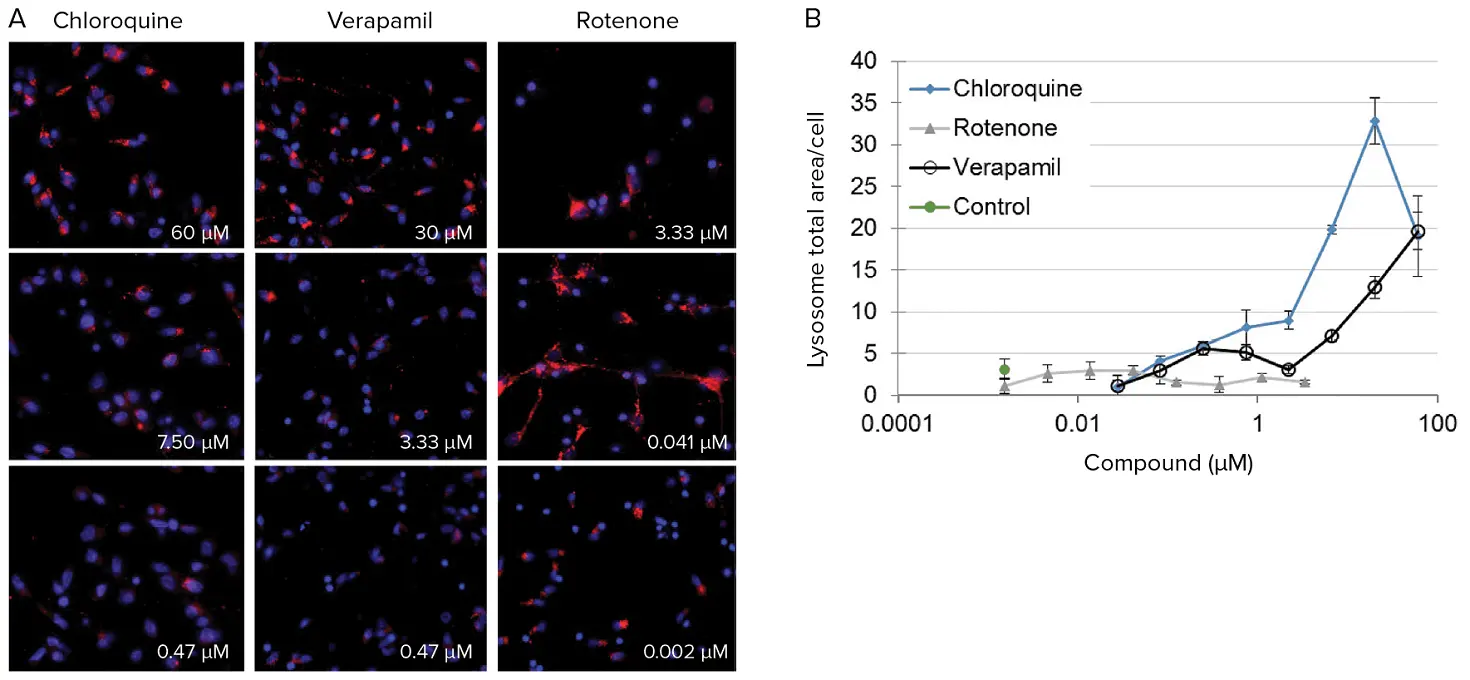
***図5. *ヒト神経細胞におけるリソソーム反応の定量。(A)3種類の化合物を3種類の濃度で曝露した後のiPSC由来ニューロンの代表画像。リソソーム(赤色)を可視化し、応答を検出するために測定することができる。(B)神経細胞におけるオートファジーの第二の指標である総ライソソーム面積に対するクロロキン、ロテノン、ベラパミルの用量反応効果。リソソームの測定は、2つの小胞の融合という最終段階におけるオートファゴソーム経路の破壊を示すことができる。
ラットPC-12細胞
複数の毒性事象を測定する同じアッセイをPC-12細胞で行った。細胞内リソソームへの影響を調べるために、いくつかのパラメータを測定した(図6)。
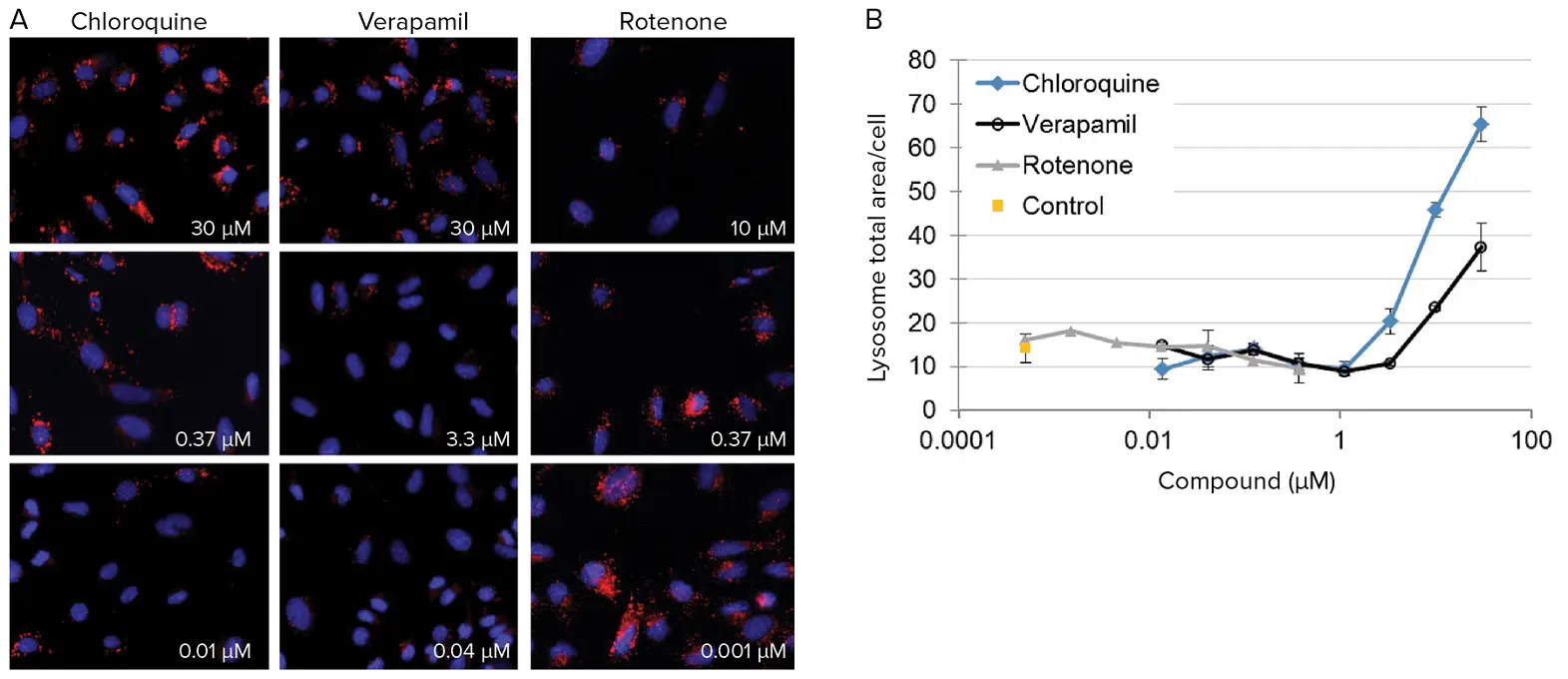
***図6. *ラットPC-12細胞におけるリソソーム応答の定量。(A)3種類の化合物を3種類の濃度で暴露したラットPC-12細胞の代表イメージング。上記の画像は60倍のPF対物レンズを用いて取得した。リソソームを赤で示す。細胞内リソソームの減少または増加を定量化することで、化合物の毒性メカニズムを知る手がかりとなる。(B)ラットPC-12細胞における、オートファジーの第二の指標である凝集リソソーム面積に対するクロロキン、ロテノン、ベラパミルの用量反応効果。リソソームは、化合物への曝露によって阻害または刺激される可能性がある。
透過光画像を用いた正確なニューロンセグメンテーションの作成
細胞体から離れた神経突起伸長にあるオートファゴソームを検出することは困難である。染色されていない細胞体の明視野画像を得ることは、長い突起を持つ細胞のセグメンテーションに役立ちます。ニューロンに関連する染色された小器官だけを正確に定量するために、カスタム・モジュールを構築した。これにより、染色されたアーチファクトや残屑ではなく、細胞残屑のみが対象オブジェクトとして検出されることが保証された(図7)。
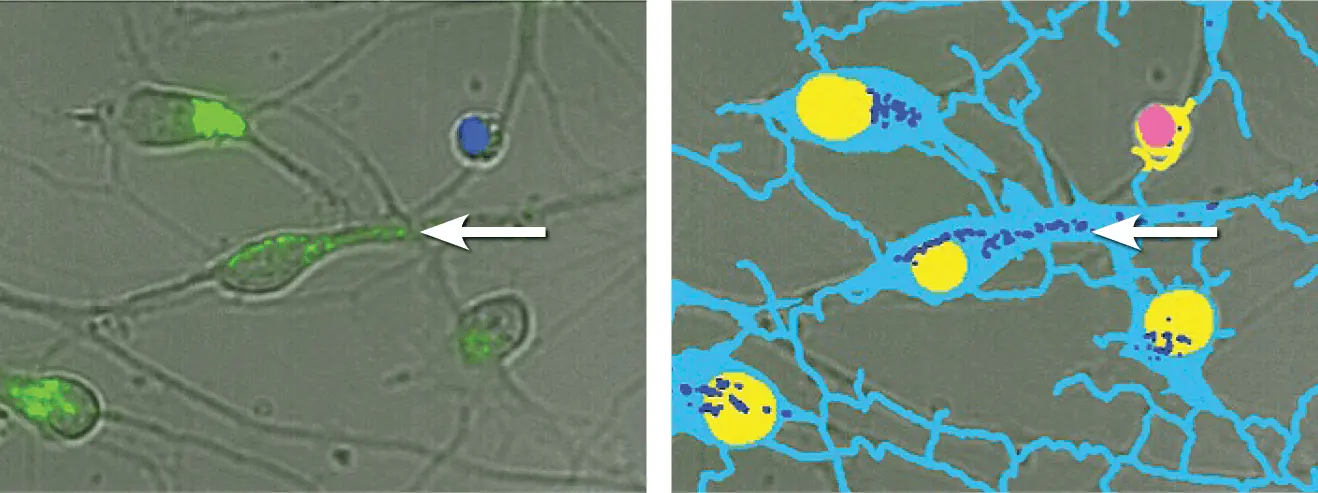
***図7. *カスタムモジュールを用いた神経細胞のセグメンテーション。(左)透過光(灰色)、ヘキスト染色核(青色)、CYTO-ID染色オートファゴソーム(緑色)の40倍拡大画像の重ね合わせ。(右)透過光画像から細胞体とアウトグロースを青緑色で識別し、健全な核を黄色、アポトーシス核をピンク色、オートファゴソームをロイヤルブルーで識別したセグメンテーションマスク。オートファゴソームは、細胞体から遠く離れていても数えることができる(矢印で指摘)
カスタムモジュール解析から生成されたリードアウトの用量反応曲線をAcuityXpress™解析ソフトウェアで作成した(図8)。ベラパミルとクロロキンの両方について、オートファゴソーム形成に対する明確な用量依存的応答が認められた。オートファゴソームおよびリソソーム形成で示される、化合物によるオートファジーの阻害または刺激に関するEC50値を図9に示した。
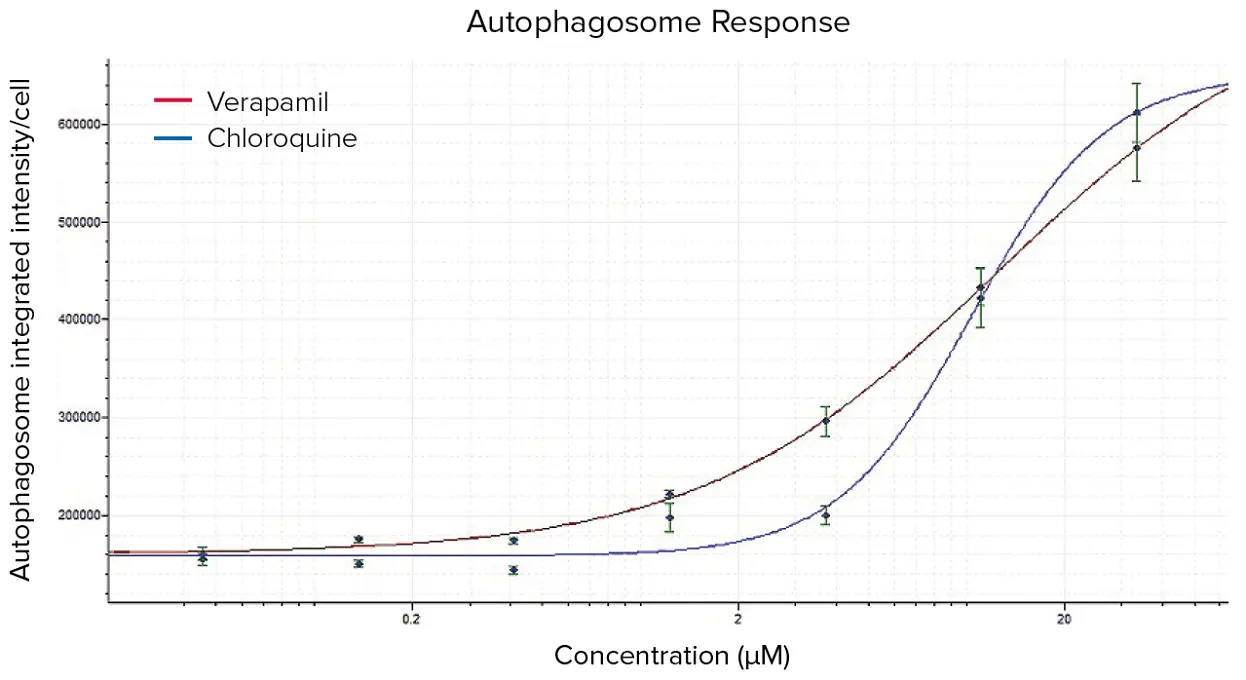
***図8。*ベラパミルとクロロキンのオートファゴソーム形成の用量反応曲線。図7で定義したカスタムモジュールを用いて画像を解析し、生成された測定値を用いてAcuityXpress解析ソフトウェアで曲線をプロットした
| EC 50 |
オートファゴソーム | リソソーム |
||
|---|---|---|---|---|
| Compound | PC-12 | Neuron | PC-12 | Neuron |
| Chloroquine | 5.5 µM | 5.8 µM | 4.4 µM | 2.0 µM |
| Verapamil | 21 µM | >60 µM | 18.8 µM | 9.5 µM |
| Rotenone Flat, no fit | Flat, no fit | Flat, no fit | 73 nM | Flat, no fit |
***図9. *試験化合物のEC50値。EC50値は、用量反応カーブを非線形モデルにフィット処理することにより、オートファジーを阻害または刺激する化合物について計算された。細胞の種類によって、薬物曝露に対する感受性が異なることは予想外ではなかった。
結論
我々は、特異性神経細胞培養において、実験条件に対するオートファジーを評価できることを示した。これにより研究者は、神経細胞のオートファジーに対する実験化合物の用量反応効果を調べたり、オートファジー、ひいては神経変性疾患に関連する神経細胞の生理学的メカニズムに影響を及ぼす可能性のある化合物ライブラリーをスクリーニングしたりすることができる。
ImageXpress Microシステムは、ワイドフィールド高解像度明視野および多波長蛍光イメージャー顕微鏡を含む一連の機能を備えており、384ウェルマイクロプレートで培養したヒトおよびラットの神経細胞の画像キャプチャを可能にした。MetaXpress®ソフトウェアは、これらの画像を解析し、オートファゴソーム、リソソーム、およびその他の可視化された細胞コンポーネントの凝集面積の測定値によって定量化された、実験条件とオートファジーの発生との関係を図示することができた。
参考文献
- Mizushima, Yoshimori and Levine (2010) Methods in Mammalian Autophagy Research. Cell 140:313-326.
- Jin H. Son, et. al. (2012) Neuronal autophagy and neurodegenerative diseases. Experimental and Molecular Medicine 44, 2:89-98.
PDF版(英語)