Application Note ウェールズから西部劇へ
細胞性熱ショック反応の研究
- 色素を使わずに細胞増殖をモニターする
- 蛍光細胞イメージングによる細胞死メカニズムの研究
- 細胞の画像化、細胞ベースアッセイ、ウェスタンブロットの検出をすべて1つのプラットフォームで実行できます。
PDF版(英語)
はじめに
細胞反応を調べるには、画像イメージング、細胞ベース の生存率や増殖アッセイ、タンパク質発現の変化を見るための ウェスタンブロットなど、情報を収集するための複数のアプローチが 必要になることがある。多くの場合、必要な結果を得るためには複数のインストゥルメンテーション・プラットフォームが必要であり、その過程でいくつかのソフトウェア・パッケージを学ぶ必要があるかもしれない。
このアプリケーションノートでは、SpectraMax® i3 Multi-Mode Detection Platformという単一のインストゥルメンテーションを用いて、関連する複数の細胞パラメーターのデータをどのように収集したかを示す。ヒートショックをモデルシステムとして使用し、イメージングやウェスタンブロットスキャンを含むさまざまな検出モードを使用して、多面的な細胞応答をどのように把握できるかを示した。
細胞を通常より高い温度にさらすと、アポトーシス経路が活性化され、熱ショックタンパク質HSP70の発現が増加することが知られている。健常またはストレス下の2つの異なる増殖条件下のCHO-K1細胞を熱ショックに暴露し、SpectraMax i3システムのイメージング機能を用いて増殖、生存能、アポトーシスを測定した。ScanLater™ウェスタンブロット検出システムを用いて、熱ショックに応答して発現が上昇するHSP70の発現を解析した。
- CHO-K1細胞(ATCC P/N CCL-61)
- 細胞培養培地(10%ウシ胎児血清および1%ペニシリン/ストレプトマイシン含有Ham's F12)
- 黒壁透明底組織培養マイクロプレート(Corning P/N 3603)
- SpectraMax i3 マイクロプレートリーダー
- SpectraMax MiniMax™ 300 サイトメーター
- EarlyTox Cell Integrity Kit(Molecular Devices P/N R8213)
- CellEvent Caspase-3/7 Green 検出試薬(Life Technologies P/N C10423)
- ScanLaterウエスタンブロット検出システム
- ScanLater:ユーロピウム標識ヤギ抗マウス抗体付き抗マウス評価キット(Molecular Devices P/N R8201
- ScanLaterウェスタンブロット検出カートリッジ
- 抗HSP70マウスモノクローナル抗体(R&D Systems P/N MAB1663)
- Immobilon-FL Membrane, 0.45 μm pore size (EMD Millipore P/N IPFL 000 10)
方法
CHO-K1細胞は、健常細胞とストレス細胞の2種類を用意した。健常細胞は培地を定期的に交換し、コンフルエンス80%以下で継代した。一方、ストレス細胞はオーバーコンフルエントにさせ、培地交換の頻度を少なくした。
完全なソリューション SpectraMax® MiniMax™ 300イメージングサイトメーター、ScanLater™ウエスタンブロットカートリッジ、最適化された試薬、業界をリードするデータ取得・解析ツールSoftMax Proなどのオプションにより、SpectraMax i3x* 検出プラットフォームは、1つのシステムで細胞パスウェイとタンパク質の活性化および発現を探索することができます。
ヒートショックの前日、イメージングと細胞ベースアッセイ用に、健常細胞またはストレス細胞を黒壁透明底96ウェル組織培養マイクロプレートに1ウェルあたり7500細胞で播種した。ウェスタンブロットサンプルには、細胞を6ウェル組織培養プレートに1ウェル当たり225,000細胞で播種した。
プレーティングの翌日、セルプレートの半分を45℃、90分間のヒートショックにかけた。ヒートショック直後、細胞をSpectraMax® MiniMax® 300イメージングサイトメーターの透過光(TL)チャンネルでイメージングし、形態の変化を調べた。ヒートショック後6時間と24時間に、細胞を再度撮像して増殖を測定し、形態を再検査した。StainFree™ Technologyを用いて、各ウェル内の個々のセルを色素なしでカウントした。
アポトーシスと細胞生存能の細胞ベースアッセイを行い、熱ショックがアポトーシスやその他の細胞死経路を誘導したかどうか、またその反応が健常細胞とストレス細胞集団で異なるかどうかを調べた。CellEventアッセイを用いて、コントロールおよびヒートショック条件下でアポトーシス細胞を定量した。Molecular Devices® EarlyTox™ Cell Integrity Assay Kitは、生細胞と死細胞の区別と計数に使用された。両アッセイとも、熱ショック期間の6時間後と24時間後に実施した。
ウェスタンブロットでは、6ウェルプレートで培養・処理したセルをトリプシン処理し、ペレット化し、0.5% Tweenとプロテアーゼ阻害剤を加えたPBSで洗浄・溶解した。細胞溶解液を遠心分離し、上清のタンパク質含量を測定した。2.1μgのセル抽出物を4-20%ゲルにロードし、PVDF膜に転写し、マウス抗HSP70、次いでユーロピウム標識抗マウス二次抗体でプローブした。タンパク質バンドは、ScanLaterウェスタンブロット検出カートリッジ付きSpectraMax i3リーダーを用いて検出、定量した。
細胞増殖
ヒートショック後、細胞はイメージングや他のアッセイに先立ち、6時間または24時間回復させた。この2つの時点で、SpectraMax® MiniMax® 300イメージングサイトメーターでStainFree細胞計数を用いて細胞数の差を定量化した。このソフトウエアによる細胞の同定と計数には色素は必要なかった。細胞の同定には、SoftMax® Proソフトウェアの事前設定が用いられた。ヒートショックを受けたセル、特にストレスを受けた集団で増殖の減少が観察され、それは24時間後に顕著になった(図1)。
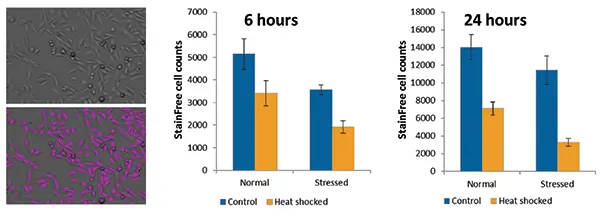
図1. 熱ショック後の細胞増殖のStainFree測定。左は未処理のCHO-K1細胞の透過光画像(上)、紫色のマスクはStainFree分析で同定された細胞を示す(下)。グラフは、コントロールまたはヒートショック条件下での正常細胞集団とストレス細胞集団のStainFree細胞数を示す。セル数は6時間と24時間で比較した。
アポトーシスアッセイ
6時間と24時間の時点で、セルをアポトーシスについてアッセイした。熱ショック後6時間までに、ストレスを受けた細胞はアポトーシス細胞の割合が高かったが、24時間までには、ストレスを受け、熱ショックを受けた集団の中に、より多くのアポトーシス細胞が見られた(図2)。対照的に、非熱ショック細胞はアポトーシス細胞の割合が低く、安定していた。
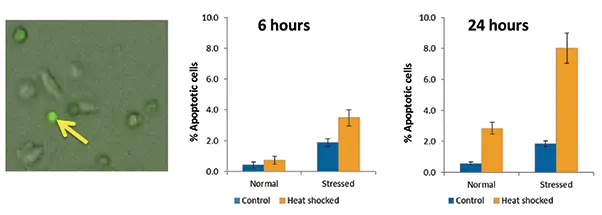
図2. コントロール細胞と熱ショック細胞におけるアポトーシス。左のパネルには、丸みを帯びた形態を持つアポトーシス(明るい緑色)細胞と、より扁平で細長い形状を持ついくつかの非アポトーシス細胞が示されている。黄色の矢印は、高レベルの緑色蛍光を持つアポトーシス細胞を指す。グラフは、コントロールおよびヒートショック条件下での、正常細胞集団とストレス細胞集団におけるアポトーシスの割合を示している。
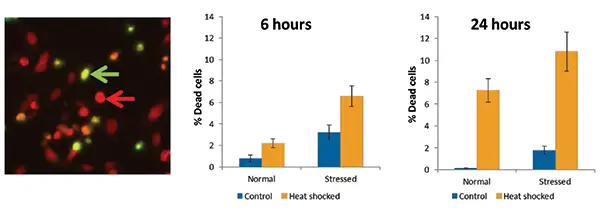
図3. ヒートショック後の細胞生存率の定量。左のパネルでは、熱ショックを受けた細胞をイメージングした(緑矢印は死細胞、赤矢印は生細胞)。グラフは、正常細胞集団とストレス細胞集団の両方で、熱ショックにより死細胞の割合が増加したことを示している。
細胞生存率アッセイ
細胞がアポトーシス以外の方法で死滅しているかどうかを調べるために、EarlyTox Cell Integrity Kitが用いられた。熱ショックにより、特に24時間後に細胞死の増加が観察された。ストレスを受けた細胞は、正常集団よりも死細胞の割合が全体的に高かった。これらの結果はアポトーシスの結果とよく一致しており、観察された細胞死のすべて、あるいはほとんどがアポトーシスによるものであることを示唆している。
HSP70誘導
ScanLaterウェスタンブロット解析の結果、予想通りHSP70はヒートショックに応答して誘導されたが、この応答はストレス細胞よりも正常細胞集団の方がはるかに大きかった。SoftMax® ProソフトウェアのScanLater解析により、ブロット上のバンドの強度が定量された。熱ショック6時間後の健常細胞ではHSP70が48倍増加したが、ストレス細胞では1.5倍しか増加しなかった(図4)。非ヒートショック対照細胞で発現したHSP70の量は、ストレス細胞集団では正常細胞の約18倍であった。
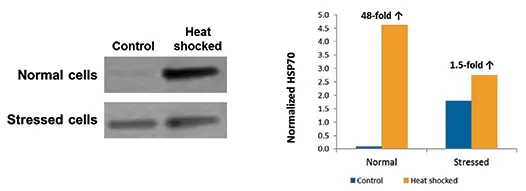
図4. HSP70発現のウェスタンブロット解析。処理6時間後のコントロールおよびヒートショックセルにおけるHSP70発現のウエスタンブロットを左パネルに示す。SoftMax® ProソフトウェアのScanLater解析で行った定量をグラフに示す。正規化HSP70」は、積算密度からバックグラウンドを差し引いた値を示し、単位は百万。
結論
SpectraMax i3 マルチモード検出プラットフォームを用いて、細胞ベースイメージングアッセイとウェスタンブロット検出を行い、ヒートショックに対する細胞応答を調べた。StainFree cell countingでは、正常細胞およびストレス細胞における熱ショックによる増殖の変化を同定した。アポトーシスと細胞生存率アッセイにより、熱ショックによる細胞死のメカニズムが明らかになった。最後に、ウエスタンブロット分析により、コントロール細胞とヒートショック細胞におけるHSP70の誘導を定量することができた。アポトーシスと細胞生存能アッセイの結果から、我々は、ヒートショックに応答して起こる細胞死のすべて、あるいはほとんどがアポトーシスによるものであると仮定した。HSP70の誘導は、ヒートショック条件下では正常(非ストレス)細胞で最も高かった。HSP70は熱ショック前にもストレス細胞で誘導され、熱ショック下ではさらに誘導された。しかし、ストレスを受けた細胞のHSP70は、健常細胞で誘導される高レベルには達しなかった。その結果、ストレス細胞はアポトーシスからあまり保護されず、観察されたアポトーシス細胞の割合が高くなったのかもしれない。
SpectraMax i3システムとSoftMax Proソフトウェアによる解析により、従来は複数の検出装置と複数の異なるデータ解析ツールが必要であった細胞機能の多面的な調査が、単一のプラットフォームで実行できるようになった。

PDF版(英語)