2023/1/27
3Dオルガノイドと複雑な細胞アッセイの自動化【ポッドキャスト】
遺伝子治療や個別化医療による高度な創薬時代を迎えるにあたり、複雑な疾患を研究し、薬剤の治療効果を評価し、患者の健康にリスクをもたらす副作用を特定するための準備が必要である。残念ながら、動物モデルや2次元細胞培養といった現在の前臨床試験法は不十分である。これらのモデルの物理的・化学的特性は人間の状態を表していないため、前臨床での薬剤評価は臨床での成功には結びつかない。だからこそ、オルガノイドのような3D細胞モデルの開発は、薬剤の有効性と安全性の評価を改善するための大きなマイルストーンとなり得るのです。
オクサナ・シレンコ博士は、モレキュラー・デバイス社のアッセイ開発担当シニア・マネージャーであり、3Dバイオロジーのための複雑な細胞ベースモデルの開発、ハイコンテントイメージング、アッセイの自動化に取り組んでいる。

Bayer、Fibrogen、Bioseekなど複数のバイオテクノロジー企業で細胞ベースアッセイのハイスループットを開発した後、2009年に研究科学者としてMolecular Devicesチームの一員となる。幹細胞由来の3Dモデルの開発と最適化を担当し、抗がん剤スクリーニングや神経細胞、心臓血管系、肝臓の薬物毒性評価を行う。オクサナは生化学/生物物理学の博士号を持ち、15年以上の業界経験を持ち、35以上の科学論文を執筆している。
このポッドキャストの抜粋では、シニア・サイエンティストのオクサナが、3D細胞イメージングの課題である画質、ハイスループット、自動化、解析に取り組みながら、3D細胞モデルの利点について論じています。
1. なぜ3D細胞モデルや3Dオルガノイドが疾患研究や創薬スクリーニングに有用なのか?
現在の疾患研究や医薬品開発における主な問題は、開発された医薬品のうち、臨床に使われるのはわずか3%程度に過ぎないということである。臨床試験で失敗する医薬品の大半は、有効性の欠如や望ましくない毒性の問題によるものです。創薬を促進し、臨床での成功をより正確に予測するためには、より優れたアッセイシステムと疾患モデルが必要である。
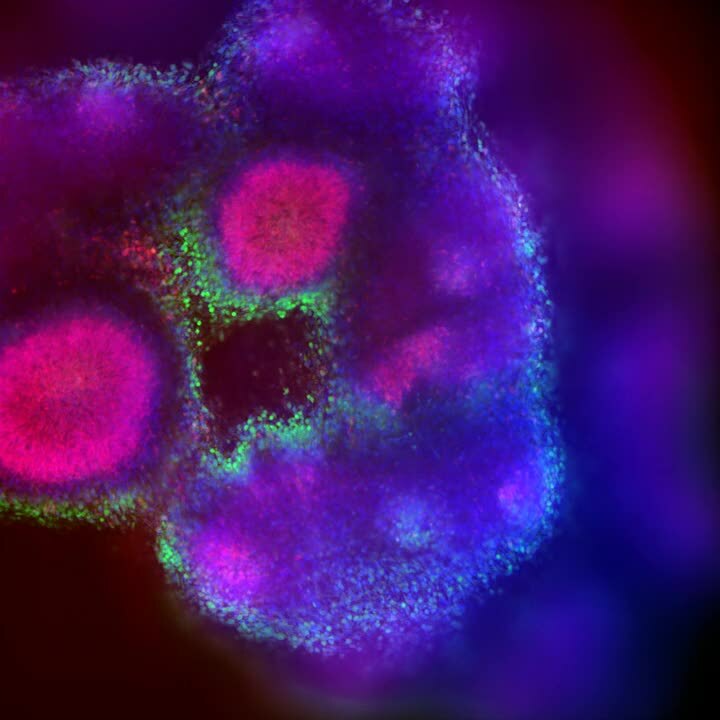
今日、生物製剤は、創薬や薬剤開発に使用できるアッセイやモデルをより複雑化する方向にシフトしている。3Dモデルは、従来のセルベースのモデルと、組織や臓器とのギャップを埋めるものと考えられている。スフェロイド、オルガノイド、Organ-on-a-chipを含む3Dモデルは、肝臓、免疫細胞、心臓細胞、線維芽細胞など、様々なヒト細胞タイプを提示する。また、3D腫瘍増殖、腸オルガノイドの陰窩、神経管、液体の流れなど、ヒト組織の形態を模倣することもできる。最後に、肝臓の代謝活動から心臓オルガノイドの拍動、脳オルガノイドの神経細胞活動のスパイクまで、組織の機能性の少なくとも一面を表現することができる。このように複雑で精巧になることで、組織内のプロセス、セルタイプ間の相互作用、薬物に対する反応、毒性作用、組織内への薬物浸透プロセスなどを模倣することができる。
大脳オルガノイドは、発達中の脳を彷彿とさせる組織を示す。
2. なぜ3Dモデルの複雑さは、研究者にとってハードル/課題となるのでしょうか?
従来の2D細胞アッセイは作業しやすいですが、3Dアッセイは予測可能性が高く、より生物学的に関連性の高いデータを作成することができます。しかし、3D研究への関心が高まっているにもかかわらず、技術的なハードルやアッセイの複雑さによって、アッセイの幅広い導入は制限されている。複雑さが増すと課題も生じるが、インストゥルメンテーションの開発や自動化の開発により、科学者はより高いスループットと精度で3Dアッセイを実施できるようになる。
3. 3Dオルガノイドの開発と分析の典型的なワークフローの概要を教えてください。
オルガノイドアッセイの典型的なワークフローには多くのステップが封じ込められ、このプロセスは通常、2Dワークフローのステップよりもはるかに長くなります。
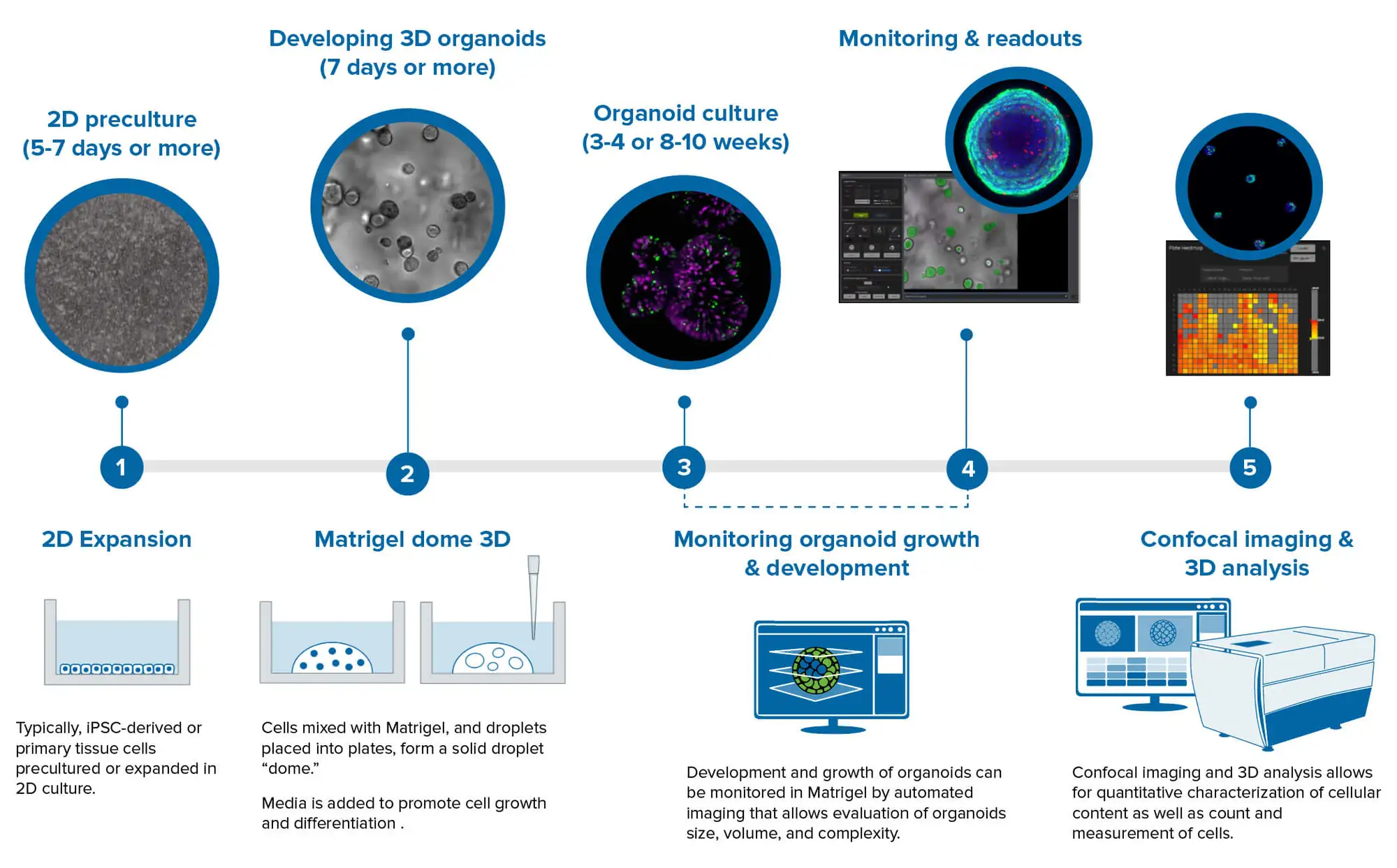
3Dオルガノイドは、腸オルガノイドや人工多能性幹細胞(iPSC)のような初代細胞、例えば神経細胞オルガノイドや心臓オルガノイドから誘導することができる。ワークフローは、iPS細胞の2D前培養または膨張から始まり、分化のステップが続く。その後、セルはマトリゲルと混合され、通常マトリゲルドーム内で展開され、継代培養や展開も含まれる。腸オルガノイド、大腸オルガノイド、膵臓オルガノイド、肝臓オルガノイドは通常、このマトリゲルドームステップを用いて開発される。
あるいは、他のオルガノイドタイプではマトリゲルを必要とせず、代わりに低付着プレーティングで発生させるものもある(例えば心臓オルガノイド)。
オルガノイドの発生には数日から数週間かかる。プロトコールによっては数ヶ月かかるものもある。これは非常に面倒なプロセスであり、自動化の恩恵は大きい。
最後に、薬物治療、ウイルス感染性アッセイ、毒性評価のいずれであれ、エンドポイントアッセイは、96ウェルまたは384ウェルプレートのマルチウェルフォーマットでセットアップされる。
次に、細胞は薬剤で処理され、ATPアッセイ、細胞死アッセイ、ハイコンテントイメージング、カルシウムオシレーションなどのリードアウトのために処理される。
4. 3D細胞モデルワークフローを具体的にどのように研究に応用しているのか、少し教えていただけますか?
私たちは、複雑な3Dワークフローのための自動イメージングと画像解析だけでなく、自動細胞培養のための自動化プロトコルの開発に焦点を当てています。最近では、トリプルネガティブ乳がんに対するより効率的な抗がん剤を見つけるための自動スクリーニングアッセイを開発し、実施しました。我々は、薬剤耐性疾患の表現型を表す患者由来の癌オルガノイドを用い、3Dオルガノイドの培養、薬剤介入のシミュレーション、腫瘍細胞を死滅させる化合物を同定するエンドツーエンドアッセイの実行に自動化を適用した。我々は化合物のライブラリーをテストし、現在の標準的な薬剤よりも高い有効性を持ついくつかの候補を見出した。
5. オルガノイドの開発と解析の自動ワークフローについて教えてください。
私たちはモレキュラー・デバイス社で、複数のインストゥルメンテーション機器を1つの複雑なシステムに統合した自動ワークセルを作りました。これには、ベックマンバイオメック自動リキッドハンドラー、LiCONiC自動インキュベーター、ImageXpress HT.aiハイコンテントイメージングシステム、SpectraMaxプレートリーダーとAquaMaxウォッシャー、Bionex自動遠心機が含まれます。すべてのコンポーネントは、協調ロボットPreciseFlex 400によって接続されており、希望する時点でプレートをインストゥルメンテーションから別のインストゥルメンテーションに移動させることができ、プレーティング・ソフトウェアは、すべてのシステム・エレメントがシームレスに連動することを保証する。各装置には、細胞の供給やオルガノイドプレーティングなど、異なるステップ用に設計された複数のプロトコルがあり、スケジューラーによって指定された時間に呼び出すことができる。

モレキュラー・デバイスのオルガノイド・イノベーション・センターは、最先端技術と新しい3Dバイオロジー手法を組み合わせ、複雑な3Dバイオロジーのスケーリングにおける重要な課題に取り組んでいます。
イメージング法もまた、オルガノイド研究にとってエキサイティングな技術分野である。オルガノイドやOrgan-on-a-chipをイメージングするためには、高度な光学系を使用する必要があります。ImageXpressハイコンテントイメージャーシステムは、3Dサンプルに対していくつかの利点がある:
強力なレーザーと共焦点光学系により、下から順に5-10ミクロン単位でZ-スタック画像を取得することができる 共焦点光学系により、ピントが合っていない光を除去することができるため、オルガノイドやマトリゲル全体でより鮮明な画像を得ることができる。
次に、MetaXpress®画像解析ソフトウェアが各2Dスライスの画像を解析し、データを3D空間に変換します。オルガノイド、セル、あるいは細胞内小器官を特徴付けるために、複数の測定値を得ることができる。これらの測定は、細胞数、強度、体積、面積、距離などを定義するのに役立ち、形態、細胞含有量、生存率の変化をモニターし、定量化することができる。また、機械学習の要素も備えており、対物レンズや特徴を認識するようにソフトウェアをトレーニングすることで、より効率的で洞察に満ちた分析を行うことができる。
6. 自動化は具体的に複雑系の研究にどのように役立つのでしょうか?
自動化することで、2ヶ月間、毎日あるいは2日おきにセルに給餌するような労力や反復作業を減らすことができる。また、ハイスループットで研究を加速させるのに役立ちます。例えば、3つの細胞株や5つの突然変異を研究する代わりに、自動化によって50の細胞株をテストし、100の突然変異を研究することができる。
機械学習アルゴリズムによるハイコンテントイメージャーは、オルガノイドや細胞の様々な変化を観察し、特徴付けることを可能にし、複数の読み出しを提供し、細胞の成長、分化、細胞周期、死、アポトーシス、遺伝子発現、あるいはシグナル伝達機構の活性化に関する貴重な情報をもたらす。
7. 今後の研究で、これらのシステムをどのように再利用しますか?
がん生物学研究に加えて、腸オルガノイド、幹細胞ワークフロー、心臓オルガノイドなど、他のワークフローも積極的に開発しています。
8. 3Dオルガノイド解析の自動化は、今後どのように進化していくのでしょうか?
生物学が進化し、アッセイの複雑さが増すにつれて、自動化は病気のメカニズムをよりよく理解し、創薬を加速し、最終的には病気を治療するためのより良い方法を見つけるためにますます重要になると考えています。
新しく、より高度な技術やインストゥルメンテーションを開発することで、生命科学の進歩にさらに貢献できると考えています。
3Dオルガノイドの背後にある基本原理と、現在のボトルネックを理解することは、創薬にこの先進的モデルを成功裏に開発・利用するために極めて重要である。
ポッドキャスト全文を聞く
さらに詳しくお知りになりたい方は、ポッドキャスト「複雑なアッセイ:ベックマン・コールター・ライフサイエンス、イアン・シューメーカー&モレキュラー・デバイス、オクサナ・シレンコ博士」をお楽しみください。
Drug Target Review - Episode 14 - Beckman Coulter社 Ian Shoemaker氏 & Molecular Devices社 Dr Oksana Sirenko氏
オルガノイドモデルがどのように開発され、専門家の研究においてどのように使用され、3Dオルガノイド解析の自動化が今後どのように進化していくのか、さらに多くのことを発見してください!