2020/12/3
3D細胞イメージングと解析ワークフローを最適化する7つのヒント
細胞生物学の分野がより複雑なアッセイへと移行するにつれ、3D細胞システムは、創薬や疾患モデリングにおいて、従来の2Dアッセイと比較して、より生理学的に適切な情報を提供することが証明されてきた。従来の2Dシステムでは、細胞は平坦な表面上で伸展、接着、増殖するが、3Dシステムでは、細胞-細胞/ECM相互作用、化合物の浸透、用量反応を通じて、生体内組織環境をよりよく模倣することができる。
3Dアッセイの複雑化に伴い、画像取得や解析に要する時間、データ保存要件の増加など、細胞イメージングに関する新たな課題も生じている。適切なツールとテクニックを使用することで、これらの課題を克服し、より効率的な方法で信頼性の高いデータを得ることができます。
ここでは、3D細胞イメージングと解析ワークフローを最適化するための7つのヒントをご紹介します。
1. 3D細胞イメージングに適切なインストゥルメンテーションとテクノロジーを使用する。
3D細胞培養を扱う場合、従来の2D細胞培養のように1つの細胞平面の画像を取得するだけでは不十分です。その代わりに、Z-スタック画像と呼ばれる、垂直方向の様々な画像(通常10~15枚)を取得する必要があります。ImageXpress® マイクロコンフォーカルハイコンテントイメージングシステムのような自動化されたコンフォーカルイメージングプラットフォームは、3D構造のより薄い光学的断面を画像化することを可能にし、背景のボケを大幅に減少させ、より良い画像解像度とより微細な細胞ディテールをもたらします。また、ImageXpressシステムの水浸対物レンズは、画質の向上に重要な役割を果たしています。
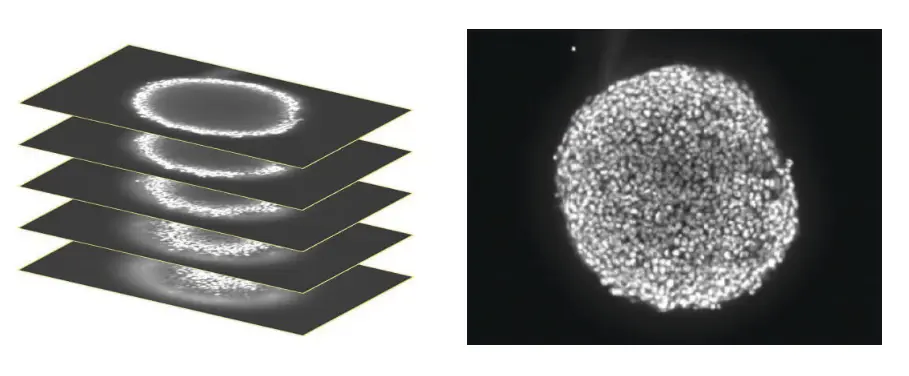
スフェロイドの深さの約半分に及ぶZ-平面の共焦点画像のスタックを取得した(左)。スフェロイドのどの面でも、一部のセルだけに焦点が合っているため、解析を容易にするため、焦点の合っている領域を1つの2D画像に統合した(右)。
2. 3Dイメージング専用に設計されたマイクロプレートを使用する
3Dイメージング専用に設計されたマイクロプレートを使用することが重要です。通常、96ウェルまたは384ウェルのクリアボトムプレートです。コーニングの丸底プレートはスフェロイド作製に便利で、3Dイメージングにも理想的です。これらのプレートは、画像取得中、スフェロイドを中央に固定しておくことができる。一方、底が平らなプレートは、サンプルの中心を保つのが難しく、問題が多い。
3. イメージング前の適切な細胞調製技術に従うこと。
使用する3Dサンプルの種類を考慮することが重要です。サンプルの種類によって、準備やイメージングに必要な条件が異なるからです。スフェロイドや厚い組織サンプルのような固形物を扱う場合、光の透過に限界があり、細胞の干渉を引き起こす光散乱のため、可視化できる距離には限りがあります。一方、マトリゲルのようなマトリックス中のセルは透明であるため、対物レンズの可視化が可能であり、より多くの光を透過させて分析を行うことができる。
スフェロイドのような3D細胞オブジェクトの染色は、色素がサンプルの表面だけでなく内部にも浸透しなければならないため、厄介な場合がある。核染色に使用されるHoechst色素の場合、効果的な浸透を得るためには2~3倍の濃度を使用する必要があるかもしれない。また、染色に要する時間も長くする必要があります。通常、Hoechstのような色素は染色に15-20分を要する。しかし、スフェロイドを扱う場合は、染色に2~3時間必要かもしれません。色素の中には親油性のものがあり、サンプルに浸透せずに表面にこびりついてしまうことがある。抗体による染色は特に難しく、科学者たちは効果的な染色プロトコルの開発に取り組んでいる。
4. 画像取得開始時の3Dサンプルの中心位置の確認
撮影を開始するには、まず対物レンズの位置を撮影部位の中心で特定し、z位置(垂直位置)のほぼ中央に位置する最初の焦点を見つける必要があります。例として、直径約500ミクロンのスフェロイドを撮像する場合、開始位置はウェル底から約50ミクロン上になります。この開始位置で、異なるチャンネル用の露光とオフセットを調整することができます。
スフェロイドが中心からずれることがあるので、プレートの寸法を調節してスフェロイドが中心にあることを確認する必要があるかもしれません。また、スフェロイドが視野内にあることを確認するために、プレートの四隅をチェックすることもできます。
5. 3D画像取得の範囲を最初から最後まで決める
これは、対物レンズ内の異なる深さの画像をスタックして取得し、どこで開始し、どこで終了するかを正確に定義し、さらにその間のステップ数を定義することを含みます。通常、10倍の対物レンズの場合、ステップ間の距離は8~10μmで開始します。20倍の対物レンズの場合は、ステップ間の距離を3~5μmから始めるといった具合です。
ステップ数を増やすと解析と可視化の質は向上しますが、画像取得と解析に時間がかかり、データストレージに負荷がかかります。さらに、画像の取りすぎはサンプルの色あせの原因にもなりかねません。最終的には、適切なバランスを見つけるために実験することです。通常、私は1枚のプレートに対して2つの異なるプロトコルを使用する。ひとつはスライス間の距離を大きくとり、もうひとつは小さくとる。
また、画像取得の最初に、撮影したいプロジェクション画像のタイプを指定することも非常に重要です。通常、共焦点イメージングでは、対物レンズは "最大プロジェクション画像 "に設定され、サンプルに関する多くの情報が自動的に生成されます。この時点で、3D解析の代わりにプロジェクション画像のみを解析することを選択し、処理を高速化することができます。
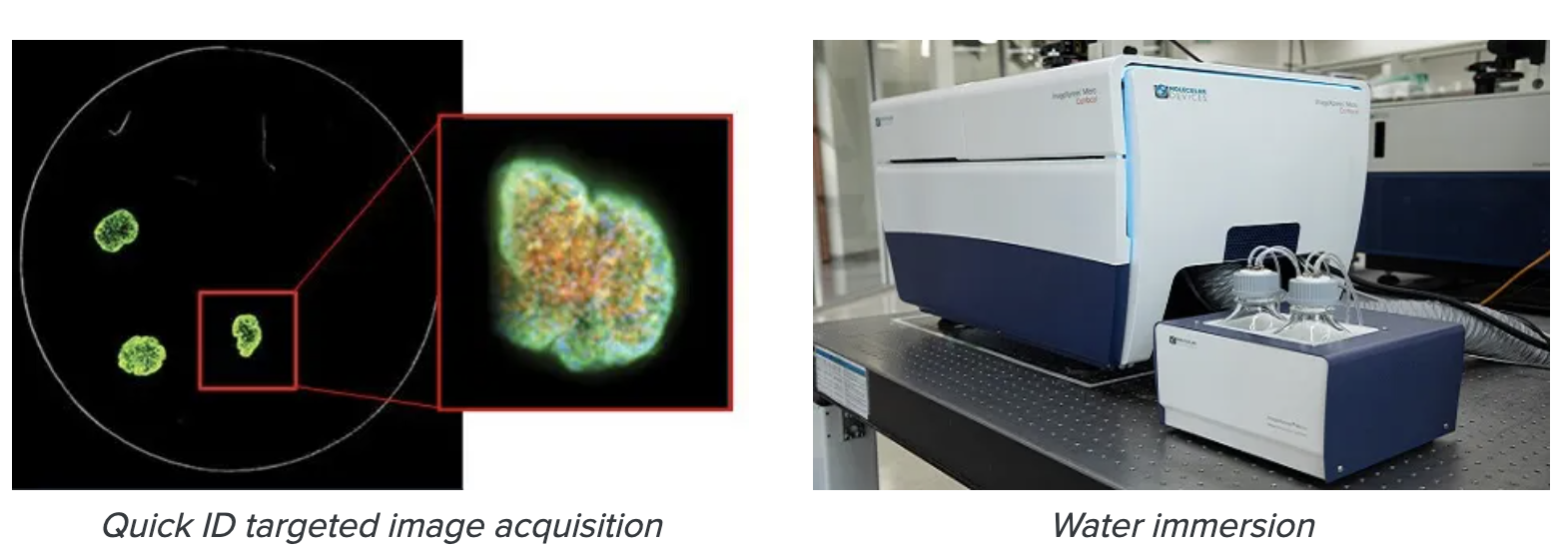
6. QuickIDと水浸対物レンズを活用し、画像取得時間を短縮しましょう。
3D画像取得中、対物レンズがウェルの中心から離れてしまい、見つけにくくなることがあります。これは、フラットボトムプレートでスフェロイドを扱う場合に特に当てはまります。この課題を克服するために、ImageXpress® Micro ConfocalシステムにはQuickIDターゲット画像取得という機能が搭載されています。このシステムは、低倍率でイメージングして対象オブジェクトを見つけ、その後自動的に高倍率で対象オブジェクトを単一視野で取得します。これにより、撮影時間とデータ保存の必要性が大幅に削減される。水浸対物レンズの使用も有益です。対物レンズは3Dサンプルからより高い信号を収集するため、露光時間を短縮し、画像取得速度を向上させることができます。
7. 適切な3D解析ソフトウェアを使用する
当社のセルラーイメージングシステムには、MetaXpress® ハイコンテント画像取得・解析ソフトウェアが含まれており、解析をよりシームレスに行うための多くのツールが提供されています。最も簡単な方法は、ソフトウェアの最大プロジェクションアルゴリズムを使用して、スタック画像のインフォーカス領域を1つの2Dプロジェクションに結合することです。核のカウント、セルスコアリング、神経突起伸長など、通常の2D解析用のツールを使用することができます。
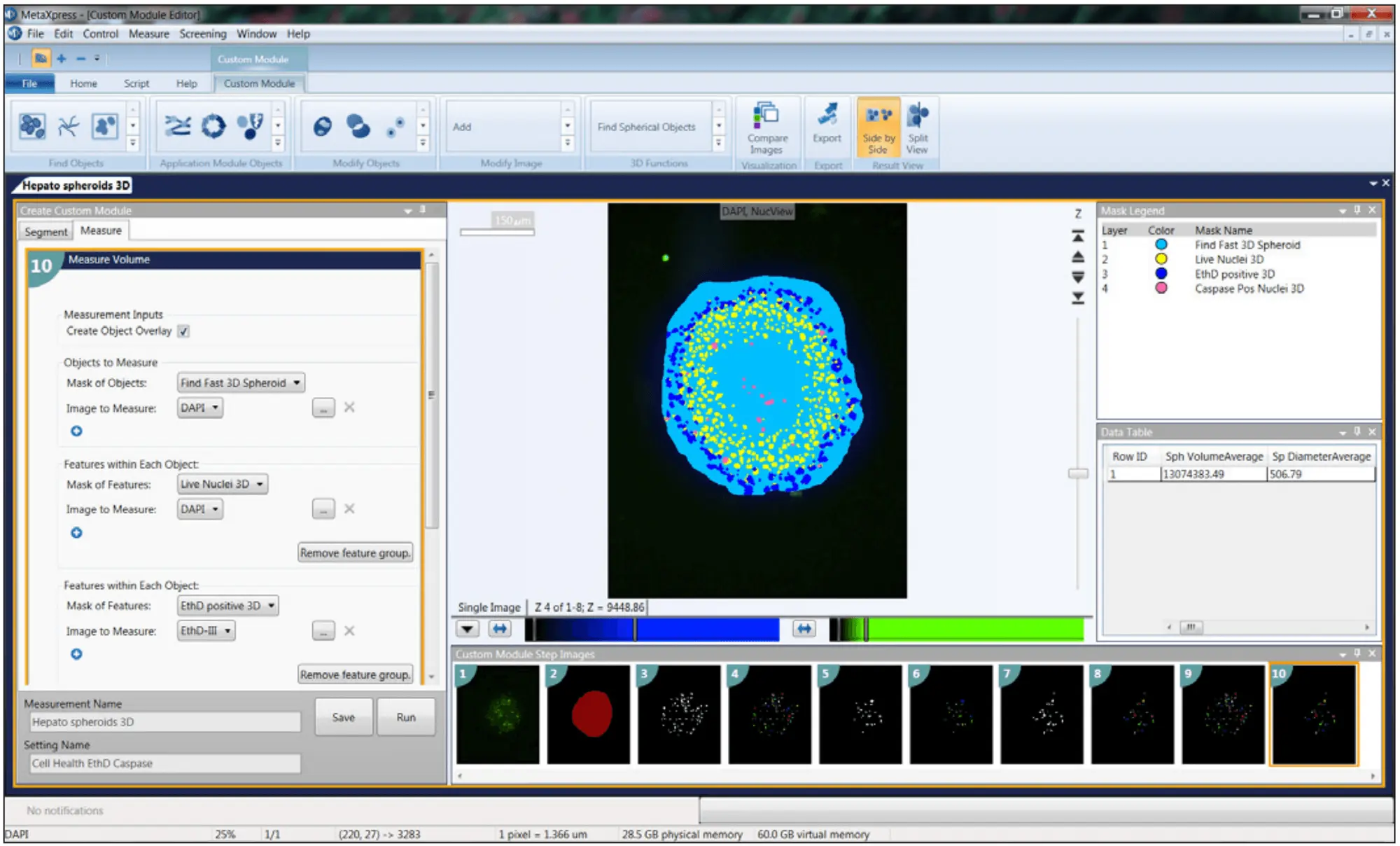
3D解析では、各Zスタックで対象オブジェクトを見つけ、それらを結合することができます。例えば、マトリゲル中のスフェロイドやセルを扱う場合、"Find round object "ツールを使えば、おおよその対物サイズと強度のしきい値を定義すれば、ワンステップで対物を見つけることができます。もう一つの一般的なツールは "Connect by best match "である。ここでは、解析プロトコルを選択し(核のカウント、生死判定、細胞スコアリングなど)、zスライスごとに別々に実行します。その後、アルゴリズムが、許容範囲として指定したスライス間の対物レンズの最大シフト量に基づいて、3Dボリューム内の隣接するzスライス間で特定の対物レンズを連結します。その後、オブジェクトを3Dフォーマットで可視化し、さらに重要なこととして、3Dの体積測定を実行して、体積やオブジェクト間の距離などを特定することができます。
3D細胞イメージングと解析ワークフローの最適化について詳しくは、3D細胞モデルのウェブページをご覧ください。