2023/9/12
工業的規模のオルガノイド生産:課題、利点、解決策
2次元の細胞株ではヒトの生物学的システムを表現する複雑さに欠けるという認識が、科学者たちに生物医学研究のためのより高度なin vitro培養ツールを求めるように促した。最近の進歩は、スフェロイドやオルガノイドのような3Dモデルの作成につながった。
スフェロイドは一般に、複数のタイプのセルが自由に浮遊する集合体であり、腫瘍の組織を反映する上で、複雑性が低いことは間違いない。対照的に、オルガノイドは、分化した幹細胞から自己集合して、臓器の構造や生物学的機能を再現しながら、その臓器をミニチュアのスケールで再現する空間的配置を作る能力によって定義される。したがって、オルガノイドはヒトの病気を研究したり、薬剤の有効性や安全性を評価したりするための生理学的に適切なモデルである。例えば、オルガノイドは、同じ薬剤で治療した場合の患者の反応を模倣する。オルガノイドは、体内のほとんどの臓器から、病気の組織や健康な組織を作り出すことができる。
その結果、オルガノイド細胞モデルは、医薬品開発のパイプラインを加速し、臨床試験における高い減少率とそれに伴うコストを削減する可能性を提供する。
しかし、これが普及し、ハイスループットスクリーニングアプリケーションに適合するためには、オルガノイドのスケール生産が必要である。
試験時の一貫性、再現性、統計的妥当性を確保するために、オルガノイドの生産をスケールアップすることは困難である。このポッドキャストでは、オルガノイドの専門家であるモレキュラー・デバイス社カスタム・オルガノイド・サービス部長のビクトリア・マーシュ・ダーバンと、シンシナティ小児病院幹細胞・オルガノイド医療センター研究開発部長のマグダレナ・カセンドラが、工業的規模のオルガノイド生産の利点と課題について議論している。
オルガノイド作製の基本
ルガノイドは通常、多能性幹細胞または成体幹細胞から生じる。
多能性幹細胞(PSCs)は、患者の皮膚線維芽細胞や末梢血単核細胞から得ることができる。PSCは自己複製が可能で、複数の細胞に分化するように再プログラムすることができる。PSCsを使用する際には、複数の細胞系譜の特徴を生み出すためにさまざまな成長因子の適用を伴う複雑な多段階プロセスで、胚発生をin vitroで再現する必要がある。これによって、同じ元の細胞から複数のオルガノイド型(脳、肺、心臓、腎臓、肝臓など)への分化が誘導されるため、人工多能性幹細胞(iPSC)と呼ばれている。
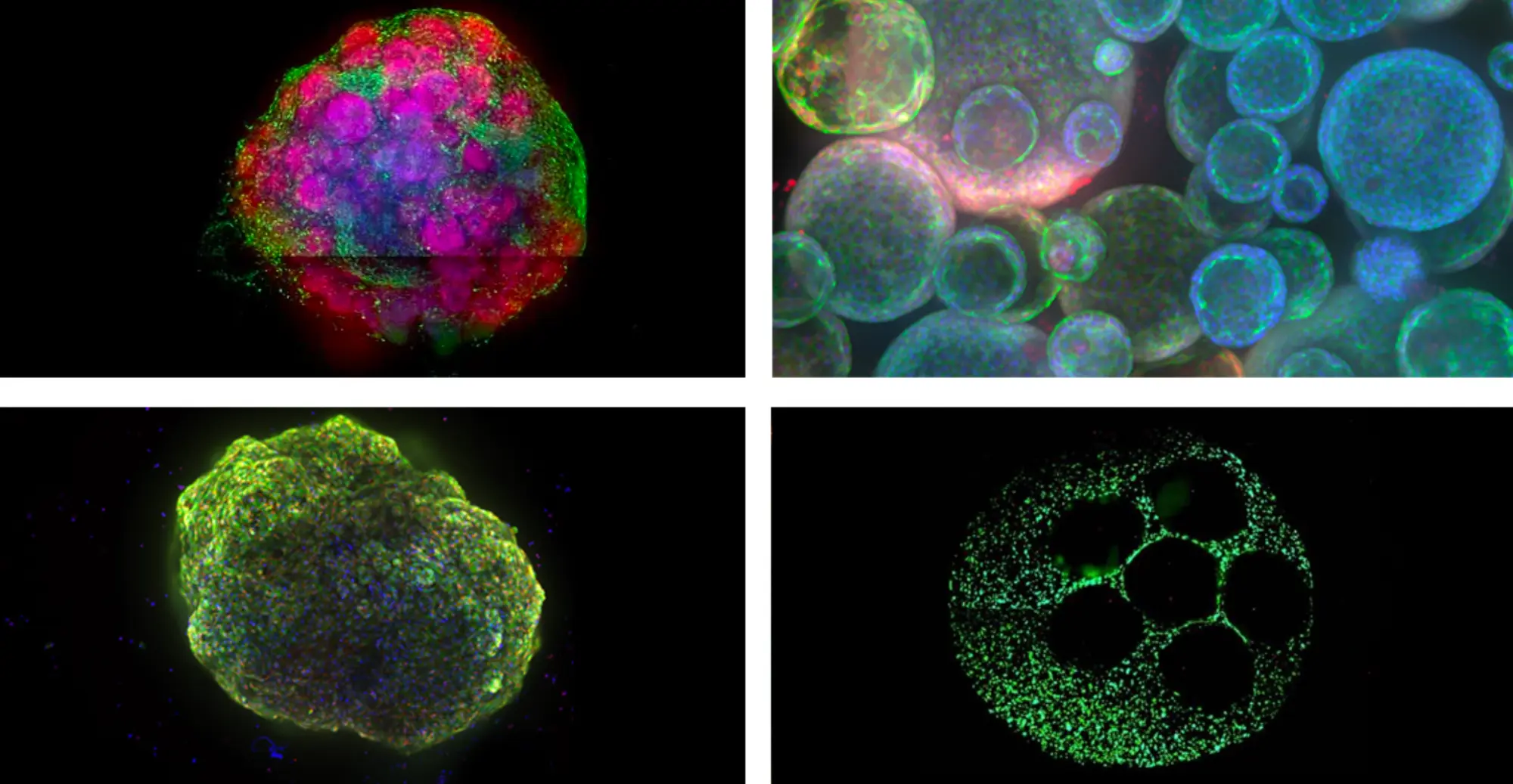
左上から脳オルガノイド、肺オルガノイド、心臓オルガノイド、3D肝臓モデル。
患者の生検サンプルや切除組織から採取された成体幹細胞は、生得的な細胞メカニズムを持っている。言い換えれば、細胞外マトリックス中で培養し、適切な組織特異性増殖因子を与えれば、実験室で自然にオルガノイドを形成することができる。
一般に、一次患者組織生検から単離された成体幹細胞からオルガノイドを製造することは、iPSCを用いるよりも簡単である。
オルガノイド製造に関わる課題
オルガノイド研究はまだ新しく、成長過程にあるため、科学者は、出発点として使用する幹細胞の種類に関わらず、オルガノイド生産の最適化とスケールアップにおける課題に直面している。
成体幹細胞由来のオルガノイドを使用する際の主な課題のひとつは、ハイドロゲルを用いて完全に3Dで行う必要がある細胞培養プロセスに関連している。このプロセスは、2次元培養よりもはるかに難しく、時間もかかる。
PSCベースのワークフローは、所望の分化パターンに操作するのが難しいため、さらなる複雑さをもたらす。マグダレナは言う: 「iPSCを使用する場合、様々な細胞系譜を模倣するために様々な成長因子を導入し、試験管内で胚発生を再現する必要があります。幸いなことに、高度に自動化された最先端のバイオプロセスが開発された今日、これらの制限は克服することができる。
このようなオルガノイドは、さまざまな組織型をより包括的に扱うことができる反面、その製造には時間がかかり、in vitroでエラーを起こさずに分化させるためには、かなりの訓練と専門知識が必要となる。
バイオリアクターは、注意深くモニターされた環境条件下でオルガノイド(iPS細胞と成体幹細胞の両方)を培養するのに広く使われている。特異性は、ハイドロゲル ベースのマトリックスでの初期増殖からバイオリアクター での懸濁への移行に細心の注意を要することである。
ハイドロゲルに懸濁している間は、iPSCは機械的刺激にさらされない。しかし、3D懸濁液に入れると、急速に変化する剪断応力にさらされ、成長速度と分化に影響を与える可能性がある。低レベルのせん断応力は分化を促進するが、過度のせん断応力は細胞損傷と細胞死を誘発する。したがって、バイオリアクターのせん断応力は、オルガノイドの収量を失うことなく、望ましい分化状態を達成するために注意深く最適化される必要がある。現在の戦略には、バイオリアクターの回転速度を調節したり、シアストレスのないバイオリアクターを使用したりすることが含まれる。最適な戦略は、目的のオルガノイドに必要な正確な増殖と分化の要件と、初期幹細胞を運ぶハイドロゲルがバイオリアクターに適合しているかどうかによって決まる。例えば、柔らかいハイドロゲルは、バイオリアクター内でせん断応力によって破壊され、幹細胞凝集体の完全性を危うくする可能性がある。
もう一つの課題は、成体幹細胞の元となる材料を入手するのが難しいこと、すなわち、適切なオリジナルのオルガノイド株や一次患者の生検材料を見つけるのが難しいことである。現在、オルガノイド研究の大半は学術研究機関で行われており、オルガノイドは非営利の研究目的でのみ生産されている。しかし、アカデミアから製薬会社などの商業的環境に移行すると、必然的に倫理的な懸念が生じる。患者サンプルからのオルガノイド培養を商業化する際には、倫理的同意を考慮しなければならない。
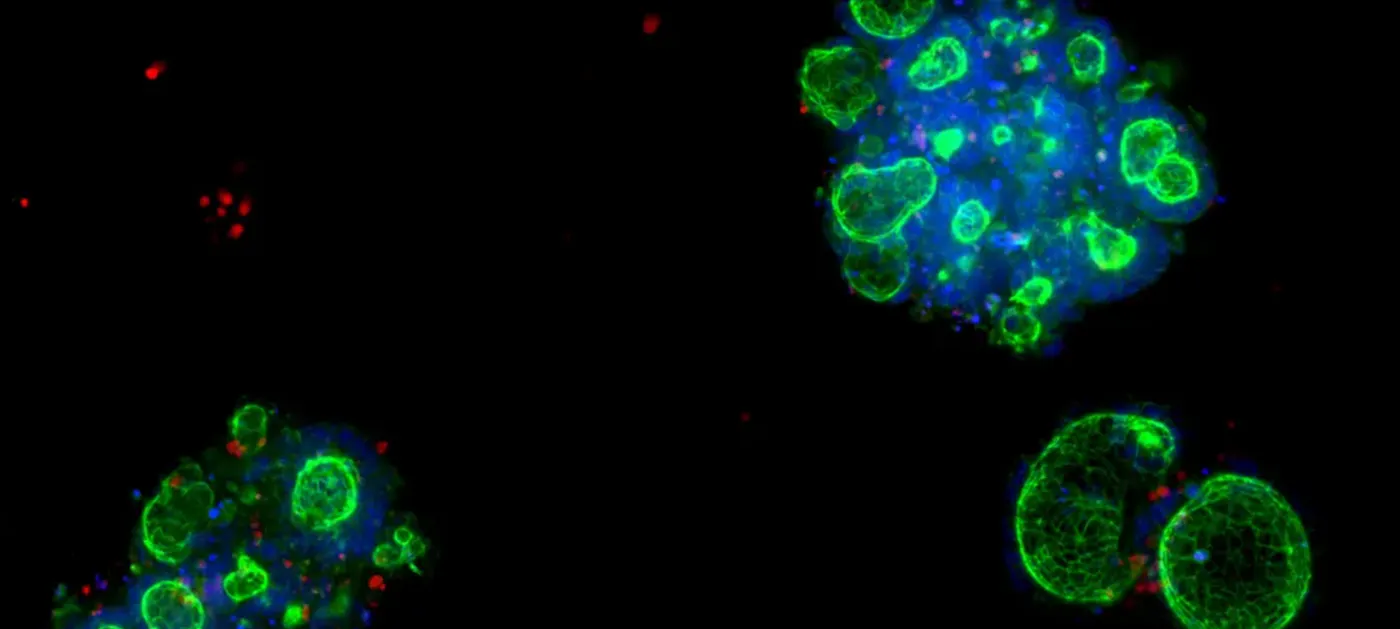
大腸オルガノイドは、炎症性腸疾患(IBD)などの疾患の研究に用いることができる。
オリジナルのオルガノイドからオルガノイド培養を 再現することは、細胞株の最適化プロトコールが異な るため、面倒な場合もある。例えば、大脳(脳)オルガノイド培養では、IPCSを神経誘導培地に移植してからハイドロゲル液滴で培養する。ビクトリアによれば、「プロトコールは、ソースとなる組織の種類、例えば、がん組織であるかどうかや、がんのタイプ・サブタイプによって大きく異なることがあります。そのため、生産ワークフローをラインごとに最適化する必要があり、専門家の目が必要になるのです"
プロトコールの実施に一歩間違えれば、シングルセル細胞株は望まない表現型に分化してしまう。
プロトコールは、ソースとなる組織の種類、例えばがん組織であるかどうかや、がんのタイプ・サブタイプによって大きく異なる可能性がある。そのため、生産ワークフローをラインごとに最適化する必要があり、専門家の目が必要となる。
オルガノイドをスケールアップする利点
オルガノイドの生産規模を拡大することは難しいが、その見返りは大きい。
マグダレナによれば、主な利点のひとつは、バイオ医薬品への応用が容易になることである。"オルガノイドをスケールアップすることで、業界標準や規制当局の慣行に適合するようになり、創薬や幹細胞治療、個別化医療への応用が容易になります"。
オルガノイドの大量バッチ生産は、学術研究にも産業研究にも有益である。オルガノイドの大量バッチ生産により、科学者や製造業者はハイスループットなアッセイで大規模な実験を行うことができる。
規模を拡大することで、オルガノイドは業界標準や規制慣行に適合するようになり、創薬や幹細胞治療、個別化医療への応用がより容易になる。
ビクトリアは、大規模なオルガノイドのバッチは、バッチ間のばらつきを緩和することができると付け加えた: 「特に、オルガノイド生産に使用される動物由来の試薬は、多くの場合、様々な供給源から入手されます。特に、オルガノイド作製に使用される動物由来の試薬は、多くの場合、様々な供給元から入手されます。これらの培養試薬は、特に小規模の実験用に開発されたものです。つまり、オルガノイドを培養しようとするたびに、異なる試薬を使用することになり、これはオルガノイドの標準化が進んでいないことを意味します」。
最後に、互換性のあるバイオリアクターを導入することで、研究者はシアストレスなどの環境条件をより簡単にモニターすることができ、最終的に一貫性と再現性を向上させることができる。
オルガノイド: 3Dの予測力
オルガノイド研究が重視されるようになった主な理由は、オルガノイドによって組織構造やセル間相互作用に関する深い洞察が得られ、創薬プロセスにおける予測力が高まるからである。例えば、「ミニ内蔵」は、特異性嚢胞性線維症の患者に最も効果的な薬剤を特定するために使用されてきた(1)。同様のモデルは、消化器癌患者から作製され、同様に患者自身における治療法の影響を予測できることが証明された(2)。さらに最近では、様々な組織におけるSARS-CoV-2感染の影響をモデル化し、様々な治療法を同定するために、膨大な種類のオルガノイドが使われた(3)。
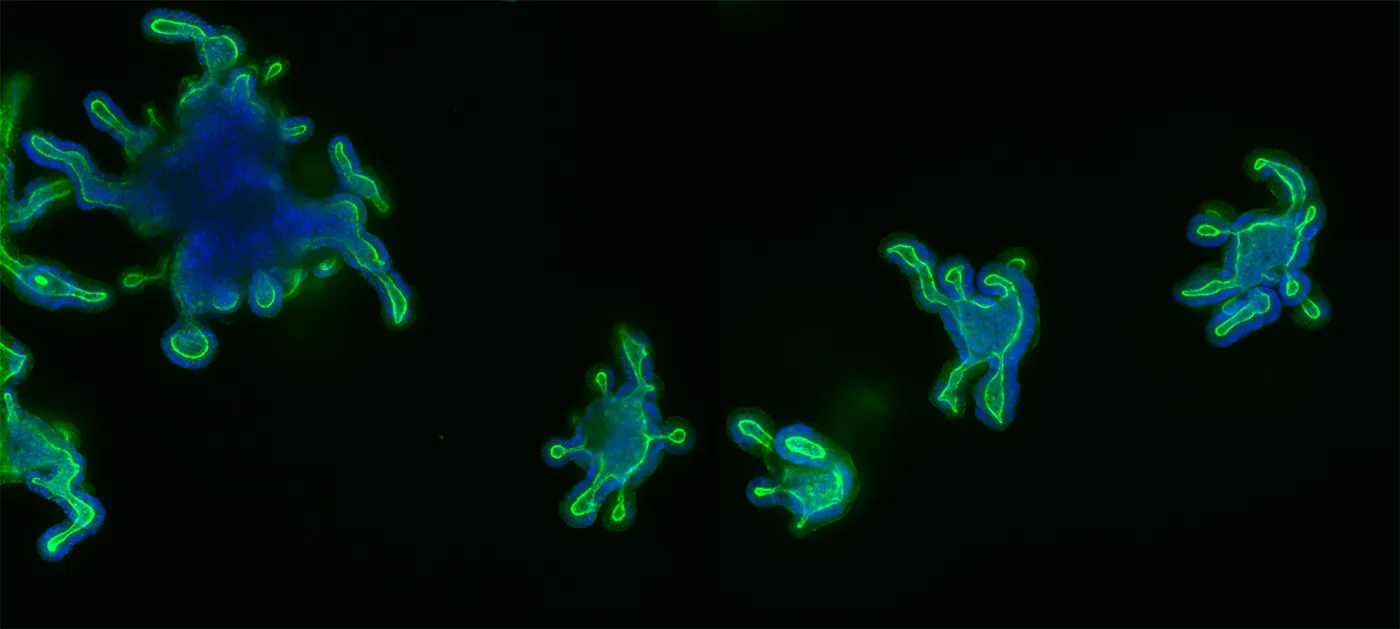
腸オルガノイドは、腸管内腔および腸管上皮周囲の構造を再現した3Dマイクロ組織モデルである。栄養吸収や粘液分泌など、腸の重要な機能をシミュレートすることができる。
この予測性の向上は、オルガノイドが創薬パイプラインのより早い段階で薬剤候補の失敗を特定し、偽陽性(前臨床研究で有望であったにもかかわらず臨床で失敗した候補)をより早い段階で排除できることを意味する。
オルガノイドは個別化医療においても有望である。患者特異性の幹細胞は、患者の遺伝的体質や生理的特徴と一致したオルガノイドを生み出す。従って、希少な遺伝性疾患や治療抵抗性のがん患者を対象としたオーダーメイドの治療法を開発する際、オルガノイドは非常に貴重な存在となるだろう。
オルガノイドの利用が広がれば、動物モデルの使用量を減らすこともできる。二次元細胞モデルと同様、動物モデルもまた患者の反応を予測するには不十分である。さらに、創薬における動物使用に関する倫理的懸念という重圧もある。FDA近代化法の制定により、研究者たちは動物モデルに代わる戦略を模索し始めた。
医薬品開発や疾病メカニズムの研究のためのin vitroプラットフォームとしてオルガノイドを使用することは、法律の改正と相まって、研究に使用される動物の数を減らすことを可能にするだろう。科学者たちがオルガノイドの価値を認識し、研究室でオルガノイドを使用するための必然的なスキルと経験を得るにつれて、オルガノイドの採用は牽引力を増していくだろう。オルガノイド株へのアクセスと、この複雑でヒト中心のin vitroモデルをフルに活用するためのアッセイの開発は、オルガノイド分野を大きく広げ、ライフサイエンス研究の新時代へと我々を導いてくれるだろう。
- Saini, Angela. "Cystic fibrosis patients benefit from mini guts." Cell Stem Cell 19.4 (2016): 425-427.
- Vlachogiannis, Georgios, et al. "Patient-derived organoids model treatment response of metastatic gastrointestinal cancers." Science 359.6378 (2018): 920-926.
- Han, Yuling, et al. "Human organoid models to study SARS-CoV-2 infection." Nature Methods 19.4 (2022): 418-428.