2021/6/9
生細胞イメージング実験を成功させるためのヒント
過去10年間に、顕微鏡やカメラ技術の著しい進歩があり、興味ある分子を標識する技術の進歩もあった。これらの進歩により、基礎研究から神経生物学、発生生物学、癌研究、医薬品開発などの先端研究まで、様々な分野で生細胞イメージングが普及するようになった。これらの分野において、生細胞イメージングは、生物全体レベルから分子レベルに至るまで、一定期間にわたって起こる細胞プロセスを研究するために使用することができる。
生細胞イメージングには多くの用途があり、使用できる顕微鏡法も多種多様であるが、共通の課題は、十分な解像度の画像を取得しながら、実験中にサンプルの完全性を維持することである。この2つの要素は、生細胞イメージング実験から適切で再現性のあるデータを得るために非常に重要です。
適切で再現性のあるデータを得るための実施基準
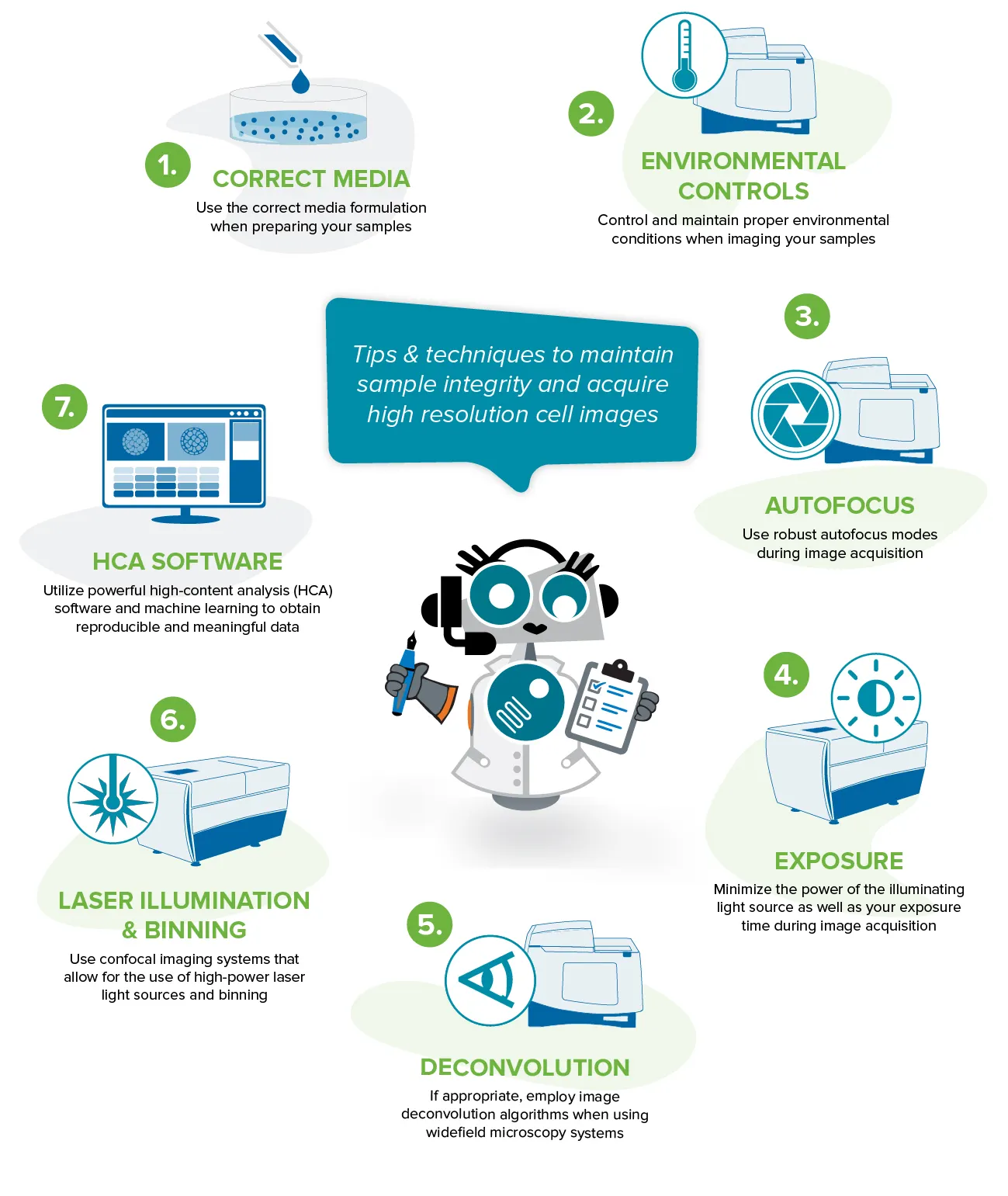
サンプルの健康状態を維持し、生細胞イメージング実験を成功させるためのヒントとテクニックをご紹介します。
1. サンプル調製時に正しい培地処方を使用する。
生細胞イメージング実験を成功させるためには、培地処方に細胞の増殖と発育に必要な適切な栄養素が含まれていることを確認することに加え、pH、緩衝能、浸透圧などの因子を考慮することが重要です。培地のpHと浸透圧(すなわち、培地溶液内の溶質量)の変化は、細胞の発現や表現型に影響を与え、最終的には細胞の外観や挙動に影響を与える可能性がある。最適な環境条件を調整・維持することは、培地に対する 望ましくない、あるいは有害な変化を防ぐのに役立つ。
さらに、培地内には、自家蛍光や高いバックグラウン ドシグナルの原因となる多くの因子が存在します。血清濃度を下げるだけでなく、フェノールレッドを含まない培地を使用することを検討する。これにより、バックグラウン ドシグナルが大幅に減少します。
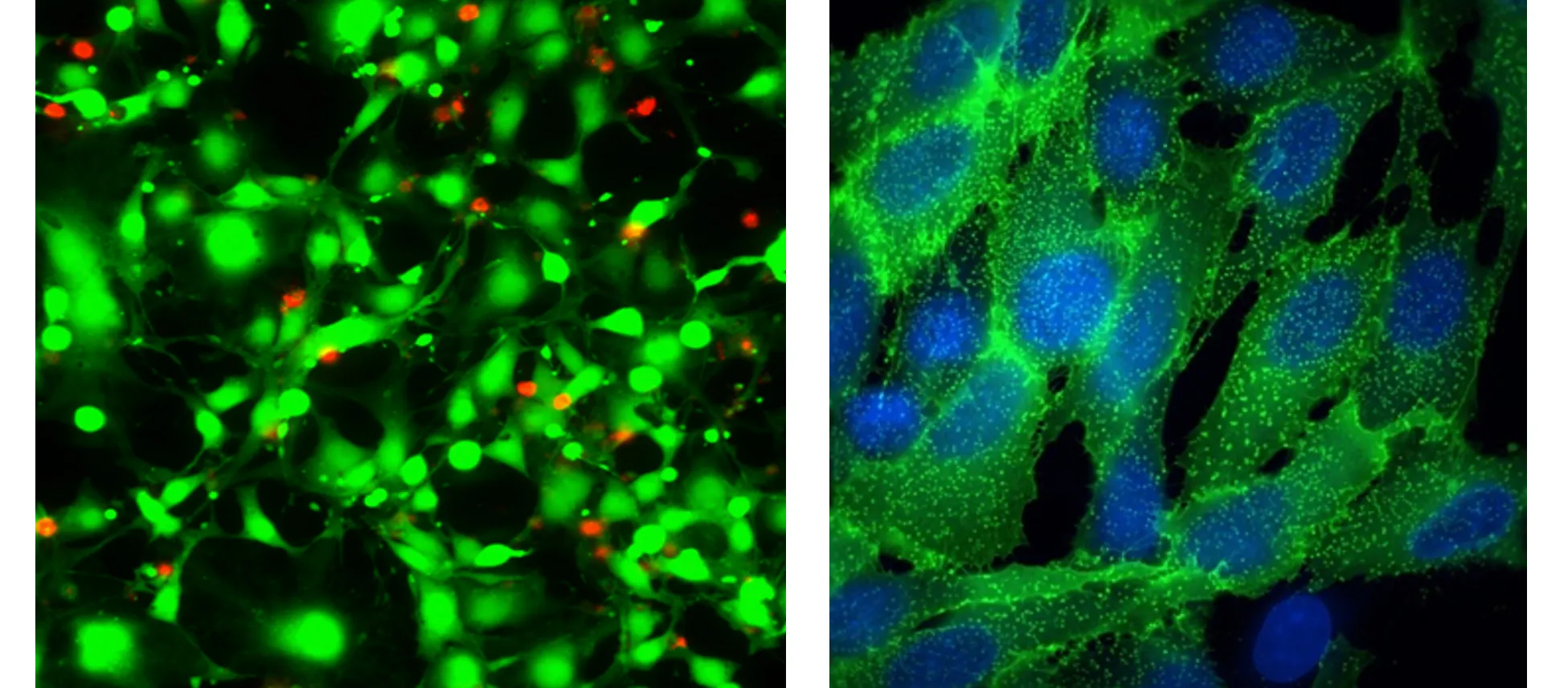
左:ストラウロスポリンで18時間処理したHeLa細胞をEarlyTox™ Live Dead Assay(カルセインAM(緑)とエチジウムホモダイマーIII(赤)で染色した40X Plan Apoイメージング
右:イソプロテレノールで処理したTransfluor U2OSの100X Plan Apo(air)像。受容体の内在化を刺激し、GFPタグ付きß-アレスチン(緑)で可視化した。セルはHoechst 33342核染色で対比染色した。
2. サンプルのイメージング時の適切な環境条件の管理と維持
生細胞イメージング実験の全期間を通して、サンプルの環境条件を適切に維持することが重要です。環境制御には、温度、湿度、ガス(酸素や二酸化炭素など)が含まれます。
安定した温度を調節・維持する能力は、細胞の健全性を維持するだけでなく、フォーカスドリフトのリスクも低減します。焦点ドリフトとは、時間の経過とともに焦点を維持できなくなることである。これは一般的に温度変化によるもので、マイクロプレートやその他の培養容器に使用されている材料の膨張や収縮を引き起こす。温度変動によるフォーカスドリフトのリスクをさらに減らすには、マイクロプレートが装置のステージまたは環境制御チャンバーに設置されていることを確認し、取り込み設定を構成する前に熱平衡をとるようにしてください。また、タイムラプス実験中にウェ ルに培地を加える必要がある場合は、イメージング容器内の培地と同じ温度であることを確認する。オンボードフルイディクスコントロールオプション、または培地や試薬添加のためのリキッドハンドラーとの自動化統合により、スループットが向上し、手動での作業による細胞混入や妨害のリスクを最小限に抑えることができます。

適切な湿度を保つことは、特に長期の生細胞実験において、培地の蒸発を防ぐのに役立ちます。蒸発は浸透圧の変化を引き起こし、セル の挙動に悪影響を及ぼし、アッセイに影響を与えま す。湿度管理が不可能な場合は、低張液(低 溶質)を使用することができます。
炭酸ガスレベルのコントロールも、サンプル内の pH調整に役立つので重要です。炭酸ガス濃度を制御できない場合は、pHを維持するために使用できるHEPESのような様々な合成緩衝液があります。しかし、合成緩衝液は多くの細胞種に有害である可能性があるため、使用前に目的のセルと合成緩衝液の適合性を確認する必要があります。HEPES緩衝培地での長時間の 維持は細胞に有害である可能性があるからである。
適切な酸素レベルを維持することも重要である。酸素の必要量は、細胞の種類や特定のライブセル実験の要件によって大きく異なることがあるからである。
ImageXpress® Pico自動細胞イメージングシステムやImageXpress® Confocal HT.aiハイコンテントイメージングシステムのようなイメージャーには、温度、湿度、酸素、二酸化炭素のためのさまざまな環境制御オプションがあります。これらのイメージャは、閉鎖環境制御システムと完全統合型であるため、プレーティングプレートは、サンプルの完全性を損なう可能性のある外光やその他の外部ラボ条件にさらされることはありません。さらに、ImageXpressシステムのソフトウェアにより、環境制御センサーの読み取り値を通じて、実験中の細胞環境を正確にモニターすることができます。
3. 画像取得時のロバスト性オートフォーカスモードの使用
ImageXpressシステムは、さまざまなハードウェア(レーザーおよびLED)およびソフトウェア(画像ベース)のオートフォーカスモードを搭載しており、実験間で焦点の合った画像を見つけ、保存し、焦点ドリフトを最小限に抑えることができます。オートフォーカスモードは、さまざまなサンプル、培養容器の厚さ、対物レンズ、イメージングパラメータに対応します。
ハードウェアオートフォーカス方式は、ほとんどのサンプルに対応し、サンプルの質や明るさに依存しません。ハードウェアオートフォーカスにより、撮影速度が速くなり、サンプルの光退色を最小限に抑えることができます。試料のZ位置が時間経過やプレート間で変化する場合、ソフトウェアオートフォーカスメソッドを追加することで、試料や実験器具全体にわたって信頼性の高いフォーカスを提供することができます。ソフトウェアベースのフォーカスが必要なほとんどの場合、ハードウェアとソフトウェアの両方のオートフォーカスを有効にする必要があります。ハードウェアオートフォーカスは、プレート底面、ウェル底面、またはその両方を検出します。次にソフトウェアオートフォーカスがイメージコントラストを利用して理想的な焦点面を見つける。したがって、ソフトウェアオートフォーカスが最適に機能するためには、サンプルは明るく、ゴミがないことが望ましい。
ハードウェアオートフォーカスとは対照的に、ソフトウェアオートフォーカスは撮影速度を低下させ、サンプルを光退色させる危険性がある。これを軽減するために、ソフトウェアオートフォーカスは最初に取得するチャンネルに対して有効にし、蛍光チャンネルの代わりに透過光をこの最初のチャンネルとして利用することができます。さらに、露光時間を短縮し、より明るく安定した蛍光色素を使用する。ビニング(#6参照)などのツールも露光時間の短縮に役立つ。
ソフトウェアオートフォーカス法は、ハードウェアオートフォーカスがプレートに設定されていない場合、プレートの不完全性によりハードウェアオートフォーカスが失敗する場合、ウェル内の量が少なくハードウェアオートフォーカスの信頼性が低下する場合、または油浸対物レンズを使用する場合にのみ単独で使用してください。
MetaXpress®ハイコンテント画像取得・解析ソフトウェアでは、特定のアッセイのニーズに合わせてオートフォーカス設定を行うことができます。単一のウェルで高速カイネティックタイムラプス実験を行う場合、オートフォーカスを最初のタイムポイントのみに適用して、取得速度を上げることができます。長時間のタイムラプス実験や、イメージ ング速度が重要でない場合は、すべてのタイムポイントにオートフォーカ スを設定し、フォーカスのドリフトを抑えることができる。
CellReporterXpress® 画像取得および解析ソフトウェアでは、様々なハードウェアおよびソフトウェアオートフォーカスルーチンを有効にすることができる。それぞれ特異性のある使用例に合わせて設計されており、多様なサンプルに比類のないフォーカスオプションを提供します。例えば、Well Insertハードウェアオートフォーカスルーチンは、3つのピーク(プレーティングボトム、ウェルボトム、ウェルインサート)を検出し、3つの異なる表面を封じ込めた実験器具を迅速に検出し、最適なフォーカシングを行います。低倍率でのスピードアップが必要な画像取得の場合、Anchor Focus Position ルーチンは、選択されたインフォーカス Z 位置を保持し、イメージオートフォーカスを無効にし、この保存されたフォーカス位置で画像を取得します。これは、生物全体や組織のような巨視的なサンプルを扱う場合に特に便利です。
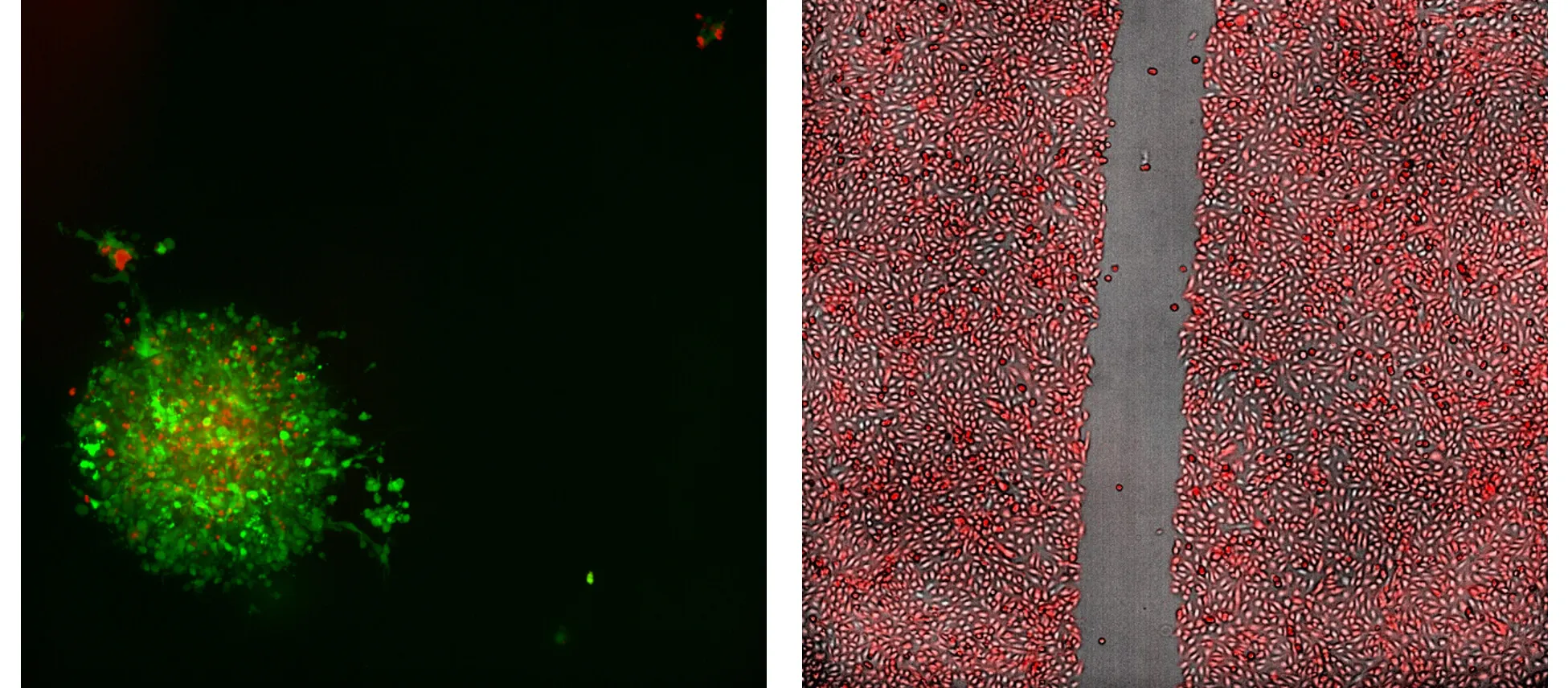
左:GFPを発現するMC38細胞をRFPを発現するT細胞で処理したマウス結腸癌スフェロイドを示す、免疫腫瘍学アッセイの代表的な20X共焦点、2Dプロジェクション画像。
右:RFPを安定的にトランスフェクトしたシグマU2OS細胞の4X創傷治癒アッセイ画像。
4. 画像取得時の露光時間および光源のパワーを最小にする。
照明光源のパワーと露光時間は、細胞の光毒性を引き起こす可能性があります。セルへのわずかな変化でさえ、その挙動や遺伝子発現に影響を与える可能性があります。したがって、サンプルを過剰に光に曝すことなく、質の高い画像を取得できる適切なバランスを見つける必要があります。
照明に関しては、蛍光体や蛍光分子が励起状態になると、DNA損傷やセルへのストレスの原因となるフリーラジカルが発生する。光の高輝度が高いほど、励起状態も高くなり、光毒性や細胞へのダメージが生じます。紫外線(UV)光は光毒性が高いことが知られているため、DAPIのような励起性の蛍光色素を使用すると、緑色や赤色の蛍光色素を使用した場合と比較して、光毒性が高くなる可能性がある。
蛍光イメージングやマルチカラーイメージングに関しては、光安定性が高く、発光ピークが明瞭で非常に明るくSN比の高い蛍光色素を使用するのが最善です。これにより、露光時間を短縮することができます。ImageXpressシステムには、クロストークを除去するためのナローバンドパスフィルターキューブが含まれています。また、減衰や制御が可能なハイパワー光源も搭載しています。例えば、ImageXpress® Confocal HT.aiシステムには、8つのイメージングチャンネルを持つ7チャンネルのレーザー光源が搭載されており、セルペインティングアプリケーションのようなマルチカラーラベリング実験に対応します。
水浸対物レンズのような高開口数(NA)対物レンズは、より少ない露光時間でより明るく高解像度の画像を生成することを可能にします。高NA対物レンズを使用する場合は、薄いプラスチック製マイクロプレートや培養皿(カバースリップの厚さのもの)を使用するのが望ましい。また、黒壁で底が透明なマイクロプレートを使用するのも、自家蛍光の発生が少ないので好ましい。
5. ワイドフィールド顕微鏡システムを使用する場合は、必要に応じて画像デコンボリューションアルゴリズムを採用する。
ImageXpress PicoシステムやImageXpress® Microハイコンテントイメージングシステムなどのワイドフィールド顕微鏡システムは、生細胞イメージング実験に最適です。これらのイメージングシステムで解像度や感度を向上させるために、画像のデコンボリューションアルゴリズムを使用することができます。画像デコンボリューションソフトウェアを実行することにより、画像取得中のピンぼけ光を減少させ、露光時間を短縮し、アッセイの質を維持することができます。ただし、アーチファクトを発生させないよう、デコンボリューションは正確かつ注意深く適用する必要があります。
6. 高輝度レーザー光源とビニングが可能な共焦点イメージングシステムを使用する。
ImageXpress® Confocal HT.aiシステムのような共焦点顕微鏡システムには、3Dサンプル、厚いサンプル、または薄暗い蛍光色素(蛍光タグ付きタンパク質など)のイメージングに最適なレーザー光源が搭載されています。コンフォーカル装置では、レーザーやLEDの光強度を調整・制御することができます。
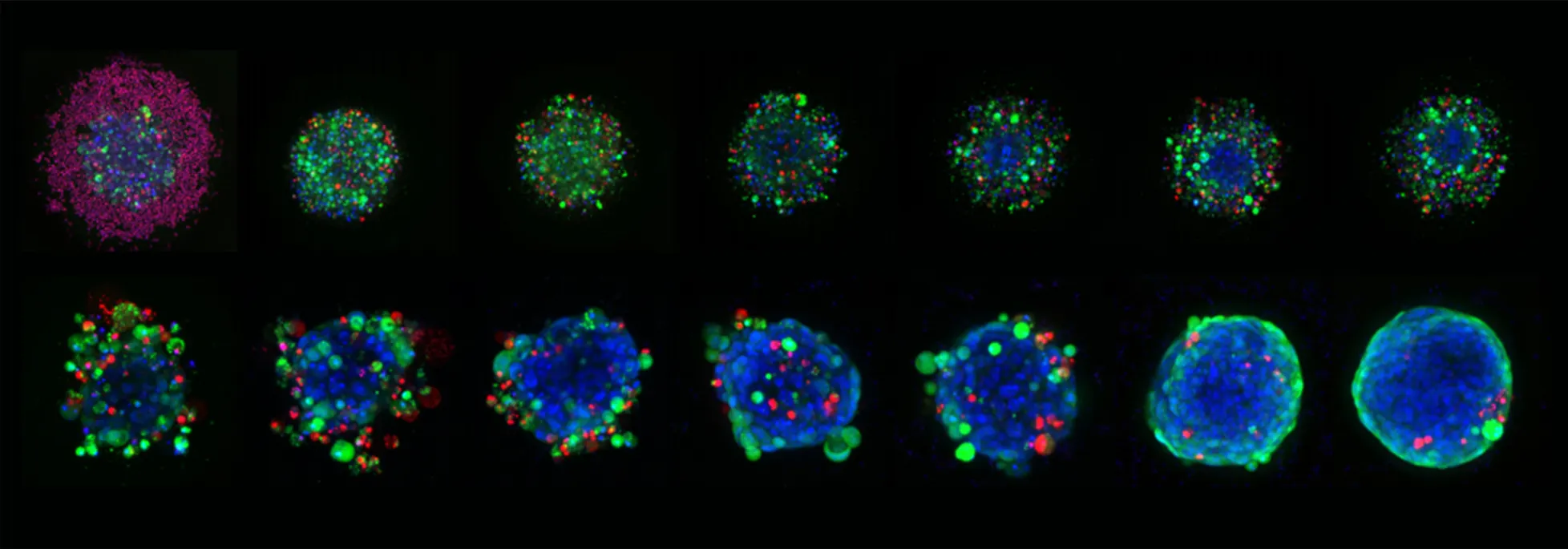
Corning Elplasiaマイクロキャビティプレートで増殖させ、様々な濃度のスタウロスポリンで合計6日間処理したHCT116スフェロイドの代表的な10X Plan Apo像。スフェロイドはHoechst 33342(青、核)、カルセインAM(緑、生細胞)、およびethidium homodimer-III(赤、死細胞)で染色した。
ビニングは、ワイドフィールドやコンフォーカルで撮像する際に使用できるもう一つのツールであるが、ビニングの効果は、コンフォーカル装置で撮像する際に、より顕著に現れる。コンフォーカル装置のスピニングディスク構成により、サンプルに当たる光量が制限され、焦点外光が遮断されるため、通常、露光時間を長くするか、高輝度光を使用する必要がある。ビニングは、隣接するピクセルからの電荷または強度信号を結合し、特定の領域のピクセル強度の合計を生成することにより、この必要性を軽減する。この合計により高輝度が得られる。基本的に、ビニングは画像のノイズに対するシグナルを増加させるので、露光時間を短くし、光強度を低くすることができる。ただし、空間分解能は低下する。繰り返しますが、質の高い画像を取得することと、サンプルの健全性を維持することのバランスを見つけることが重要です。
7. 再現性のある有意義なデータを得るための強力な解析ソフトウェアの活用
生細胞イメージングアプリケーションでは、大規模で複雑な画像やデータセットから、関連性のある膨大な量の定量データを抽出する能力が求められます。
当社のMetaXpressやCellReporterXpress® ソフトウェアのようなハイコンテント解析(HCA)ソリューションには、画像を正確にセグメンテーションし、再現性のあるデータを生成するためのロバスト性解析アルゴリズムが含まれています。MetaXpressやCellReporterXpress®には、様々な生細胞イメージングアプリケーション用にあらかじめ設定された解析モジュールが含まれています。よりカスタマイズされた解析は、MetaXpress ソフトウェア内のカスタムモジュールエディターを使用して実行できます。
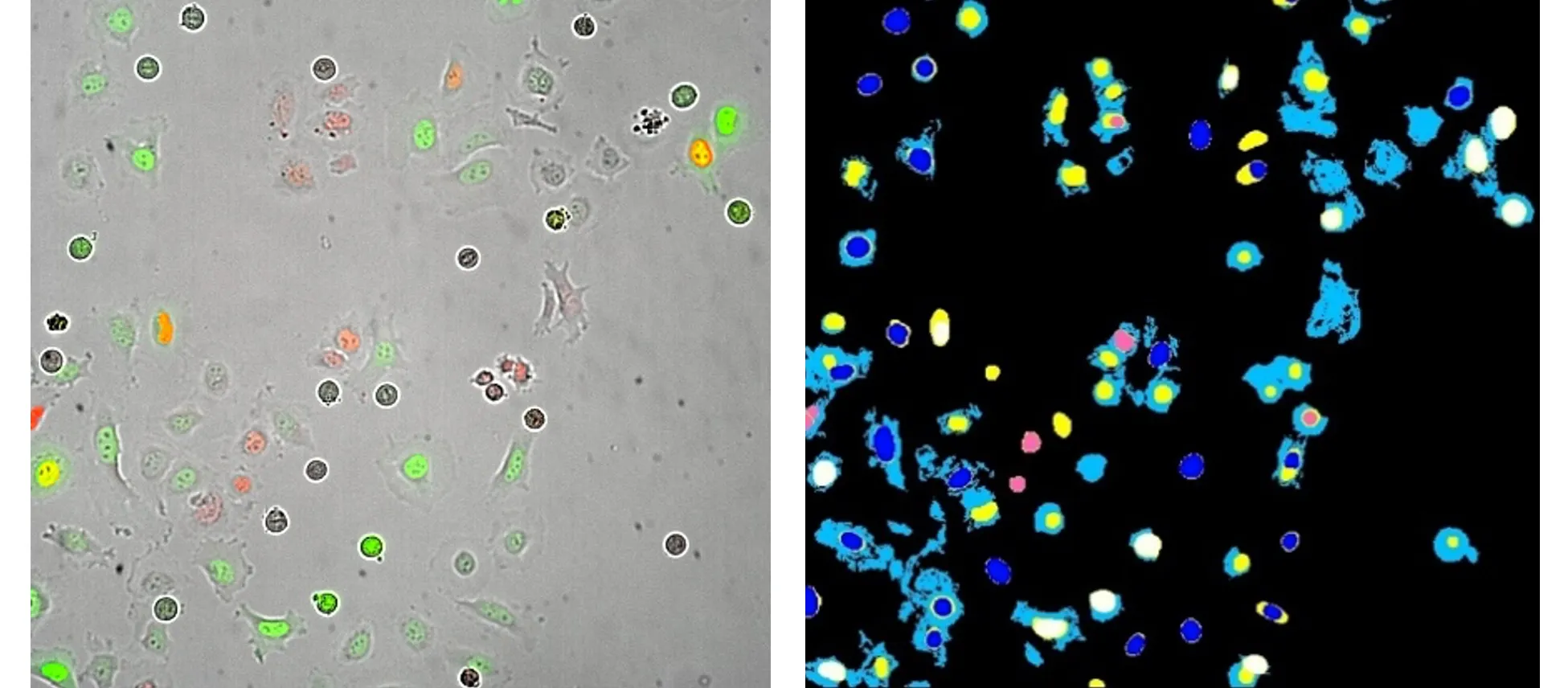
左:Fucci細胞周期センサー(GFP-ジェミニンとRFP-Cdt-1)をトランスフェクトしたHeLa細胞の20X Plan Apo像。この画像は、細胞周期阻害剤noccodazoleで処理した13時間後に撮影された。
右: MetaXpress Custom Module解析から生成された解析セグメンテーションマスク。
研究対象のセルについてより詳細な情報を得たい場合は、高度なデータ分析機能を備えた機械学習アルゴリズムを使用することができます。当社のIN Carta™画像解析ソフトウェアパッケージには、解析精度を向上させ、膨大な量の不均一性画像データを分類・比較するためのガイド付き機械学習ワークフローが含まれています。
生細胞イメージング実験では大量のデータが生成されるため、データ解析のための処理能力だけでなく、十分なストレージ容量を確保することが重要です。前述したように、ビニングは画像データサイズを縮小し、データ転送速度を速めることができるため、画像をより迅速に解析することができる。ImageXpressシステムにはMetaXpress® PowerCore™ハイコンテント分散画像解析ソフトウェアも含まれており、並列処理を利用することで解析速度を飛躍的に向上させることができます。
生細胞イメージングに使用される様々なアプリケーションや技術について詳しくは、生細胞イメージングページをご覧ください。