2022/9/27
【ポッドキャスト】従来の細胞株開発の課題と、
モノクローナリティを制御するための新たな技術
遺伝子エンジニアリングと合成生物学の進歩により、ここ数十年で数多くの飛躍的進歩がもたらされた。細胞株開発の重要性は、特筆に値する。この開発なくして、感染症に対する多くの救命ワクチン、抗体医薬、そしてインスリンを含む組換えタンパク質製品は、広く利用されることはなかったであろう コンプライアントの細胞株開発で最も困難なステップは、主に手作業で行われる単クローン性の保証である。治療用細胞株の単クローン性は、規制上の理由から達成され、文書化されなければならない。
ポッドキャスト「ICGEBのNatasa Skoko博士とMacroGenicsのHugh Graham博士による細胞株開発」では、細胞株開発の従来のワークフローと、モノクローナリティの検証に役立つ新しいテクノロジーについて議論しています。
ここでは、専門家による講演の要点をまとめた: 国際遺伝子工学・バイオテクノロジーセンター(ICGEB)のバイオテクノロジー開発ユニット・グループリーダーのナタサ・スココ博士と、マクロジェニックスの細胞培養科学ディレクターのヒュー・グラハム博士です。
安定したセルラインの意義
最も単純な形では、細胞株という用語は、一定期間培養を維持することができ、明確な表現型、機能、安定性を保持することができる細胞の集団を定義している。
Skoko博士は、安定した細胞株の歴史的意義を次のように要約している。「細胞株の使用は、科学的研究だけでなく、多くの基本的な生物学的プロセスの理解に革命をもたらしました」その応用範囲は、抗体や治療用タンパク質の生産から薬剤スクリーニングまで多岐にわたる。
細胞株開発には、ロバスト性があり、コスト効率が高く、培養が容易な哺乳類細胞のエンジニアリングが必要である。この条件をすべて満たす細胞株のひとつが、1987年に初めて開発されたチャイニーズハムスター卵巣(CHO)細胞である。今日、市販されているバイオ医薬品の70%はCHO細胞株から製造されている。CHO細胞株は、様々な増殖培地や増殖条件(懸濁、付着増殖、供給バッチ、灌流など)にアダプターとして適応し、ヒトタンパク質の翻訳後修飾を模倣するためにタンパク質を折り畳んだりグリコシル化したりする能力があるため、バイオ医薬品の大量生産において特に効率的である。
従来の細胞株開発ワークフローの課題
バイオ医薬品を大量に生産するためには、安定した細胞株の作製が不可欠である。
最初のステップは、目的の遺伝子を適切な宿主細胞株にトランスフェクションすることで、DNAの宿主ゲノム研究へのランダムな統合をもたらす。エンジニアリングされた細胞株が増殖し始めると、通常は選択圧のもとで、スクリーニング用のクローンを作製するためにシングルセル細胞株を分離する必要がある。
従来のワークフローでは、限界希釈法を用いて96ウェルプレートにセルをプレーティングする。この方法では細胞懸濁液を希釈し、あるウェルに一定量をプレーティングすると、そのウェルには細胞が1つしかない可能性が非常に高くなるようにする。ウェルによっては空であること もあり、複数の細胞が入っていることもある。したがって、これらのウェルのどれからでも高い確率で、シングル細胞から細胞株が開発されることになります。
これは素晴らしいことですが、どのくらいの時間がかかるのでしょう?セルが24時間ごとに倍増すると仮定すると、1000個のセ ルに達するには10回倍増する必要があり、10日かかる。十分な数の細胞を得るには2~3週間かかる。さらに、単クローン性の規制により、細胞株のクローン性をさらに保証するために限界希釈法を繰り返す必要があります。つまり、この低スループット法で結果を得るには、数ヶ月を費やす必要があるのだ。グラハム博士はこう付け加える: 「細胞株の安定性が問題になります。望ましい数に達し、単クローン性の高い保証が得られるまでに、細胞株の性質が流れたり、目的の遺伝子のコピーが失われたり、予想外の方法でアダプター化したりする可能性があります」。
自動化は、ハイスループットなモノクローナル細胞株増殖とその文書化を促進する方法である。
結論として、限界希釈法は、単クローン性を文書化し、細胞の質を保持するのが難しいので、スピード、コンプライアンス、細胞株の質を達成するのに失敗する可能性がある。Skoko博士もGraham博士も、ハイスループットなモノクローナル細胞株増殖とその文書化を促進する方法は自動化であることに同意している。
モノクローナル細胞株の要点
ここで一歩下がって、モノクローナル性を定義してみよう。モノクローナル細胞株は、単一の細胞、あるいは単一の前駆細胞に由来する。
なぜそれがそんなに重要なのか?セルが増殖し、倍加し始めると、遺伝子のドリフトや突然変異、プラスミドの消失が起こる。そのため、その細胞が発現する治療用タンパク質の品質が均一であることを、直近の表現型を調べるだけで保証することは不可能に近い。
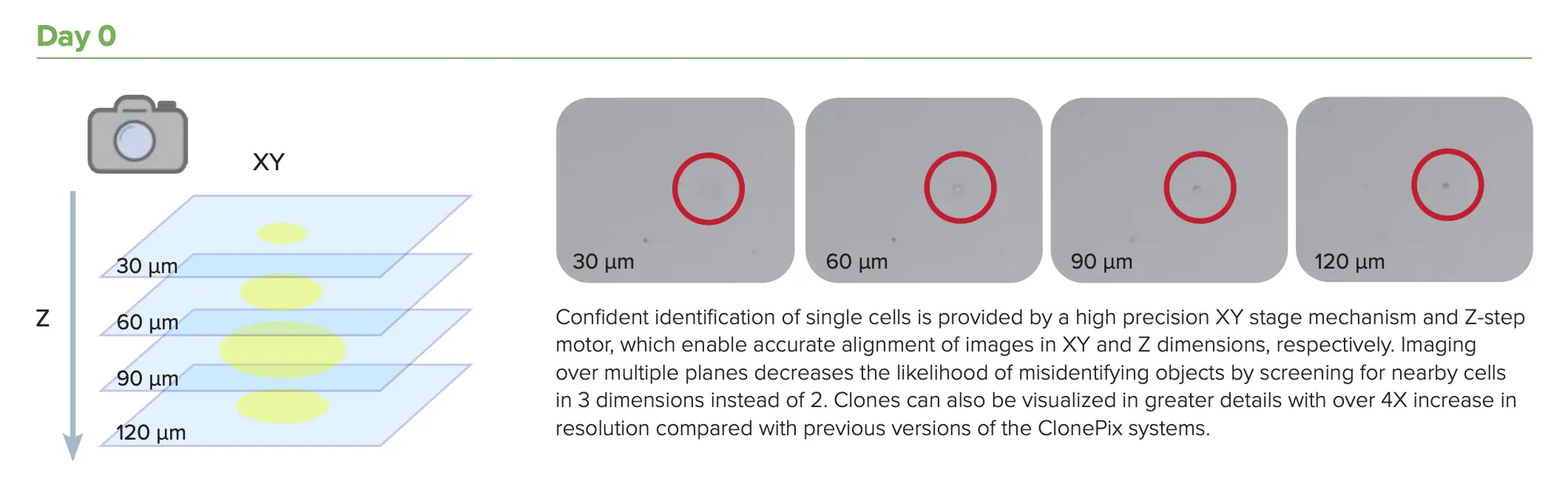
それを補うためには、ゼロ日目からセルを文書化し、そのセ ルが本当に一つの細胞から生まれたものであることを証明す る必要がある。
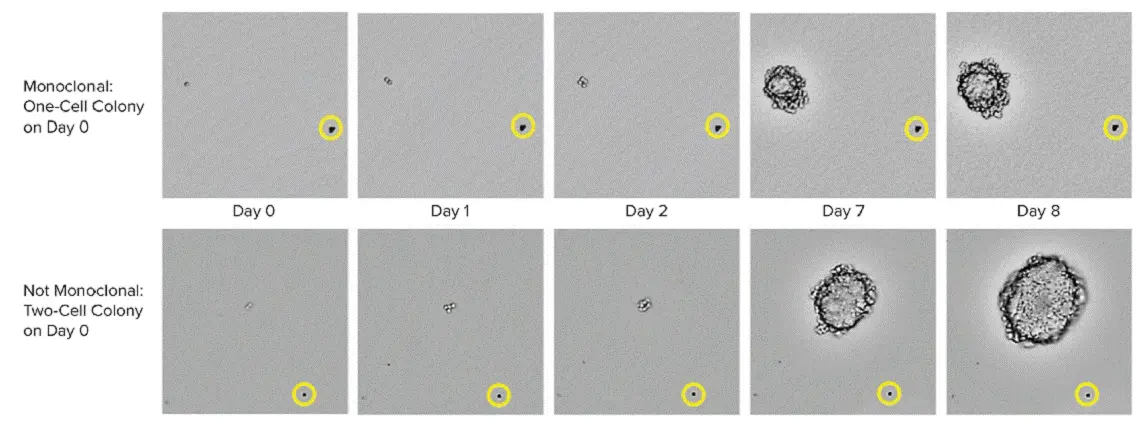
CHO-s細胞の増殖は、6ウェルプレートから複数の時点の画像をキャプチャーするために用いられた。0日目には、上段に1個のセルが存在し、下段には2個のセルが観察されることが明瞭に観察される。黄色の円は、同じコロニーが経時的に撮像されていることを確認するための位置基準となるビーズの位置を示す。
規制当局が求める典型的な単クローン性の証拠は、画像ベース、すなわち、単一細胞の画像を記録しなければならない。
最も効果的なモノクローナル細胞株開発装置は、シングルセル・プリンターで、シングルセルの成膜を行う。その他の方法としては、蛍光活性化セルソーティング(FACS)や、インキュベーションからピペッティングまで全てのステップを自動化するワークフローがある。
早期のモノクローナリティ検証の重要性
早期の段階でモノクローナリティを保証することは、ライフサイエンスへの応用においていくつかの意味を持つ。グラハム博士は、医薬品開発サイクルにおけるモノクローナリティの重要性を強調しています: 「10年以上前に開発された細胞株や分子が商品化されようとしています。10年以上前に開発された細胞株や分子が商品化されようとしています。10年前のクローニング・プロセスには、クローン性起源を保証するために必要な文書がないかもしれません。そのような細胞株を規制当局に提出する際、その細胞株が元々クローン性の細胞株に由来するものであることを示すよう求められるかもしれません。その証明がない場合、プロジェクトの後半で証明するのは大変な作業になります」。
"リスクを最小限に抑え、一貫した生産工程と製品品質を確保することです。だからこそ、早い段階でモノクローナリティを保証することが不可欠なのです"
スココ博士はこう付け加える: 「リスクを最小限に抑え、一貫した生産工程と製品品質を確保することです。だからこそ、早い段階で単クローン性を保証することが不可欠なのです。単クローン性の保証が高いセルバンクから始めることで、後の作業が少なくなります。さらに、製造における深刻な混乱を避け、製造工程を変更する際の不確実性を減らすことができます。"
シングルセル細胞株を検証する新しいモノクローナル技術
モノクローナル細胞株のイメージングと培養のための新たな技術が増えつつある。いくつか例を挙げよう:
- 半固体細胞懸濁液:単一細胞を半固体懸濁液中で成長させ、その成長過程をイメージングすることができる。
- 単一細胞を隔離し、細胞混入から保護するためのクローニングリング。
- FACS: 蛍光特性に基づいて細胞を選別すること。
- 単一細胞を含む新しくプレーティングされたウェルを画像化できる、マイクロ流体滴下ベースの単一細胞プリンター。
これらの方法を組み合わせることで、単クローン性証拠の信頼性が向上する。
もちろん、現在の技術を改善し、より優れた技術を発明する可能性は大いにある。何よりもまず、限界希釈法やフローサイトメトリーによるソーティングのコストと時間に関する課題を克服するため、視覚的証拠、すなわち単一細胞イメージングをもっと頻繁に使用しなければならない。
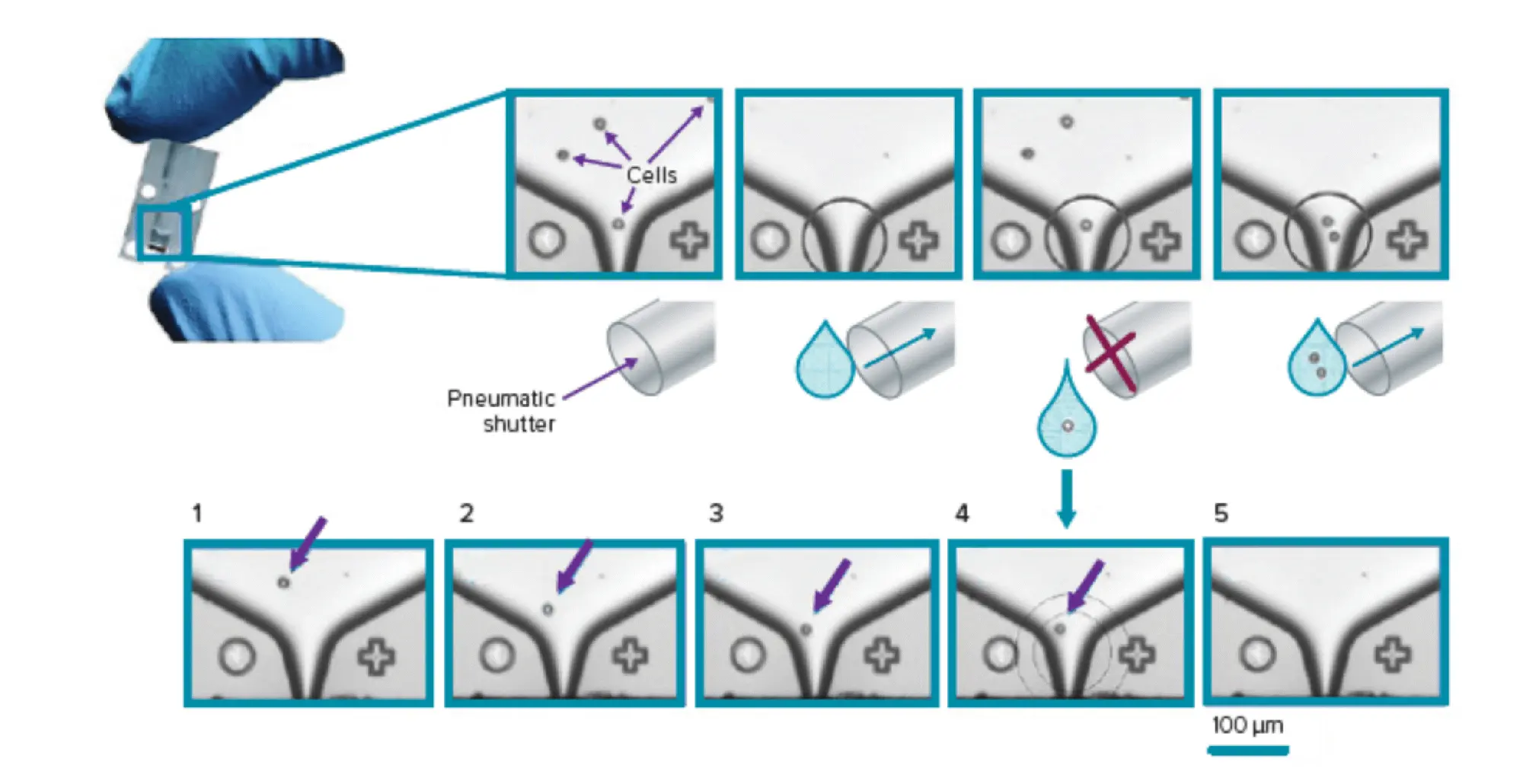
CloneSelect Single-Cell Printer シリーズは、特許取得済みマイクロ流体ベース技術とリアルタイム画像解析を利用した完全自動化システムで、単一細胞を選別して標準マイクロプレートに注入すると同時に、画像記録により単細胞性を保証します。
生産ラインの下流では、さらなる改善が可能である。例えば、治療用タンパク質の製造における分析物を改善すれば、製造工程全体をモニターすることができる。これによって遺伝的多様性がコントロール下に置かれ、製造されたタンパク質の均一性が保証される。
モノクローナル細胞株開発におけるもう一つの懸念はスピードである。グラハム博士が指摘するように、「クリニックで使用するタンパク質を作るクローン細胞株を待つことは、時間的な障壁となります。今日、人々は初期のクローンのプールから最初のタンパク質のバッチを作り、最初の医薬品の製造管理及び品質管理の基準(GMP)の臨床材料とする方向に向かっています。その後、後期臨床試験やGMP製造のためのクローン細胞株を作製する。初期の臨床試験でクローン由来の証明の必要性をなくすことは、バイオ医薬品開発を加速する興味深いアプローチである。しかし、このアプローチは、規制当局の承認を得るためにさらなる作業が必要かもしれない。
細胞株開発プロセスにおける規制の役割とその影響
お分かりのように、規制がモノクローナル細胞株開発に影響を与えることは否定できない。厳しい規制が意味することのひとつに、製造者は承認を申請する前に、モノクローナル細胞株に関する包括的な報告書を提出しなければならないということがある。不十分な証明や書類の欠落は、規制当局の遅延や承認後の追加的なコミットメントにつながる可能性がある。薬事承認には優れた科学的裏付けが必要であるため、特にクローン由来については、できるだけ早い段階から多くの証拠を提供することが最善である。
モノクローナル細胞株ワークフローの将来は?
モノクローナル細胞株ワークフローには、金銭的な問題、ハイスループットの結果を得ること、モノクローナル由来であることの保証など、未解決の課題がある。
従来の方法と比べ、今日のモノクローナル細胞株開発者は、規制遵守と細胞株の品質を保証するためのはるかに優れたツールを有している。
細胞株開発研究から生成される膨大なデータセットを整理するために必要な、データ管理の改善もその1つである。データ管理と機械学習を組み合わせることで、クローン由来のみに基づきバイオ医薬品の品質を予測するプラットフォームを生み出すことができる。
自動化技術は、正確なクローン作製、従来の限界希釈法に伴うエラーの排除、異なる分泌体の不均一性を克服するのに役立つ。
自動化の役割もまた、スピードと一貫性において、より極めて重要になるだろう。より具体的には、自動化はクローン開発とクローンスクリーニングを加速することができる。Skoko博士は自動化の効果を明確にする: 「我々は、2、3週間で10,000クローンをスクリーニングすることについて話している。従来のワークフローでは、30週間から2年かかるでしょう。自動化技術は、正確なクローンを持ち、従来の限界希釈法に伴うエラーを排除し、異なる分泌体の不均一性を克服するのに役立ちます。クローンの安定性を最初から評価できます」。
単クローン性を保証する自動細胞株開発ワークフロー
自動化技術を統合することで、何十万ものクローンをスクリーニングし、目的のタンパク質について最も高い収量を生み出すことができるゴールデン・クローンを見つけることができます。さらに重要なことは、ゼロ日目から開発プロセスの全ステップを完全に文書化できることです。最終的には、単クローン性保証の欠如や一貫性のない製品品質に起因する将来の紛争を回避することで、コストと時間を節約することができます。
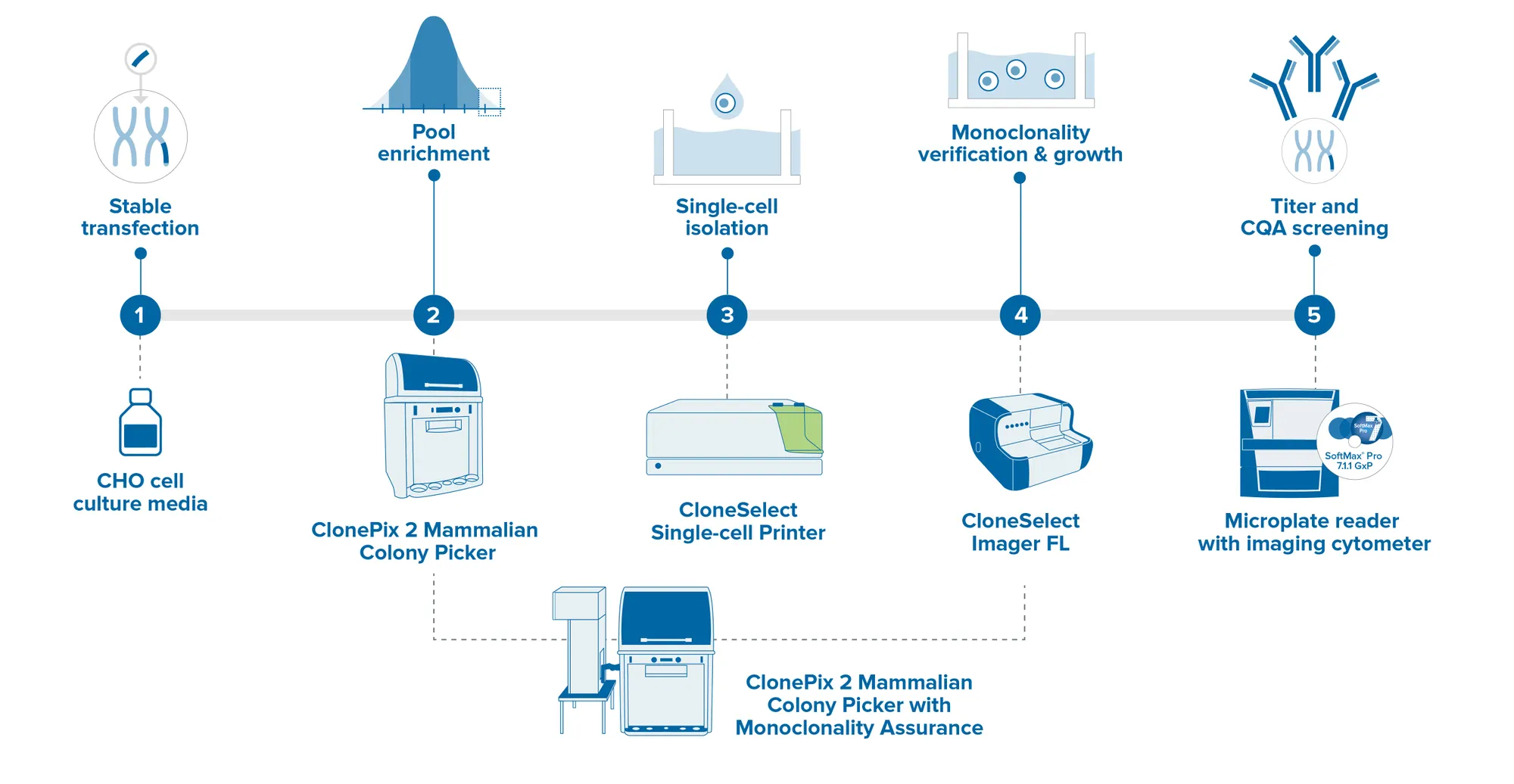
複数のステップをシングルステップに統合することで、細胞株開発のタイムラインを加速します。モノクローナル性保証機能が強化されたClonePix 2 哺乳類細胞コロニーピッカーは、高産生なクローンとモノクローナルなクローンをオール・イン・ワン・システムで自動的にスクリーニングおよびピッキングします。初日にモノクローナリティの検証を行うことで、より多くのクローンをより短時間でスクリーニングし、その後2週間以内に高生産クローンのスクリーニングとピッキングを行うことができます。迅速なZスタック画像取得機能により、単焦点面だけでなく、培地全体の単一細胞の検出が可能。
Molecular Devicesは、お客様の細胞株開発ワークフローを自動化するロバスト性技術と、クローンピッキング、シングルセル分離およびイメージング、マイクロプレートリーダーなどの分子クローニングを保証する技術を有しています。当社の実績あるGxPソリューションは、GLP/G準拠施設のデータインテグリティとコンプライアンスを保証します。
細胞株開発とモノクローナリティ・アプリケーションの詳細をご覧いただくか、オートメーション・ソリューションにご興味のある方は、オートメーション・スペシャリストにご相談ください。