2022/4/14
COVID-19に対するモノクローナル抗体の役割
SARS-CoV-2との闘いにおいてmAbsが鍵となる理由と、パンデミックが創薬と開発のパイプラインをどのように形成したかをご覧ください。
過去3年間で、COVID-19に対する治療法の開発は大きな勢いを得た。ワクチン接種が戦いの最前線にありました。mRNAを投与することで、ワクチンはあなたの細胞に無害なバージョンのスパイク・タンパク質を産生するよう促し、それによってあなたの免疫系を刺激して抗体を産生させ、潜在的な脅威を撃退する。問題は、すでにCOVID-19に感染している場合、あるいはワクチン接種後も入院のリスクが高いほど免疫系が低下している場合にどうするかである。そこで、モノクローナル抗体が、体内に侵入したウイルスを標的として中和するのである。
ポッドキャスト
Drug Target Reviewの最新ポッドキャスト(Episode 6 - mAbs and SARS-CoV-2 with Dr. Carter Mitchell & Dr. Sharath Madasu, Kemp Proteins)で、カーター・ミッチェル(最高科学責任者)とシャラス・マダス(Kemp Proteins Protein Characterizationマネージャー)は、COVID-19に対するモノクローナル抗体(mAbs)の役割と、パンデミックがその探索と開発をどのように形成したかについて議論しました。
Drug Target Review - エピソード6 - mAbsとSARS-CoV-2 ケンプ・プロテイン社 カーター・ミッチェル博士 & シャラス・マダス博士
なぜmAbsがSARS-CoV-2に有効なのか?
モノクローナル抗体(mAbs)はウイルスの中和を通してウイルスに作用する。ウイルスが宿主を認識する過程、あるいはウイルスが内在化する過程を阻害するためである。
モノクローナル抗体の作用機序
SARS-CoV-2では、スパイク蛋白とACE2レセプターの結合を阻害し、宿主細胞へのウイルスの侵入を阻止することが目的である。スパイクタンパク質はその認識結合ドメイン(RBD)を介して結合を仲介する。現在、中和モノクローナル抗体のほとんどはRBDに対して上昇している。
COVID-19変異体に対するモノクローナル抗体の有効性は?
有効性に関しては、変異体の数が増えているため、一概に答えることは困難です。有効性は変異体によって異なります。例えば、ほとんどの緊急使用許可抗体はアルファ型とデルタ型には効きますが、オミクロン型には効き目が弱くなります。
オミクロンの課題は、スパイクタンパク質に少なくとも36の変異があり、そのうちのいくつかはRBDに位置していることである。これらの変異はグリコシル化に差異をもたらし、ウイルスが以前に形成された免疫学的反応やモノクローナル抗体の中和を回避することを可能にする。
幸いなことに、ソトロビマブのような新しい抗体は、最近の変異型でも中和活性を維持している。とはいえ、その効果は千差万別である。α型やβ型には非常に有効でも、γ型やδ型には無効な抗体もある。対照的に、デルタやアルファに有効な抗体は、ベータ、ガンマ、オミクロンの変異体にはあまり効果がない。
特定の変異体の変異がEC50に与える影響は、変異が結合エピトープにあるかどうかに依存する。
他のCOVID-19治療に対するmAbの利点
必要投与量の確実性は、COVID-19治療におけるモノクローナル抗体の主な利点の一つである。
マダス博士によれば、回復期血漿療法の成功率はドナーに大きく依存する。マダス氏はさらにこう説明する: 「回復期血漿療法では、A)ドナーが中和抗体を産生し続けていること、B)ドナーが効果を発揮するのに十分な量を産生し続けていることが期待されます。モノクローナル抗体では、患者に投与する中和抗体の量を正確に知ることができます。
回復期血漿療法は、患者間の血漿不適合という大きなリスクももたらす。COVID-19の効果的な治療法としてモノクローナル抗体を用いれば、こうしたリスクは大幅に軽減される。
Mitchell博士は、mAb療法のもう一つの特筆すべき特徴である、将来出現するかもしれないあらゆる種類の変異体を中和できる擬似ポリクローナル混合物のサブセットを産生する能力を強調している。これらの抗体が将来の変異体に対しても有効であると、どうしてそんなに確信できるのだろうか?各サブセットは特異性結合エピトープを持っているので、突然変異は1つまたは複数のmAbサブセットの組み合わせによって速やかに認識される。
Mitchell博士は、ポリクローナル混合物の潜在的な利点について、もっともらしい例を挙げている。「今から5年後、新しいタイプの変異型が出てきた場合、野生型プラス2023年に出てきた変異型に対して育てたモノクローナル抗体を併用することで、その特定の変異型に対してより有効な治療ができるかもしれません」。
突然のパンデミックの影響
モノクローナル抗体の開発は紛れもなく前進している。しかし、COVID-19の大流行がなければ、モノクローナル抗体作製の進歩はまだ続いていたのだろうか?
モノクローナル抗体開発のプロセスはすでに確立されていたが、パンデミックによって危機感が生まれた。マダス博士はまた、ワクチンよりも抗体療法の方が人々の理解を得やすい/得やすいと考えている。パンデミックの初期には、ワクチンの有効性が明らかではなかったため、一部の人々はワクチンの摂取をためらったかもしれません。一方、抗体に対する人々の理解度は高かったため、抗体療法はより広く受け入れられた。
パンデミックは、既存の戦略の改良を加速させただけでなく、新しい技術の開発も促した。ハイスループット表面プラズモン共鳴法(SPR)、ハイスループット生物層干渉法(BLI)などの技術は、パンデミックの間に関心を集めた。さらに、ハイスループットの動的光散乱法(DLS)やFLDも大きく進歩した。新しい技術としては、人工知能に基づくDe Novoモノクローナル抗体設計があり、抗体探索プラットフォームのスピードと複雑性を向上させた。
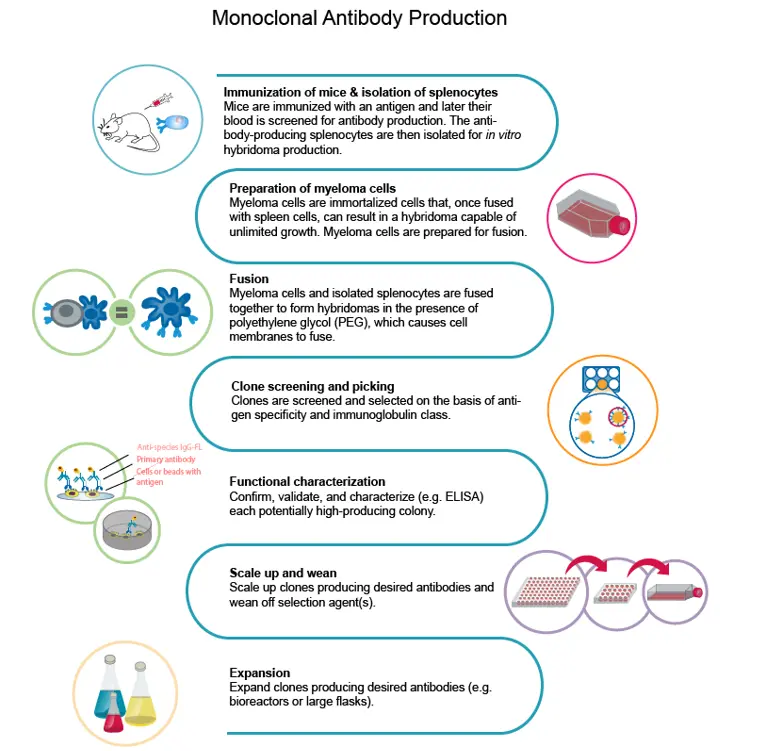
COVID-19 モノクローナル抗体ワークフロー
ワークフローを構築する最初のステップは、モノクローナル抗体の開発に使用する抗原を選択することである。最初の段階では、免疫反応を起こす動物に抗原を投与して免疫する。その後、動物の免疫反応で生じたβ細胞を分離し、骨髄腫細胞と融合させてハイブリドーマを作製する。
Mitchell博士によれば、初期段階の成功の鍵は抗原の最適化である。「COVID-19の場合、抗体は主に3量体であるスパイク蛋白質に対して上昇される。COVID-19の場合、抗体は主に3量体であるスパイク蛋白質に対して上昇する。スパイク蛋白質は高分子量の凝集体を形成する傾向があり、免疫化戦略には不向きかもしれない」
さらに付け加えると、スパイクタンパク質のグリコシル化パターンは、異なる生物種はおろか、細胞の種類によっても大きく異なる。
だから抗原の選択には細心の注意が必要なのだ。一つの抗原の糖鎖のわずかなずれ(例えば、異なる変異体において)でも、抗体の成功率に大きく影響する可能性がある。
課題とボトルネック
免疫
主な課題の一つは、ウイルスゲノムの理解である。研究チームは通常、抗原を合成・精製し、その発現を最適化しなければならなかった。しかし、発現と精製の成功を評価するためには、科学者たちの共同研究という性質に頼って、それぞれの研究室から情報を発表しなければならなかった。全体として、動物の免疫化とハイブリドーマの作製だけで、8週間かかることもあった。
単一細胞の分離
免疫戦略に最適な抗原を同定したら、次の課題はハイブリドーマの単細胞分離に十分な数のB細胞を得ることである。
これらのハイブリドーマを増殖させる伝統的な方法は、単細胞がコロニーを形成するようにする半固形培地である。これは以前は時間のかかるプロセスであったが、マイクロウェルプレートの各ウェルに単一細胞をプレーティングできるロボットインストゥルメンテーションにより、スループットと効率の両方が改善された。
先進的な単一細胞分離ツールは、クローンアウトグロースの効率も向上させ、コロニーが単一細胞から生成されたことをモノクローナリティの検証も可能にすることに注目することが重要である
大規模単クローン性
大規模な単クローン性を得るためには、単細胞分離ハイブリドーマの組換え型を作製する必要がある。臨床試験の承認には、mAbの組換え体作製と、適切な免疫学的反応を可能にするヒト抗体への製剤化が必要である。
十分な濃度のmAbを生成するために安定した細胞株を形成するには、遺伝子の配列を決定し、ヒト構築物に操作する必要がある。組み換え作製にはCHO細胞株が用いられ、8-20g/LのmAb産生を目標としている。
時間と経済的制約
時間とコストは、mAbワークフローにおいて考慮すべき重要な要素
安定したクローンの作製は、最初の供給から12日で達成できるが、完全なモノクローナルの保証には、従来のクローニング法では6ヶ月かかることもある。さらに重要なことは、完全に実現されたmAb構造を作製するにはコストがかかることである。解決策は、一本鎖可変フラグメント抗体またはVHHナノボディを形成することであろう。これは、抗原に対する特異的結合親和性を示す、可能な限り小さな抗体フラグメントである。ミッチェル博士は、このアプローチが非常に強力である理由を要約する:
「mAbをより小さなナノボディに変換することで、大腸菌でよりコスト効率の良い方法で生産することができます。それによってコストが下がり、先進国でしか利用できない治療法とは対照的に、広く適用できる治療法となるのです」。
マダス博士によれば、その安定した構造により、後発開発途上国への流通がより容易になるという。「保管施設を利用できない後発開発途上国のことも考える必要があります。これらのナノボディの中にはかなり安定したものもあり、それほど厳密でない条件下で保存することも可能です」。
抗体からナノボディへの変換は、mAbsをベースとした治療薬をより低コストで世界中に流通させるための重要なステップであることは明らかだ。特に、保管設備が不十分な発展途上国では、ナノボディは極端な温度下でも安定性を保つことができるだろう。
単クローン性の確保と自動化によるCOVID-19 mAb生産の迅速化
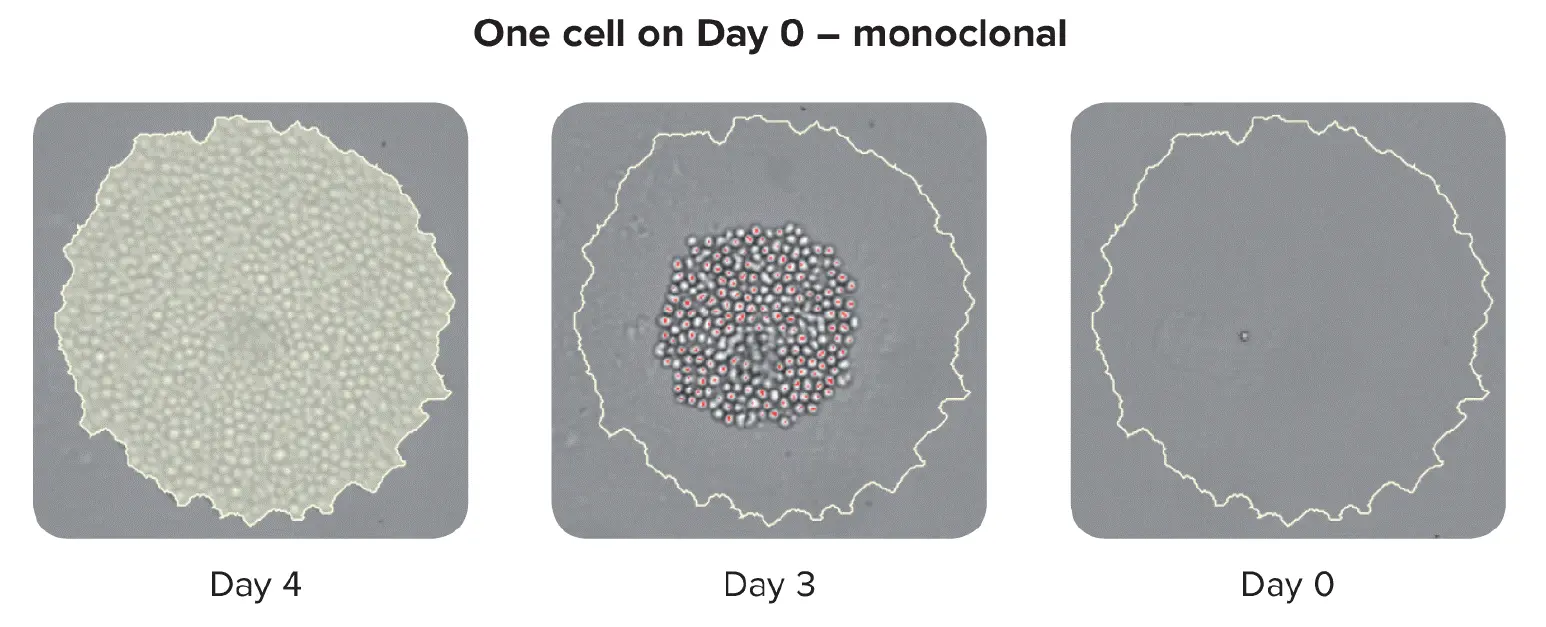
単クローン性の保証
スケールでモノクローナリティを保証するセルには、シングルセルプリンティングやコロニーピッキングのような自動化技術がある。HAT培地から単離されたコロニーをピッキングする際、インストゥルメンテーションはコロニーをピッキングした後、ゼロ日目からタイムラプスで画像を撮影する。目の前で証明されることが、単クローン性の証拠となる。高性能のクローンを保証するために、ラボでは細胞ベースまたは免疫ベースのアッセイと画像ベースの方法を組み合わせることができます。この併用戦略により、単クローン性が確保され、クローンが単一品種の抗体を分泌していることが保証されます。プロセスの最終段階として、エピトープ結合アッセイを実施し、エピトープ結合が均一かどうかを判定することも有用である。
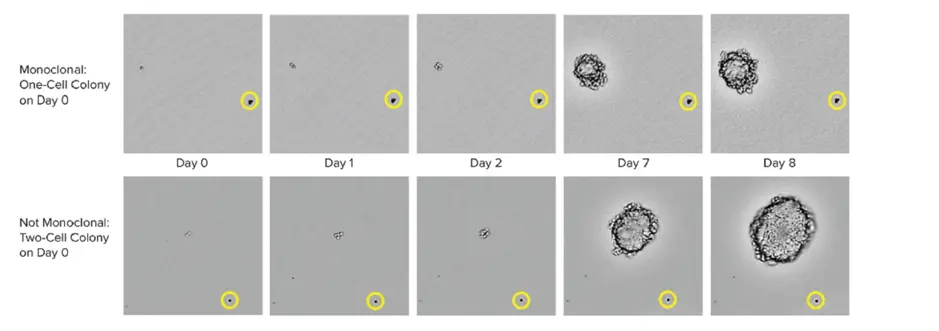
ターンアラウンドタイムにおけるロボット工学の役割
開発期間を短縮する究極の方法は、クローンを調べるためにハイスループットのロボット工学を導入することである。COVID-19の自動化mAbワークフローでは、クローンの挙動やモノクローナル抗体が高分子量凝集体を作る可能性を理解するために、自動精製が大いに役立っている。
ロボット工学をハイスループットで活用することは、新規治療薬を市場に投入する上で常に有利である。この方法は、タンパク質空間あるいはエピトープ空間のより良い概観を提供する。クローン数が多ければ、抗原を部分的にカバーする単一の mAb ではなく、所望の属性をすべてカバーする mAb を得られる可能性が高まります。
ハイスループットのワークフローでは、最も収率の高いモノクローンのサブセットに焦点を絞ることができます。そして、動物実験や毒性試験でさらなる評価を行うために、最高ランクのサブセットを進めることができる。また、大規模な精製に適さないサブセットを排除することで時間を節約し、研究所のCOVID-19研究の旅における資金流出を防ぐことができる。
将来のmAbラボプロセスの自動化
COVID-19研究所の多くは、週に何千ものクローンのデータを作成することができるため、すでに自動化プロセスを導入している。自動化された合成、発現、精製、生物物理学的特性解析により、mAbの治療メカニズムの理解はより容易になる。
さらに重要なことは、自動化が偏りのない解析方法と選択基準に道を開くことである。対物レンズは、狭い範囲のバリアントしか治療できない抗体のスケールアップを避けるために、幅広いバリアントや変異に対する抗体ライブラリーを多様化するために必要である。
SARS-CoV-2研究の将来とモノクローナル抗体の役割
mAbベースの治療薬は、臓器移植患者の急性拒絶反応を抑えるために開発されたmuromonab-CD3(Orthoclone OKT3)がFDAに初めて承認された1986年以来、米国で販売されている。(1)現在のCOVID-19の研究は、診断学においてもモノクローナル抗体の重要性を高めている。実際、モノクローナル抗体はSARS-CoV-2亜種の検出において重要な役割を果たした。
診断以外にも、現在のモノクローナル抗体は研究者が必要な修正を決定するのに役立ち、ワクチン候補の開発にも役立つ。基準となるmAbがウイルス変異体を中和できるかどうかを調べることで、研究者はより効率的な新規治療薬を開発するかどうかを決定することができる。
mRNAベースのワクチンがCOVID-19との戦いの中心にある一方で、モノクローナル抗体は、タンパク質ベースのワクチンから抗体ベースの治療薬まで、様々な応用の舞台裏で活躍してきた。
マダス博士とミッチェル博士は、今後、モノクローナル抗体は、乳幼児、(ワクチンに反応しにくい)合併症を持つ患者、ワクチン接種をためらっている人々など、ワクチン未接種の人々に特に応用できると考えている。前述したように、重要なのは、探索・生産プロセスの効率を上げることによって、費用対効果の高いmAbベースの治療薬を生産し、可能な限り広く利用できるようにすることである。
Molecular Devicesのラボオートメーション・ソリューションによるCOVID-19のモノクローナル抗体探索
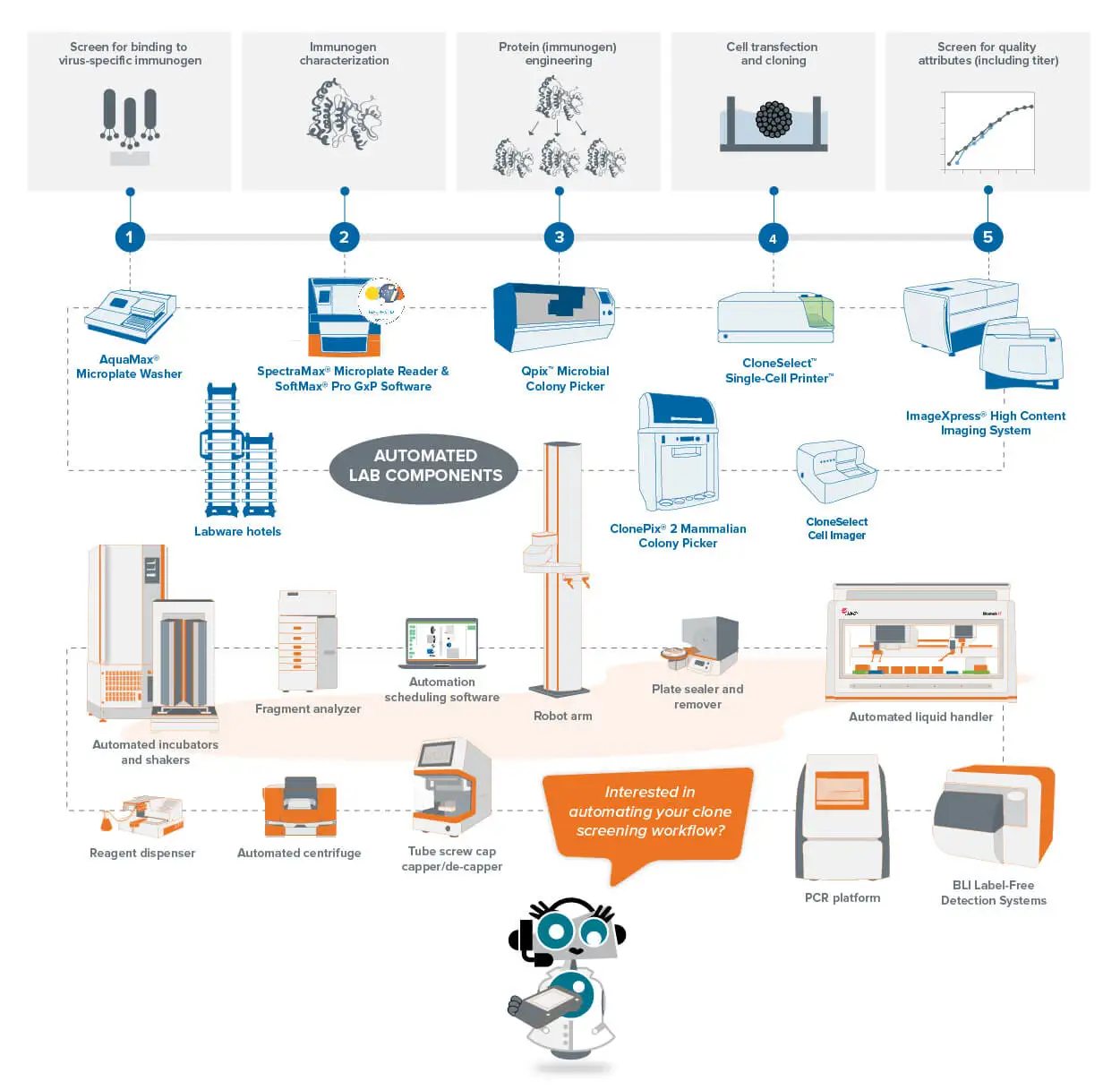
クローンスクリーニングはモノクローナル抗体探索のボトルネックの一つです。ターゲット抗原に関して何千もの細胞をテストし、分析しなければならないからです。自動化されたクローンスクリーニングワークフローは、作業時間を短縮し、複数のプロセスから抽出されたデータを統一・標準化することで、この負担を克服するのに役立ちます。
モレキュラー・デバイスは、必要不可欠なステップのための統合ワークフロー・ソリューションを構築しました。自動細胞株開発ワークフローは、一貫した十分なレベルの治療用タンパク質を産生するモノクローナル細胞株を作製することを目的としています。自動分子クローニングワークフローは、DNA配列の単離時のエラーやコンタミネーションを最小限に抑え、ベクターとしてご希望の生物種に増殖させることを目指します。
これらのワークフローは、目的タンパク質の収量を最大化すると同時に、ロボット工学による完全統合型ワークセルを実現するための他の機器を統合する機会を提供する。. 全体として、このようなワークフローは、費用対効果が高く、時間を節約でき、研究目標の変更に伴う変更も容易である。
ハイスループット クローンスクリーニングのためのラボ自動ワークフローのページでは、細胞株開発ワークフローについてさらに詳しく説明しています。モノクローナル抗体アプリケーションのページでは、mAbの生産方法と各工程の複雑さをご覧いただけます。
- Wang, S. S., Yan, Y. S., & Ho, K. (2021). 米国FDAが承認した高濃度製剤による治療用抗体:要約と展望。Antibody therapeutics, 4(4), 262-272. https://doi.org/10.1093/abt/tbab027