Application Note ウイルス中和アッセイの高速化:
ハイスループットスクリーニングに最適
- ELISAワークフローによる迅速で簡単なアッセイセットアップ
- BSL-3や細胞培養は不要
- プラーク減少中和試験のデータと一致する結果
PDF版(英語)
Cathy Olsen, PhD | Sr. Applications Scientist | モレキュラーデバイス
はじめに
SARS-CoV-2ウイルスによる世界的なCOVID-19パンデミックは、このウイルスの病原性の理解やワクチンの探索・開発のために、多くの研究ツールの迅速な開発を必要としました。ウイルス感染やワクチン接種に対する免疫応答をモニタリングするアッセイは、COVID-19研究において重要です。中和抗体は免疫応答およびワクチン有効性の主要なバイオマーカーであるため、患者血清サンプル中の中和抗体レベルを効率的にモニタリングできることは重要なパラメータです *1。
ヒト血清中の中和抗体の同定は、従来、プラーク減少中和試験(PRNT)などの方法で行われてきました。しかし、PRNTは標的細胞に感染性ウイルスを添加するため、BSL-3実験室と煩雑な細胞培養技術が必要です。結果データの解析には時間がかかり、自動化には適していません。代替法として、偽ウイルス中和試験(pVNT)は、ウイルスの修飾型を用いてBSL-2実験室で実施できますが、細胞培養と蛍光イメージングによる中和活性の測定が必要であり、サンプルのハイスループットスクリーニングには不向きです *2。
GenScript社の cPass™ SARS-CoV-2 Neutralization Antibody Detection Kit は、従来のウイルス中和アッセイの課題を克服するために開発された代替ウイルス中和試験(sVNT)です。このキットは、図1に概要を示し、図2に模式図を示すように、ELISAフォーマットを採用しています。
スパイクタンパク質の受容体結合ドメイン(RBD)のHRP結合フラグメントを、患者血清サンプル(中和抗体を含む可能性あり)と混合します。この混合物をACE2受容体でコートされたELISAプレートに添加します。サンプル中の抗体に中和活性がある場合、HRP-RBDのACE2への結合が阻害され、洗浄によりHRP-RBDが除去されます。吸光度マイクロプレートリーダーで測定されるシグナルは、中和抗体の存在下で低下し、アッセイコントロールとの比較により、試験サンプル中の中和活性を評価できます *3。
ここでは、SpectraMax® マイクロプレートリーダーで検出し、SoftMax® Proソフトウェアで解析したsVNTキットの結果を示します。これらの結果は、従来のpVNT法で得られた結果と密接に相関しながら、必要な時間はごくわずかで、より低いバイオセーフティレベルで実施可能です。

図1. PRNTとsVNTキットのワークフロー比較。sVNTアッセイはBSL-2実験室で1時間以内に完了できますが、PRNTは感染性SARS-CoV-2ウイルスと煩雑な細胞培養技術を必要とし、BSL-3実験室で2日以上かかります。
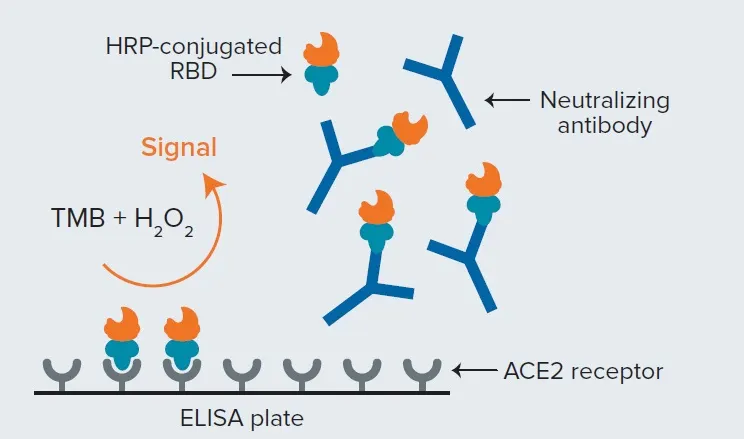
図2. SARS-CoV-2 sVNT法 このアッセイはELISAフォーマットを使用し、試験サンプル中の中和抗体によるRBDとACE2の結合阻害を検出します。
材料
- GenScript cPass™ SARS-CoV-2 中和抗体検出キット (GenScript)
- PRNT(Corgenix)により中和活性陽性が確認された血清検体(10 検体)
- MultiWash+™ マイクロプレートウォッシャー(モレキュラーデバイス)
- 吸光度検出モード付き モレキュラーデバイス マイクロプレートリーダー:
⚪︎SpectraMax® ABS Plusマイクロプレートリーダー
⚪︎SpectraMax® iD5 マルチモードマイクロプレートリーダー
⚪︎SpectraMax® i3x マルチモードマイクロプレートリーダー
⚪︎SpectraMax® M5e マルチモードマイクロプレートリーダー
測定方法
すべてのキット構成品と試験サンプルは、アッセイセットアップ前に室温に戻しました。
希釈が必要なキット試薬は以下のように調製しました:
- 1X洗浄液は、20Xストックを脱イオン水で希釈して作製
- HRP-RBDストック溶液は、HRP希釈バッファーで1:1000に希釈し、HRP-RBD作業溶液を作製
試験サンプルとアッセイコントロールはHRP結合RBDと混合し、以下のようにインキュベートしました。試験サンプルと陽性・陰性コントロールは、サンプル希釈バッファーで1:10に希釈(例:試験サンプル12 μL + バッファー108 μL)。各希釈サンプルとコントロールは、HRP-RBD作業溶液と等量混合(例:HRP-RBD作業溶液120 μL + 希釈試験サンプルまたはコントロール120 μL)。混合物は37°Cで15分間インキュベートしました。
陽性コントロール混合物、陰性コントロール混合物、サンプル混合物をアッセイストリップの二重ウェルに100 μLずつ添加。プレートを密封し、37°Cで15分間インキュベートしました。
MultiWash+プレートウォッシャーを使用し、すべてのウェルを1X洗浄液300 μLで4回洗浄し、最後に交差吸引。各ウェルにTMB溶液100 μLを添加し、プレートを密封して室温暗所で15分間インキュベートしました。
| カットオフ | 結果 | 解釈 |
|---|---|---|
| ≥ 30% | 陽性 | SARS-CoV-2中和抗体検出 |
| < 30% | 陰性 | SARS-CoV-2中和抗体検出せず |
表1. アッセイ結果の解釈に使用する阻害率カットオフ値
TMB基質でインキュベート後、各ウェルに停止溶液50 μLを添加し、450 nmで吸光度を直ちに測定しました。
試験結果の有効性は、陰性コントロールOD₄₅₀値が1.0以上、陽性コントロール値が0.3未満であるかを確認して評価。基準を満たさない場合、試験結果は無効となり再試験が必要です。
各試験サンプルの阻害率は、以下の式で算出:
$$\text{Inhibition} = \left( 1 - \frac{\text{OD value of Sample}}{\text{OD value of Negative Control}} \right) \times 100\%$$
表1のカットオフ値を用いて、サンプル結果を陽性または陰性と解釈(検出可能なSARS-CoV-2中和抗体の有無)。カットオフ値はキットマニュアルに記載。地域や民族背景に応じて、代表的な患者血清パネルに基づき独自のカットオフ値設定を推奨します。
結果
アッセイ結果の品質は陰性・陽性コントロールで評価。表2に示すように、陰性コントロールウェルのOD₄₅₀値は1.0以上、陽性コントロールウェルのOD₄₅₀値は0.3未満であり、sVNTキットの品質管理要件を満たしました。
サンプルと陰性コントロールのOD₄₅₀値を用いて阻害率を算出しました(方法参照)。阻害率が30%以上の場合、SARS-CoV-2中和抗体の存在を陽性と解釈、30%未満の場合は陰性と解釈しました。PRNT(Plaque Reduction Neutralization Test:プラーク減少中和試験)で中和活性陰性と判定された3サンプルは、sVNTアッセイでも陰性。同様に、PRNTで陽性と判定された10サンプルは、sVNTでも陽性でした(表3)。
| コントロール | OD₄₅₀ | 平均 | 標準偏差 | %CV |
|---|---|---|---|---|
| 2.066 2.148 | 2.107 | 0.058 | 2.7 | |
| 0.063 0.061 | 0.062 | 0.002 | 2.8 |
表2. 陰性・陽性コントロールOD₄₅₀値はそれぞれ1.0以上および0.3未満であり、アッセイ結果を検証。コントロールは二重測定で実施し、%CV値は3.0未満で再現性を示します。
|
プラークの減少 中和試験 |
GenScript sVNTアッセイ |
|||
|---|---|---|---|---|
| サンプル | PRNT90 |
平均 OD₄₅₀ |
% 阻害率 |
結果 |
| N-1 | <20 | 1.991 | 5.5 | ネガティブ |
| N-2 | <10 | 1.869 | 11.3 | ネガティブ |
| N-3 | <20 | 1.590 | 24.6 | ネガティブ |
| P-1 | 160 | 0.112 | 94.7 | ポジティブ |
| P-2 | 80 | 0.061 | 97.1 | ポジティブ |
| P-3 | 80 | 0.096 | 95.4 | ポジティブ |
| P-4 | 160 | 0.091 | 95.7 | ポジティブ |
| P-5 | 320 | 0.084 | 96.0 | ポジティブ |
| P-6 | 320 | 0.141 | 93.3 | ポジティブ |
| P-7 | 160 | 0.105 | 95.0 | ポジティブ |
| P-8 | 640 | 0.101 | 95.2 | ポジティブ |
| P-9 | 640 | 0.149 | 92.9 | ポジティブ |
| P-10 | 160 | 0.225 | 89.3 | ポジティブ |
表3. PRNTで陰性と判定された3サンプル、および陽性と判定された10サンプルの阻害率と陽性/陰性結果。結果はSpectraMax ABS Plusプレートリーダーで取得。他のSpectraMaxプレートリーダーでも同一結果(陽性/陰性)を確認しました。
結論
GenScript cPass SARS-CoV-2 Neutralization Antibody Detection Kitを用いて得られた患者血清サンプルのデータは、従来の煩雑なPRNT法で得られた結果と一致しました。sVNTキットは、約1時間で完了できるコンパクトなELISAワークフローと使いやすい試薬を提供します。必要な洗浄ステップはMultiWash+マイクロプレートウォッシャーで自動化し、貴重な時間を節約できます。SpectraMaxプレートリーダーとSoftMax Proソフトウェアは、アッセイ専用プロトコールを用いて必要な計算を自動適用し、結果を自動出力します。
参考文献
- Lau EHY, Tsang OTY, Hui DSC, Kwan MYW, Chan W, Chiu SS, Ko RLW, Chan KH, Cheng SMS, Perera RAPM, Cowling BJ, Poon LLM, and Peiris M. Neutralizing antibody titres in SARS-CoV-2 infections. Nature Communications 12:63 (2021).
- Sahin U, Muik A […] and Tureci O. COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responses. Nature 586, 594–599 (2020).
- SARS-CoV-2 surrogate Virus Neutralization Test (sVNT) Kit Manual (cat. #L00847).
PDF版(英語)