遺伝子編集とは
遺伝子編集とは、生物のゲノムDNAを欠失したり、挿入、置換、改変する遺伝子操作のことです。さまざまな技術によってDNAに切断を生じさせる部位特異的な標的であって、必ずしも修復機構が関与するわけではありません。遺伝子編集は、不活性化と修正という2つの技術で構成されています。
不活性化には標的遺伝子の転換が含まれ、修正では遺伝子の切断による欠陥遺伝子の修復が促進されます。遺伝子編集は、医薬品開発や遺伝子手術、動物モデルや病気の調査と治療、さらに食品やバイオ燃料、生体材料合成など、さまざま分野で広く活用されており、今後も活用範囲が増えていくと考えられています。
遺伝子編集が最初に研究されたのは1900年代後半です。その後、CRISPRが遺伝子編集技術の主な手法として広く使われるようになると、遺伝子治療は遺伝子編集の応用として注目されるようになりました。CRISPRは、欠陥のある遺伝子や欠落した遺伝子を補うために既存の遺伝子に付加する遺伝子付加と、病気に関連するDNAを直接改変することによって病気を治療する遺伝子編集という2つのアプローチによって達成することができます。
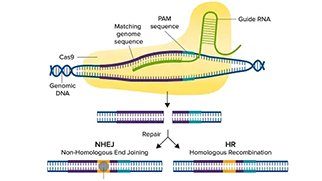
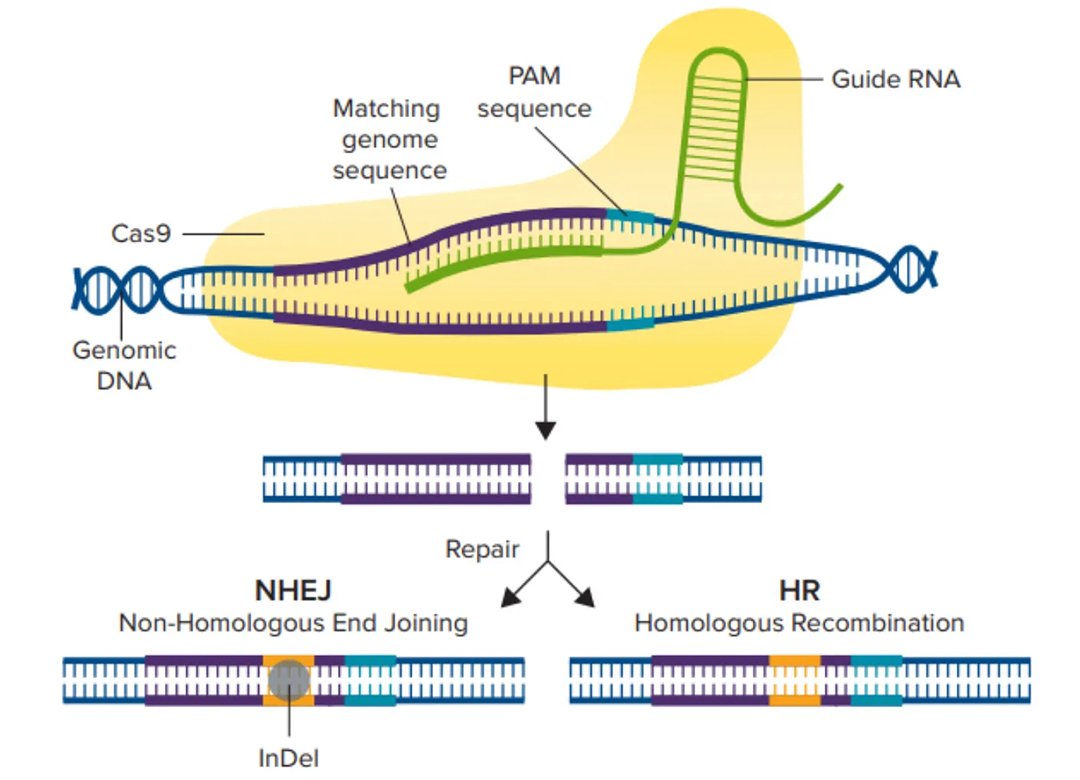
crRNAに似たガイドRNA(gRNA)は遺伝子内のある領域を標的として設計され、Cas9酵素は宿主細胞ゲノムのこの特定領域に二本鎖切断を作り出すことができます(図1)。二本鎖切断が生じると、細胞は非相同末端接合(NHEJ)経路または相同性指向性組換え(HDR)経路という2つの修復経路のいずれかを辿ります。NHEJ経路は、塩基の挿入や欠失(indel)を介して遺伝子を破壊するために使用され、HDR経路は、2つの類似または同一のDNA分子間で配列を交換することにより、レポーター遺伝子や編集された配列をノックインするために使用されます。
CRISPRによる遺伝子編集のスケールアップ
「CRISPR」はClustered Regularly Interspaced Short Palindromic Repeatsの略です。このDNA配列は、細菌や古細菌などの原核生物の免疫システムの一部として最初に発見され、2012年以降、遺伝子編集ツールとして重要性が高まっています(Jinek et al.)。この遺伝子編集ツールは、その精度の高さから、DNA配列の挿入(ノックイン)、欠失(ノックアウト)などの改変ができ、農業、疾病モデル、遺伝子治療、創薬など、数え切れないほどの応用が期待されています。従来はTALENSやZFNSのような手間がかかる高価な既存の遺伝子編集ツールが主流でしたが、CRISPRの登場で様変わりしました。
CRISPRの配列は、各回文反復の後にスペーサーと呼ばれる過去のウイルス侵入者のDNAを含んでおり、これらは将来の類似ウイルスの検出と破壊に役立ちます。このメカニズムの理解が広がったことで(Jinek et al., 2012)、真核細胞においてCRISPRが最初に使用され(Cong, L, et al., 2013)、後に異なる分野に属する他の細胞タイプおよび生物体でも使用されるようになりました。CRISPR-Cas9システムには、リボ核タンパク質複合体を形成する2つの主要コンポーネントがあります。第一の構成要素またはガイドRNAはゲノム中の相補的DNA配列に結合し、第二の構成要素である化膿連鎖球菌由来のCas9(SpCas9)は標的部位で二本鎖切断を行います。プロトスペーサー隣接モチーフ(PAM)は、上流の切断が起こるためにヌクレアーゼが最初に結合する場所です。異なるCRISPRヌクレアーゼは異なるPAM部位を持っており、カットが行われると細胞の修復システムが活性化され、ゲノムの編集も開始されます。
遺伝子編集ワークフロー
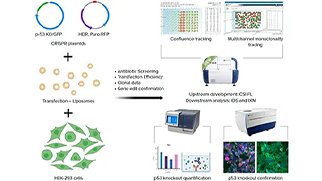
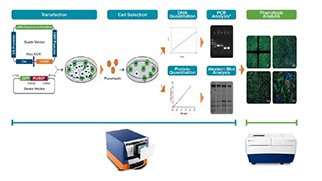
CRISPR機構を用いた遺伝子編集ワークフローでは、編集が確認された細胞株を得るために様々なステップが必要です。適切なツールを用いてこれらの作業を最適化することは、時間や労力、コストの削減につながります。作業の最適化は、研究開発を加速し、創薬、病気治療、遺伝子編集作物生産などに革命をもたらします。遺伝子編集を通じて世界中の科学コミュニティが目指す目標を達成するための手順と、効果的な解決策についてご紹介します。