Application Note 自動タイムラプスイメージングによる血管新生の評価
- ライブセルタイムラプスイメージングにより、血管新生ネットワーク形成の経時的変化を可視化
- 事前設定済みの解析モジュールを用いて、血管新生の各段階におけるHUVEC細胞の定量評価を実施
- チューブの長さや面積、さらに分岐数、セグメント数、接続セット数など、血管新生ネットワークを評価するための複数のリードアウトを生成
PDF版(英語)
Matthew Hammer|アプリケーションサイエンティスト|モレキュラーデバイス
Jayne Hesley|Sr.アプリケーションサイエンティスト|モレキュラーデバイス
はじめに
既存の血管から新しい血管が形成される血管新生は、脊椎動物の発生や創傷治癒に関わる重要な生理学的プロセスです。血管新生のプロセスは、血管新生促進分子と抑制分子の作用によって厳密な恒常性制御下にあります。この恒常性の破綻は、さまざまな病理学的状態に関与することが示されています。血管新生や血管維持の不全は、心筋梗塞などの虚血性疾患や神経変性疾患に関連しています *4。また、血管増殖の異常な増加や血管形態の異常は、がん、慢性炎症、加齢黄斑変性など多くの疾患と関連しています。*1,3-5。
血管新生や血管新生促進・抑制化合物の影響を研究するためのさまざまな細胞ベースアッセイの開発は、がんや心筋虚血などの疾患治療薬の開発に不可欠です。血管新生を評価するためにはイメージング手法が重要であり、この複雑な生物学を適切に取得・解析・定量化するためには、堅牢で精密なイメージングシステムとソフトウェアの使用が不可欠です。
本研究では、Sartorius社のIncuCyte® Angiogenesis 96-well PrimeKitを用いた共培養血管新生モデル(正常ヒト皮膚線維芽細胞とGFPを発現するレンチウイルス感染ヒト臍帯静脈内皮細胞[HUVEC])を利用し、ImageXpress® Pico 自動細胞イメージングシステムによる血管新生の経時的定量評価の有用性を示しました。ライブセルのタイムラプスイメージングを間欠的に実施し、血管新生促進・抑制化合物がHUVECの血管新生チューブ形成に与える用量依存的な影響を評価しました。さらに、自動画像解析により、複雑なチューブネットワークを評価するための複数のリードアウトを生成しました。
材料
- IncuCyte Angiogenesis 96-well PrimeKit(Sartorius)封入:
◦正常ヒト真皮線維芽(NHDF)細胞
◦CytoLight Greenを発現するヒト臍帯静脈内皮細胞(HUVEC CytoLight Green)
◦培地サプリメント - IncuCyte Angiogenesis PrimeKit VEGF/Suramin サプリメントキット(Sartorius)
- 黒壁透明底96ウェルマイクロプレート(Greiner)
- ラパマイシン(Thermo Fisher Scientific)
- ImageXpress Pico 自動細胞イメージングシステムおよび CellReporterXpress® 自動画像取得・解析ソフトウェア
方法
Angiogenesis PrimeKit アッセイ
Angiogenesis PrimeKitには、正常ヒト皮膚線維芽細胞(NHDF)とGFPを発現する正常ヒト臍帯静脈内皮細胞(GFP-HUVEC)が含まれています。NHDFはメーカーのプロトコールに従って解凍し、播種用培地で再構成しました。再構成後、NHDFを含むコニカルチューブを200 × gで4分間遠心し、沈殿させました。上清を除去し、NHDFペレットを12 mLの完全播種培地に再懸濁しました。このNHDF懸濁液を96ウェルの黒色壁・透明底マイクロプレートの各ウェルに100 μLずつ播種しました。プレートは室温のクリーンベンチ内で1時間インキュベートし、細胞を定着させました。次に、GFP-HUVECを各ウェルに100 μLずつNHDF層の上に播種しました。さらに1時間インキュベートしてHUVECを定着させた後、プレートを37°Cのインキュベーターに移し、4時間インキュベートした後、ImageXpress PicoシステムでDay 0のリードアウトを取得しました。
翌日、各ウェルの播種培地を除去し、150 μLの成長培地を添加しました。最初の化合物添加はDay 2に行い、その後Day 4とDay 7に追加しました。化合物溶液は温めた完全アッセイ培地で調製しました。血管新生を刺激するために、血管内皮増殖因子(VEGF)をHUVECに添加しました。VEGFの作業溶液は\( \frac{16\,\mathrm{ng}}{\mathrm{mL}} \)から\( \frac{0.25\,\mathrm{ng}}{\mathrm{mL}} \)までの1:4希釈系列で4連複製しました。既知の血管新生阻害化合物の効果を評価するため、VEGF存在下でsuraminまたはrapamycinを添加しました。suraminとrapamycinの2X作業溶液をVEGFの2X溶液と組み合わせてウェルに添加しました。阻害剤処理は4連複製で1:4希釈系列とし、各ウェルのVEGF最終濃度は\( \frac{4\,\mathrm{ng}}{\mathrm{mL}} \)でした。阻害剤の最終1X濃度は、suraminが80 μMから1.25 μM、rapamycinが1.2 nMから0.018 nMでした。
自動ライブセルイメージング
ImageXpress Picoシステムを用い、5% CO₂、20% O₂、85%湿度、37°Cの環境制御下でライブセルイメージングを実施しました。間欠的なタイムラプスイメージングを行い、プレートをImageXpress Picoでイメージング後、次のイメージング時点までインキュベーターに戻しました。最初のイメージングは播種後1時間、次は12時間後、さらに24時間後に行いました。その後、9日間にわたり24時間ごとにイメージングしました。
各ウェルで9視野を10X対物レンズで明視野およびFITCチャンネルでイメージングし、ウェルの約35%をカバーしました。画像はStitched Acquisition Protocolを用いてオンザフライで自動結合されました。FITCチャンネル画像はオンザフライで2Dデコンボリューションを適用し、露光時間は200 ms、明視野画像は10 msでした。
自動画像解析
CellReporterXpressソフトウェアにプリセットされているAngiogenesis Skeletonization解析モジュールを使用し、血管新生ネットワークの発達を識別・測定しました。最小限のユーザー入力で、解析モジュールはHUVECの分裂、成長、チューブ形成を正確にセグメント化しました。解析設定は、幅4 μm以上の細長い構造をチューブとして識別するよう最適化されており、小さな細胞や非チューブ形成イベント、デブリは除外されました。HUVECの分裂・成長を示す大きな細胞塊はノードとして識別されました 図1D。さらに、血管新生促進・抑制化合物の効果を評価するため、平均および総チューブ長と面積、セットごとのチューブ長、ノード数、セグメント数、分岐点数などの定量測定値を生成しました。本アプリケーションノートでは、VEGFおよび血管新生阻害化合物がHUVECのチューブ形成に与える影響を示すため、セットごとのチューブ長測定値を提示します 図2,3。
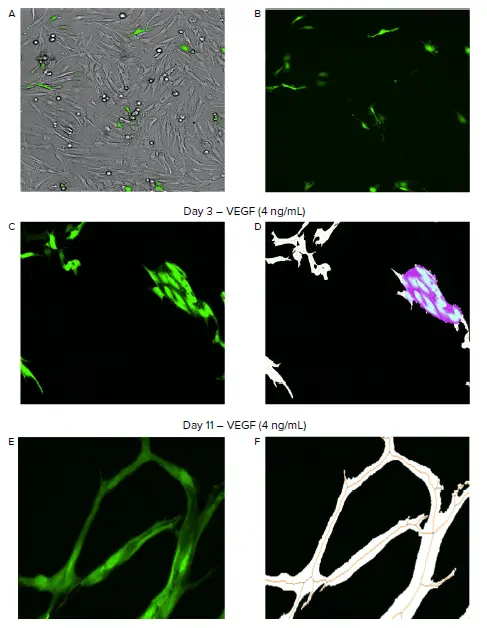
図1. ImageXpress Picoシステムによる血管新生の自動イメージングと解析。A–B. 明視野で線維芽細胞とHUVECの共培養を可視化し、FITCチャンネルでGFP発現HUVEC(緑)をイメージングしました。C–F. CellReporterXpressソフトウェアのAngiogenesis Skeletonization解析モジュールにより、タイムラプス実験全体でチューブネットワーク形成を識別・測定しました。解析モジュールは血管新生チューブ(白)、チューブネットワークのスケルトン(オレンジ)、分岐点(青)、分裂・成長中の細胞塊をノード(紫)として識別しました(D, F)。
結果
VEGFによる血管新生の刺激
血管新生促進因子の効果をモニタリングする能力は、虚血性疾患治療薬の開発や、発生・創傷治癒における血管新生の重要性を理解する上で不可欠です。基本的なシグナル分子、特に主要な増殖因子は血管ネットワークの発達とパターン形成を制御します *2,3。本アッセイでは、血管内皮細胞における重要な血管新生促進因子であるVEGFを用いて血管新生を刺激しました。HUVECはチューブの基礎的な伸長・形成を示し、VEGF添加後に即時応答が確認されました。Day 2の増殖因子添加後、およびその後の各添加後にチューブ長の顕著な増加が見られました(図3)。ただし、VEGFの最高濃度\( \frac{16\,\mathrm{ng}}{\mathrm{mL}} \)では、Day 7添加後のチューブ長増加はわずかでした。\( \frac{16\,\mathrm{ng}}{\mathrm{mL}} \)と\( \frac{4\,\mathrm{ng}}{\mathrm{mL}} \)のVEGFは最大のネットワーク形成刺激を示し、最も低い2濃度ではそれぞれ60%および40%の刺激にとどまりました。
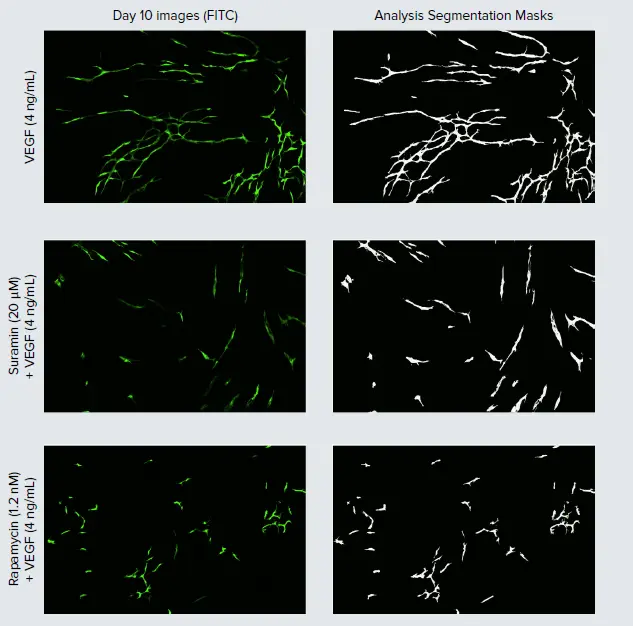
図2. 血管新生チューブネットワーク形成の刺激と阻害。Day 10の代表的なHUVEC画像(左)と、対応するチューブネットワークの解析セグメンテーションマスク(白)(右)を表示しています。VEGF刺激下でのネットワーク形成に対する阻害化合物の効果を評価するため、suraminおよびrapamycinをVEGF\( \frac{4\,\mathrm{ng}}{\mathrm{mL}} \)存在下でDay 2、4、7に添加しました。
suraminおよびrapamycinによる血管新生の阻害
血管新生阻害は、がんや炎症性疾患、変性疾患などの治療開発において重要な焦点であり、抗VEGF療法は特定のがんや加齢黄斑変性症治療薬としてすでに市場に存在します *3。VEGF媒介血管新生の阻害を示すため、一般的なチロシンキナーゼ阻害剤であるsuraminと、mTOR阻害剤であるrapamycinをVEGF\( \frac{4\,\mathrm{ng}}{\mathrm{mL}} \)と併用して評価しました。両化合物はHUVECのチューブ形成に負の影響を与え、VEGF \( \frac{4\,\mathrm{ng}}{\mathrm{mL}} \)対照と比較してチューブ長が短縮しました(図 2,3)。阻害効果は明確に用量依存的であり、最高濃度のsuramin(80 μM)では、タイムラプス実験全体でチューブ長が減少しました。
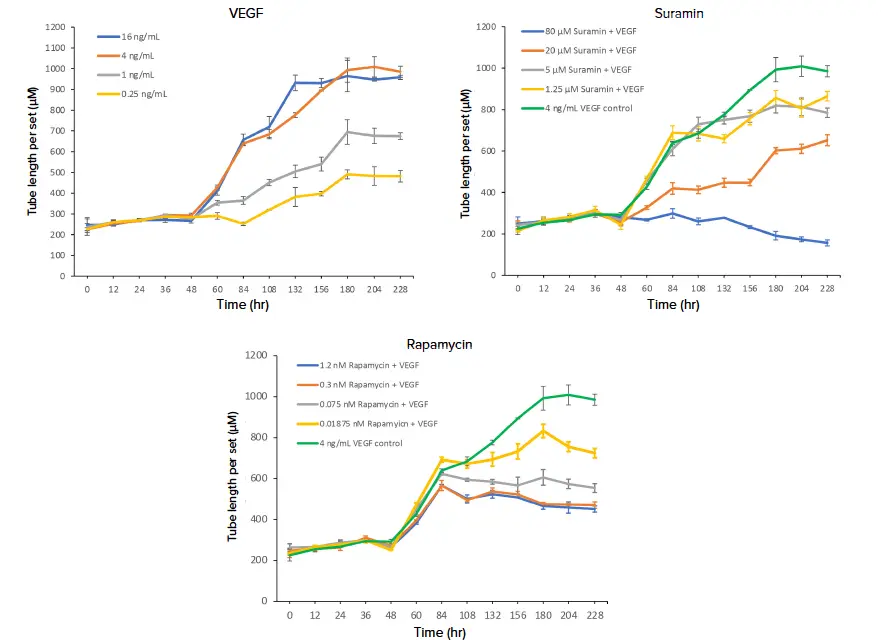
図3. 血管新生チューブネットワーク形成の評価のためのチューブ長測定。CellReporterXpressソフトウェアのAngiogenesis Skeletonization解析モジュールから生成された1セットあたりのチューブ長(チューブ長をミクロン単位で連結セット数で割ったもの)を用いて、血管新生促進因子VEGF(A)、抗血管新生化合物スラミン(B)およびラパマイシン(C)の濃度増加の効果を評価しました。スラミンとラパマイシンは\( \frac{4\,\mathrm{ng}}{\mathrm{mL}} \)のVEGF存在下でウェルに添加し、これらの化合物の効果を\( \frac{4\,\mathrm{ng}}{\mathrm{mL}} \)のVEGFコントロールと比較しました。様々な濃度の処理を4回反復し、反復のデータポイントを平均しました。
結論
血管新生の臨床的・生物学的意義は、この複雑で動的なプロセスを研究するためのin vitro細胞ベースアッセイの重要性を強調しています。本データは、ImageXpress Picoシステムがライブセル環境を最適に維持しながら、血管新生促進および阻害化合物の効果を正確にイメージングできることを示しました。堅牢な解析手法により、血管新生ネットワークの特徴付けと定量化が可能となり、新規治療薬の血管新生への影響を評価するために活用できます。
参考文献
- Li, Tinglu et al. “Tumor angiogenesis and anti-angiogenic gene therapy for cancer.” Oncology letters vol. 16,1 (2018): 687-702. doi:10.3892/ol.2018.8733
- Matsumoto, Ken, and Ema, Masatsugu. “Roles of VEGF-A signalling in development, regeneration, and tumours.” The Journal of Biochemistry, Volume 156, Issue 1, July 2014, Pages 1–10, https://doi.org/10.1093/jb/mvu031
- Melincovici, Carmen Stanca et al. “Vascular endothelial growth factor (VEGF) – key factor in normal and pathological angiogenesis.” Romanian journal of morphology and embryology = Revue roumaine de morphologie et embryologie vol. 59,2 (2018): 455–467.
- Moriya, Junji, and Tohru Minamino. “Angiogenesis, Cancer, and Vascular Aging.” Frontiers in cardiovascular medicine vol. 4 65. 24 Oct. 2017, doi:10.3389/fcvm.2017.00065
- Nowak-Sliwinska, Patrycja et al. “Consensus guidelines for the use and interpretation of angiogenesis assays.” Angiogenesis vol. 21,3 (2018): 425–532. doi:10.1007/s10456-018-9613-x
PDF版(英語)