Application Note Matrigel における
3D 細胞培養の作製と解析の自動化
PDF版(英語)
Michael Kowalski(ベックマン・コールター・ライフサイエンス、インディアナポリス、スタッフアプリケーションサイエンティスト)
Kayla Hill(セルラーイメージングフィールドアプリケーションサイエンティスト、モレキュラーデバイス、カリフォルニア州サンノゼ)
Kristin Prasauckas(フィールドアプリケーションサイエンティスト、マネージャー、モレキュラーデバイス、カリフォルニア州サンノゼ)
Tara Jones-Roe(マーケティング・マネージャー、ベックマン・コールター・ライフサイエンス、インディアナポリス)
はじめに
疾患モデルの生物学的妥当性や創薬研究の予測精度を高める手法として、研究者は3D細胞培養に注目しています *1。3Dモデルでは、細胞同士の相互作用が増加し、従来の単層培養で顕著な細胞と培養容器表面との相互作用が減少または排除されます。3D細胞培養の作製方法には複数の手法があり、それぞれに特有の利点と課題がありますが、多くの課題は自動化によって克服可能です。
3D空間で細胞を培養する一般的な方法のひとつが、Matrigel のような細胞外マトリックスベースのハイドロゲルを使用する方法です。Matrigel 培養と2D細胞培養の違いは、細胞形態(図1)、細胞極性、遺伝子発現などに明確に現れます(Baker and Chen によるレビュー²)。Matrigel は、細胞移動や3D構造形成の研究にも活用されており、例えば血管新生研究における内皮細胞のチューブ形成などが挙げられます *3,*4。
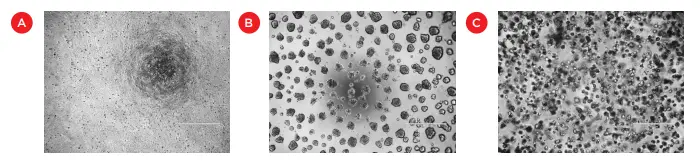
図1. HCT 116 細胞を標準的な単層培養(A)、Matrigel 表面上(B)、Matrigel 層内(C)で培養した画像を示しています。スケールバー = 500 µm。
Matrigel の特性のひとつとして、低温では液体であり、室温または37℃でゲル化する点が挙げられます。この性質により、取り扱いが難しい場合があります。細胞は通常、Matrigel をコーティングした表面上、または厚めの Matrigel 層内に埋め込んで培養され(図1)、ゲル化後に培地を上から添加します。Matrigel 培養細胞のアッセイも課題が多く、プレートリーダーやイメージング装置を用いてゲル内の細胞を直接解析する方法や、Matrigel を徐々に溶解して浮遊細胞やライセートとして処理する方法などがあります。これらのステップは手作業では困難が伴いますが、本稿では、Matrigel 培養の播種、処理、解析準備において自動化をどのように活用したかをご紹介します。さらに、自動化により384ウェルプレートの使用が可能となり、Matrigel やその他の高価な試薬の使用量を条件ごとに削減することで、コスト効率の向上も実現しました。
概要
- Biomek FXでMatrigel培養のプレーティング、薬剤処理、染色を自動化しました。
- ワークステーション
◦温度制御位置はMatrigelを液状に保ち、ゲル化を誘導しました
◦ピペッティングの最適化により、Matrigel使用量の削減によるコスト削減を実現 - 以下を用いて、Matrigel培養における細胞増殖とアポトーシス誘導を測定しました:
◦SpectraMax i3x マルチモードマイクロプレートリーダーと SpectraMax MiniMax 300イメージングサイトメーター
◦ImageXpress® Micro Confocalハイコンテントイメージングシステム
Matrigel の自動播種と培養
Matrigel を用いたワークフローは、96チャンネルヘッドとSpan-8ピペッターを備えた Biomek FXP ワークステーション(Beckman Coulter) 上で自動化されました(図2)。柔軟性の高い Biomek ワークステーションには、Matrigel を液状に保つための温度制御付きペルチェポジションと、アッセイプレートを加温してゲル化を促進するための加熱機能が多数搭載されています。96チャンネルヘッドには、任意のチップパターンで使用可能な EST(Enhanced Selective Tip)機能が搭載されており、柔軟なピペッティングが可能です。細胞操作の無菌性は、滅菌済みの Biomek ピペットチップと HEPAフィルター付きエンクロージャーによって確保されており、培地に抗生物質を含まない条件でもコンタミネーションは検出されませんでした。
細胞の播種
氷上で解凍したフェノールレッド非含有の Matrigel(Corning)を FluoroBrite DMEM 培地(Thermo Fisher Scientific)で 6 mg/mL に希釈し、埋め込み培養用には HCT 116 細胞を 100,000 cells/mL の濃度で添加しました。Matrigel(細胞あり/なし)は、4℃に保たれた振とう式ペルチェ装置上のディープウェルプレートの1列に分注されました。その後、**384ウェル黒色側壁・透明底プレート(Greiner)**の各ウェルに、EST機能を用いて列ごとに 25 µL を分注しました。アッセイプレートは静的ペルチェ上で 37℃に加温され、30分間で Matrigel をゲル化させました。ゲル化後、各ウェルに 10% FBS を含む FluoroBrite DMEM 培地を 75 µL 添加しました。Matrigel 表面培養の場合は、HCT 116 細胞を Matrigel ではなく補助培地に添加しました。最終的な細胞播種数は、埋め込み培養で 2500 cells/well、表面培養で 8000 cells/well でした
上述の通り、Matrigel 培養の播種には多くの課題があります。自動化により、ピペットチップをウェル底から 0.3 mm 上に正確に位置させることで、少量の Matrigel をウェル全体に均一に広げることが可能になりました。手動ピペッティングでは、ウェル底に接触して傷をつけたり、分注量に影響を与えたり、ウェル側面に Matrigel が付着して広がらないなどの問題が発生します。手動で均一なウェルカバレッジを得るには、Matrigel の分注量を 50 µL に倍増する必要があり、実験コストも倍増してしまいます。
自動化のもうひとつの利点は、吸引・分注・混合速度を低速に設定することで、Matrigel 溶液内に気泡が発生するのを防げる点です。分注時に気泡が入らないよう、ピペットチップには少量の Matrigel を追加吸引しました。Matrigel 培養で頻繁に問題となる気泡は、自動播種直後の培養では一切見られませんでした。培養は 37℃、5% CO₂ インキュベーター内で保存し、処理や解析の前に適宜時間を置いて行いました。
細胞増殖アッセイ
Matrigel 表面培養における初期の細胞増殖を測定するため、培養開始から3日間、毎日各ウェルに 100 µL の XTT 試薬を添加しました。吸光度は **SpectraMax i3x マルチモードマイクロプレートリーダー(モレキュラーデバイス)**を用いて、475 nm および 660 nm で測定しました(図2)。その結果、R² = 0.985 の線形増殖率が得られ、8000細胞が安定して増殖していることが示されました(図3A)。3日目に吸光度がやや頭打ちになったのは、増殖の鈍化を示している可能性もありますが、XTT アッセイの吸光度上限に近づいていることを示している可能性が高く、今後の測定では試薬のインキュベーション時間を短縮する必要があると考えられます。

図2. 左:Matrigel 培養の播種、処理、染色に使用された Biomek FXP ワークステーション。中央:SpectraMax i3x マルチモードマイクロプレートリーダーと MiniMax 300 イメージングサイトメーターによる解析。右:ImageXpress Micro Confocal ハイコンテントイメージングシステムによる解析。
XTT アッセイはエンドポイント測定であるため、ラベルフリーで細胞増殖を追跡する方法も検討しました。SpectraMax i3x マルチモードマイクロプレートリーダーに搭載された MiniMax 300 イメージングサイトメーターを用いて、表面コロニーがウェル内で占める割合(「フィールド」解析設定)を測定しました。Matrigel のわずかな凹みの影響で焦点面が不明瞭になるにもかかわらず、表面コロニーのコンフルエンスの変化は時間経過とともに明確に検出されました(データ未掲載)。重要なのは、これらの培養におけるコロニー形態が、細胞数の倍増とコンフルエンスの倍増が必ずしも一致しない点です。XTT アッセイは細胞数の増加をより正確に反映する可能性がありますが、イメージングによる解析は、細胞が安定して増殖していることを確認するための代替手段として有効であり、将来的な実験に使用する細胞の状態確認にも役立ちます。
Matrigel 埋め込み培養では、焦点面の欠如がさらに大きな課題となります。しかし、MiniMax サイトメーターのフィールド測定を用いることで、播種細胞数の違いや時間経過による増殖の違いを再び確認することができました。図3Bでは、MiniMax サイトメーターで取得・解析されたウェル画像を示しており、細胞が存在する領域が識別されています。3日間でマスクされた細胞領域が増加している様子が確認できます。この増加と、他の播種細胞数におけるコンフルエンスの変化は図3Cにグラフで示されています。細胞数の直接的な測定ではないかもしれませんが、成長曲線の高い線形性(R² = 0.968~0.999)と播種数ごとの明確な差異から、この方法が Matrigel 埋め込み培養におけるラベルフリーの細胞増殖追跡に有効であることが示唆されます。
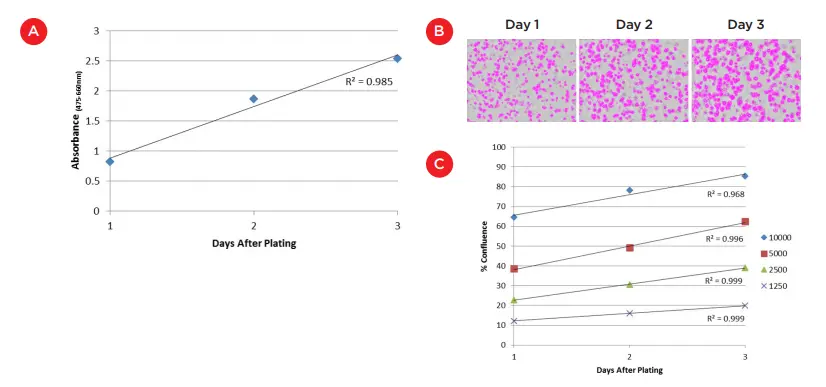
図3. A)Matrigel 表面で培養された 8000 細胞の XTT アッセイ(3日間)。XTT 試薬と4時間インキュベート後、SpectraMax i3x マルチモードマイクロプレートリーダーで吸光度を測定。B)Matrigel 埋め込み培養された HCT 116 細胞のコンフルエンス測定(MiniMax サイトメーターのフィールド解析)。画像は、2500細胞のマスク領域が3日間で増加する様子を示します。C)各初期播種細胞数におけるコンフルエンス測定のグラフ。培養初期3日間のコンフルエンス変化はすべての細胞数で高い線形性を示しました(R² = 0.968~0.999)。
化合物処理とアポトーシス解析
化合物の希釈と添加
3D培養の目的のひとつは、生物学的により妥当性の高い系で細胞の刺激応答を評価することです。ここでは、Matrigel 培養された結腸がん細胞(HCT 116)がアポトーシス誘導剤にどのように応答するかを検討しました。Matrigel 埋め込み後5日目に、アポトーシス誘導剤を NucBlue® Live ReadyProbes® Reagent(Thermo Fisher Scientific)で以下の濃度に希釈しました。ストウロスポリン:10 µM、カンプトテシン:20 µM、5-フルオロウラシル:375 µM。Matrigel 内の核染色には長時間のインキュベーションが必要なため、NucBlue を希釈液として使用しました。これらの溶液は、96ウェル丸底プレートの第1列に添加され、Span-8 ピペッターにより、1% DMSO を含む NucBlue が残りの列に分注されました。その後、EST 機能を用いて各列で1:3の段階希釈を行い、最終列は陰性対照(DMSOのみ)としました。
Matrigel 培養ウェルからは、液面の高さ(100 µL)に合わせて 10 µL の培地を吸引しました。これにより、Matrigel を乱すことなく、蒸発によって液量が減少したウェル(特に端のウェル)も他のウェルと同じ液量に調整されました。この体積の正規化により、化合物希釈液を 10 µL 添加した後の最終濃度がプレート全体で正確に保たれました。
アポトーシスアッセイ
化合物処理から24時間後、CellEvent® Caspase-3/7 Green(Thermo Fisher Scientific)を 10 µL 添加し、37℃で6時間インキュベートしてアポトーシス細胞を染色しました。細胞画像は、ImageXpress Micro Confocal ハイコンテントイメージングシステムを用いて取得しました(図2)。DAPI および FITC フィルターを使用し、4倍倍率でウェル全体を撮像しました。Zスタックを取得することで、図4Aに示すように、Matrigel 内に埋め込まれた細胞を3D空間で可視化することができました。図4Bでは、各誘導剤の上位5段階希釈のウェルにおけるZスタックの2D投影画像を示しています。これらの投影画像により、厚さ2 mmの Matrigel 層全体に埋め込まれた細胞(青:核)およびカスパーゼ陽性細胞(緑)をカウントし、各化合物によるアポトーシス誘導の相対的なレベルを評価しました。
図4Cでは、各濃度におけるカスパーゼ陽性細胞の割合(2ウェルの平均)を示しています。ストウロスポリンとカンプトテシンは最大毒性に達し、典型的な用量反応曲線を示したため、Matrigel 埋め込み HCT 116 細胞に対する IC₅₀ を算出可能でした。ストウロスポリンの IC₅₀ は 6 nM であり、カンプトテシン(IC₅₀ = 80 nM)より約10倍高い毒性を示しました。5-フルオロウラシルは効果が弱く、最大濃度(3.75 µM)付近で50%の毒性が見られたものの、IC₅₀ の算出は信頼性に欠けると考えられます。このような弱い効果は、HCT 116 細胞の 3D モデルを用いた過去の研究でも確認されています。
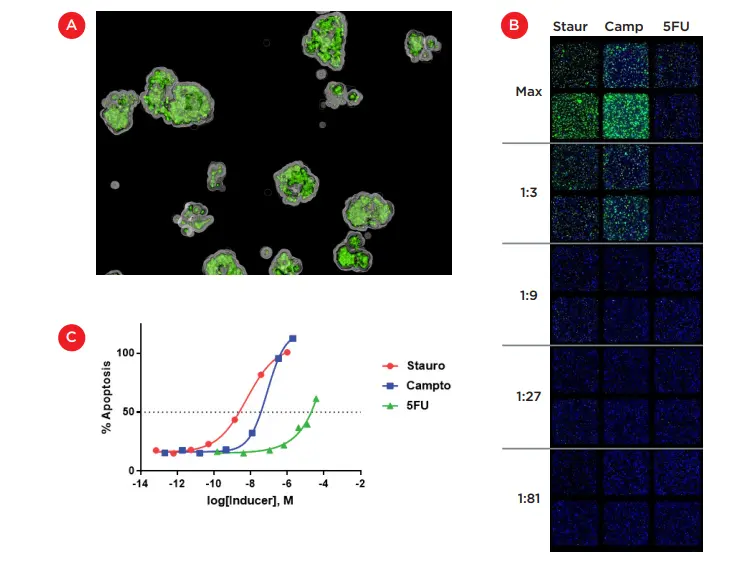
図4. Matrigel 埋込培養におけるアポトーシス誘導 A)ImageXpress Micro Confocal システムで取得した画像。蛍光Caspase-3/7基質で染色された3Dコロニーがアポトーシスマーカーとして示されています。B)ImageXpress Micro Confocal システムを用いて4倍倍率で取得したZスタックの2D投影画像のモンタージュ。スタウロスポリン、カンプトテシン、5-フルオロウラシルの希釈液(上位5段階)で処理した複数のウェルを、細胞核(青)およびアポトーシス(緑)で染色しています。C)各化合物に対するイメージングデータから生成された用量反応曲線。
ディスカッション
Matrigel 培養は多くの研究において非常に有用です。本研究では、3D培養された結腸癌細胞に対するアポトーシス誘導化合物のスクリーニングを実施しましたが、Matrigel は血管新生や神経突起伸長など、3D空間を必要とする他のアッセイにも利用可能です *5。ただし、Matrigel アッセイの活用には多くの課題があります。本研究では、ピペッティング速度と位置の精密な制御、および温度調整を組み合わせることで、これらの課題を自動化によって克服できることを示しました。たとえば、自動化によりアッセイを384ウェルフォーマットに小型化でき、Matrigel 使用量を96ウェルフォーマットや手動プレーティングと比較して50%削減できたことで、コスト削減につながりました。この小型フォーマットでは染色試薬の使用量も少なくて済み、96ウェルプレート全体を撮像するために複数視野が必要となる場合と比べて、共焦点イメージングの速度も向上します。
Biomek ワークステーションの柔軟性により、多様なワークフローやスループットに対応可能です。今回の実験では、Matrigel アッセイプレートの加温を単一のペルチェ位置で行いましたが、複数プレートを同時に処理する必要がある場合は、ペルチェの追加やインキュベーターの統合も可能です。高スループットアプリケーションには、プレートおよびチップのストレージや、SpectraMax i3x プレートリーダーと MiniMax サイトメーター、ImageXpress Micro Confocal システムなどの解析装置の統合が有効です。
本研究中に得られた追加の知見も考慮すべきです。まず、Matrigel プレーティング中に気泡は発生しませんでしたが、ゲル化の過程でウェルの縁に小さな気泡が形成されました。これはプレートの特性によるもので、Matrigel を使用しない PBS 添加時にも同様の遅延気泡形成が見られました。いずれにせよ、自動プレーティングでは手動培養よりも一貫して気泡が少なく、384ウェルプレートにアクセスするための細いピペットチップを使用していても同様でした。
埋込培養をプレーティングする際、一部の細胞はゲル化前にウェル底に沈降し、スプレッド形態を示す単層培養のような挙動を示すことがあります。理想的には、まず Matrigel の層をプレートし、その後に細胞を含む Matrigel を追加する方法が考えられますが、この方法ではウェルを完全に覆うために必要な最小量が増えるため、Matrigel の使用量が約2倍となりコストが増加します。
2D 細胞の割合を減らす方法として、ペルチェ位置でアッセイプレートを予熱し、ゲル化を加速する方法があります。これにより、384ウェル全体ではなく列単位でプレーティングする場合のプレート内差異も最小化できます。ただし、この方法ではウェル縁の気泡がやや増加する傾向がありました。これらの気泡は、XTT アッセイのようなウェルレベルのアッセイには影響しない可能性が高いですが、高倍率での画像解析には干渉する可能性があります。染色細胞数を総細胞数で正規化することでこの影響を軽減できますが、ImageXpress Confocal システムで Z スタックを取得することで、Matrigel ウェル全体を撮像でき、気泡による誤判定の可能性を大幅に低減できます。さらに、Z スタック機能の大きな利点は、取得開始高さを制御できる点です。取得をウェル底より上から開始することで、2D 細胞からのシグナルを除外し、3D 細胞のみを解析対象とすることが可能です。
Matrigel 中の細胞をイメージングする際のもう一つの課題は、染色試薬によっては高いバックグラウンドや長時間のインキュベーションが必要となる点です。これは予想されたことであり、多くのプロトコールでは細胞の固定、ウェルのブロッキング、染色後の洗浄が推奨されています。本研究では、NucBlue 核染色試薬を用いて長時間インキュベーションで生細胞を染色できたため、化合物処理時に同時添加しました。また、Caspase-3/7試薬は他のLive/Dead試薬と比較してバックグラウンドが少ないことが判明しました(データ未掲載)。これは、この試薬が酵素的に切断されて初めて蛍光を発するため、Matrigel に結合してもバックグラウンドシグナルが発生しにくいことが理由と考えられます。
Matrigel は3D 培養を研究するための一手法に過ぎませんが、本研究ではこの方法を用いて、2D 培養よりも生理学的に関連性の高い系で癌細胞のアポトーシス誘導剤に対する感受性を測定できることを示しました。培養、処理、染色の自動化により、作業時間と試薬コストを削減しつつ、この温度感受性試薬の課題を克服し、安定した細胞増殖と測定可能な用量反応曲線の取得を実現しました。
参考文献
- Kim YJ, et. al. (2009). Three-dimensional gastric cancer cell culture using nanofiber scaffold for chemosensitivity test. Int J Biol Macromol. 45(1):65-71.
- Baker BM and Chen CS. (2012). Deconstructing the third dimension: how 3D culture microenvironments alter cellular cues. J Cell Sci. 125(Pt 13):3015-24.
- Chen J, et. al. (2016). C-reactive protein can upregulate VEGF expression to promote ADSC-induced angiogenesis by activating HIF-1α via CD64/PI3k/Akt and MAPK/ERK signaling pathways. Stem Cell Res Ther. 7(1):114.
- Mou Y, et. al. (2016). OCT4 Remodels the Phenotype and Promotes Angiogenesis of HUVECs by Changing the Gene Expression Profile. Int J Med Sci. 13(5):386-94.
- Semina E, et. al. (2016). Urokinase and urokinase receptor participate in regulation of neuronal migration, axon growth and branching. Eur J Cell Biol. 95(9):295-310.
PDF版(英語)