Application Note FLIPR Tetraシステムを用いた
FLIPRカリウムチャネル測定キットによる
hERGチャネル遮断薬の特性評価
- 細胞ベースアッセイによるK⁺チャネル活性の機能的測定
- 洗浄不要の均一プロトコールによりウェル間のばらつきを低減しワークフローを簡素化
- 非均一アッセイと比較してシグナルウィンドウが拡大
PDF版(英語)
はじめに
ヒトのether-à-go-go関連遺伝子(hERG)イオンチャネルの薬剤誘導性阻害は、致死性の心室性頻拍性不整脈であるトルサード・ド・ポワントの発症リスクと関連しています。近年、hERGに対するオフターゲット効果が原因で、FDA承認済みの複数の医薬品が市場から撤退しました。そのため、創薬プロセスの初期段階でhERGチャネルを遮断する化合物を特定するニーズが高まっています。本稿では、FLIPR® Tetraシステム上で使用する新しいFLIPRカリウムチャネル測定キットの有用性を紹介し、hERG関連化合物の活性を評価します。このアッセイでは、カリウム(K⁺)チャネルに対するタリウム(Tl⁺)の透過性を利用し、蛍光指示薬により検出します。7種類の既知のhERG遮断薬を細胞ベースアッセイで評価し、その結果をIonWorks Barracuda® Plus 自動パッチクランプシステムで得られた値と比較しました。
材料と方法
FLIPR®カリウムチャネル測定キット(図1)は、タリウム感受性の蛍光指示薬を含んでいます。初期の染料ロードステップでは、Tl⁺指示薬がアセトキシメチル(AM)エステル型として細胞膜を通過し、受動拡散によって細胞内に取り込まれます。細胞質内のエステラーゼがAMエステルを切断し、活性型の蛍光性形態に変換します。さらに、背景蛍光を低減するために、専用のマスキング染料が細胞外に適用されます。カリウムチャネルを活性化するために、細胞はK⁺とTl⁺の混合液、またはTl⁺存在下でリガンドにより刺激されます。蛍光シグナルの増加は、カリウムチャネルを介して細胞内に流入したTl⁺を示しており、カリウムチャネル活性の機能的測定となります。FLIPRカリウムチャネル測定キット(モレキュラーデバイス製、製品番号:R8222)には、Tl⁺感受性染料、均一操作用マスキング染料、200 mM K₂SO₄、50 mM Tl₂SO₄、5倍濃度の塩化物非含有バッファー、HBSS + 20 mM HEPESバッファーが含まれています。96ウェル、384ウェル、1536ウェルプレートに対応し、最大10枚まで使用可能です。アッセイのワークフローは図2に示されています。
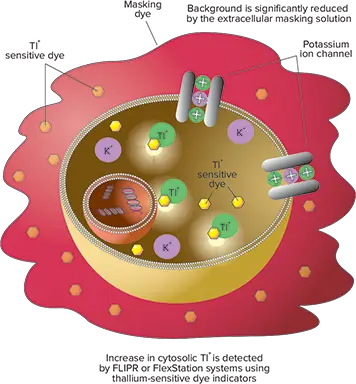
図1:FLIPRカリウムチャネル測定キットの原理

図2:FLIPR TetraシステムにおけるFLIPRカリウムチャネル測定キットのワークフロー
化合物の調製
化合物の疎水性は、非特異的な器具への吸着を介して見かけのポテンシー値に影響を与える可能性があります。本研究では、化合物をまず100% DMSOで希釈し、アッセイ直前にHBSS + 20 mM HEPESバッファーへ混合転送し、ガラスライニングされたポリプロピレンプレートに分注しました。
実験手順
ヒトKv11.1(hERG)イオンチャネルを安定的に発現するチャイニーズハムスター卵巣(CHO)細胞は、ChanTest社(米国オハイオ州クリーブランド)より提供されました。細胞はアッセイの2日前に、選択抗生物質を含む培養液で、384ウェルの黒壁・透明底プレートに1ウェルあたり6,500個で播種され、37°C、5% CO₂で培養されました。アッセイの24時間前に、培養液をテトラサイクリン含有の誘導培地に交換し、アッセイの4時間前に温度を37°Cから28°Cに変更して、hERGチャネルの膜発現を促進しました。プレートは室温・暗所で1時間染料とインキュベートされました。
hERGチャネルの薬理学的解析では、遮断化合物を最初に添加し、室温で30分間インキュベートします。あらかじめ最適化された刺激バッファーを、FLIPR Tetraシステムによる検出中にウェルに添加します。励起には470–495 nmのLED、蛍光の検出には515–575 nmのエミッションフィルターを使用します。比較のため、FluxORアッセイキット(Life Technologies)を用いた並行実験も実施しました。このキットの使用にあたっては、メーカーのプロトコールに従いました。データは約140秒間、1秒間隔で取得され、GraphPad Prismにエクスポートして解析を行いました。
アッセイ開発では、hERGチャネルを刺激するために必要な最適なタリウムおよびカリウム濃度を決定しました。K₂SO₄およびTl₂SO₄の各種濃度を含む刺激バッファーを用いてプレートをセットアップしました。Tl⁺およびK⁺バッファーは、1X塩化物非含有バッファーで希釈されました。タリウム硫酸塩およびカリウム硫酸塩は、1モルあたり2価の陽イオンを持つため、それぞれの濃度は2倍として扱われます。FLIPR Tetraシステムによる検出中に刺激バッファーを細胞に添加し、濃度の組み合わせごとにシグナルトレースを比較して、最大のシグナルを得られる最適濃度を決定しました。hERGに対して最大シグナルを示した最適な最終濃度は、Tl⁺が1 mM、K⁺が10 mMでした(図3)。
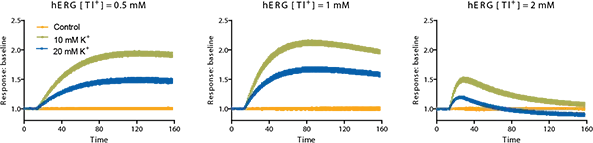
図3:hERGチャネル刺激剤の最適化 細胞に色素を添加してインキュベートした後、FLIPR Tetraシステムによる検出中に刺激バッファーを添加しました。シグナルの濃度依存的な応答をさまざまな条件下で評価した結果、塩化物を含まないバッファーに1 mMのTl⁺および10 mMのK⁺(最終濃度)を含む刺激バッファーを用いることで、最適なシグナルが得られました。
電気生理学的解析
比較のため、同一のhERGチャネル遮断薬セットについて、IonWorks Barracudaシステム 1(図4)を用いてIC₅₀値を取得しました。化合物の周波数依存的な影響を評価するため、電圧プロトコールを化合物添加の前後に0.1 Hzで5回適用しました。5回目のスイープにおけるhERGテール電流のピーク振幅を用いて、化合物の効果を測定しました。
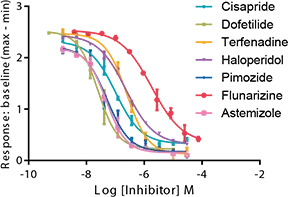
図4:IonWorks Barracudaシステムによる電気生理学的アッセイ 化合物は最終アッセイ濃度の3倍濃度で1% DMSO中に添加され、ウェル内のバッファーと混合することで、最終濃度1倍、DMSO濃度0.33%となるように調整されました。化合物は5分間インキュベートされ、その後、+40 mVで1秒間の刺激を加え、続いて-50 mVへの1秒間のステップを適用してピークテール電流を測定しました。
結果
FLIPRカリウムチャネル測定キットを用いて、7種類の既知のhERG遮断薬を評価しました。濃度依存的な応答曲線は図5に示されています。IonWorks Barracudaシステムで得られたデータとの比較によるIC₅₀値は表1に示されています。化合物の効力の順位は両アッセイ間で一致しており、IC₅₀値も半対数以内で良好な相関を示しました。
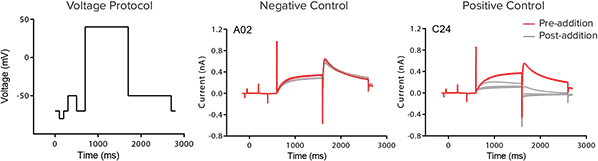
図5:参照化合物によるhERGチャネルの濃度依存的阻害
| 化合物 | ClogP | IC50 (nM) FLIPRテトラシステム |
IC50 (nM) イオンワークスバラクーダシステム |
比率 |
|---|---|---|---|---|
| ドフェチリド | 25 | 1.4 | 15.3 2 |
1.6 |
| アステミゾール | 48 | 6.1 | 62 | 0.8 |
| ピモジド | 6.4 | 51 | 55 | 1.5 |
| シサプリド | 3.7 | 102 | 69 | 0.9 |
| ハロペリドール | 3.8 | 237 | 81 | 2.9 |
| テルフェナジン | 6.5 | 249 | 332 | 0.8 |
| フルナリジン | 5.4 | 1,795 | 1,000 | 1.8 |
表1:FLIPR TetraシステムによるFLIPRカリウムチャネル測定キットと、IonWorks Barracudaシステムによる電気生理学データのIC₅₀値の比較
さらに、3種類の化合物を用いて、他のタリウムベースのアッセイキット「FluxORカリウムイオンチャネルアッセイ」との性能比較を行いました(図6)。両アッセイ間のIC₅₀値は表2に示すように類似していました。ただし、FLIPRカリウムチャネル測定キットによるシグナルウィンドウ(応答とベースラインの比)は2.25であり、FluxORの0.5と比較して有意に高い値を示しました。ネガティブコントロールにはhERGチャネル応答を遮断する4 µMテルフェナジンを使用し、ポジティブコントロールには刺激バッファーに対して最大応答を示すバッファーを使用しました。ウェル間ばらつきの低減とシグナルウィンドウの拡大により、図7に示すようにZ’因子も向上しました。これは、FLIPRカリウムチャネル測定キットが洗浄ステップや培地交換を必要としない真の均一アッセイであることに起因すると考えられます。
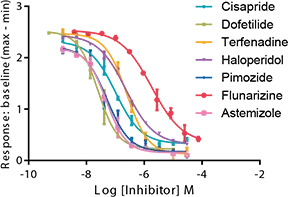
図6:FLIPRカリウムチャネル測定キットと競合キットの結果比較
| 化合物 | IC50 (nM) FLIPRカリウムチャネル測定キット |
IC50 (nM) FLUXOR キット |
|---|---|---|
| アステミゾール | 60 | 34 |
| ピモジド | 51 | 27 |
| テルフェナジン | 121 | 90 |
表2:FLIPRカリウムチャネル測定キットと競合キットのIC₅₀値の比較
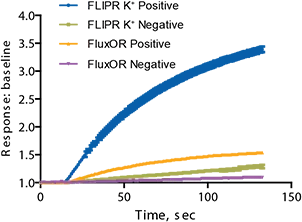
図7:FLIPRカリウムチャネル測定キットと競合キットのシグナルダイナミックレンジの比較 ネガティブコントロール:4 µMテルフェナジン、ポジティブコントロール:バッファー。FLIPRカリウムチャネル測定キットのZ’因子=0.85(n=32)、競合キットのZ’因子=0.64(n=30)
結論
FLIPRカリウムチャネル測定キットは、洗浄不要の均一プロトコールを用いてカリウムチャネルの機能的活性を測定します。本研究では、参照hERG遮断薬を用いて、FLIPR Tetraシステムによる結果が電気生理学的手法で得られたデータと高い相関を示すことを確認しました。
別の実験セットでは、FLIPRカリウムチャネル測定キットが競合製品と比較して有意に広いアッセイウィンドウと高いZ’因子を示しました。アッセイ品質の向上とFLIPR Tetraシステムのハイスループット性能を組み合わせることで、創薬初期段階におけるhERGリスク解析に強力なプラットフォームを提供します。
モレキュラーデバイスの以下のシステムと互換性があります。

参考文献
- Karen Cook, James L. Costantin, and Xin Jiang, Validation of the IonWorks Barracuda System for hERG Ion Channel Assay, Application Note, 2011.
- D. Rampe, et al, A mechanism for the proarrhythmic effects of cisapride (Propulsid): high affinity blockade of the human cardiac potassium channel HERG, FEBS Letters 1997; 417(1): 28-32.
PDF版(英語)