Application Note FLIPRカルシウムアッセイキットによる細胞内カルシウム測定の比較
- 混合&測定アッセイ形式により、色素のローディングや洗浄手順に伴う細胞の剥離やカルシウムシグナル応答の低下を低減
- 複数のフォーマットでリアルタイムカイネティックセルベースアッセイに対応
- 使いやすいScreenWorksソフトウェアでアッセイパラメーターを簡単に設定
PDF版(英語)
イントロダクション
Gタンパク質共役型受容体(GPCRs)は、細胞シグナリングにおいて重要な役割を果たしています(図1)。受容体がリガンドによって活性化されると、受容体のコンフォメーションが変化し、細胞内でGタンパク質の活性化が引き起こされます。活性化されたGタンパク質は、カルシウムを含む様々な細胞内メッセンジャーのカスケードを誘導する可能性があります。FLIPR®システムはハイスループットで機能的な細胞ベースアッセイを行うことができ、蛍光カルシウム感受性レポーター色素を用いて検出される細胞内カルシウムの変化を評価する創薬に最適なシステムです。本アプリケーションノートでは、FLIPRカルシウム測定キットを用いたカルシウム動員アッセイの基本的なプロトコールについて説明します。FLIPR Tetra®システムを用いた均一性、迅速性、信頼性の高い蛍光アッセイです。FLIPR Tetraシステムを用いて、Rat Muscarinic Receptor (M1)をトランスフェクトしたCHO M1WT3細胞におけるカルバコールの用量反応を測定します。96ウェルおよび384ウェルのマイクロプレートフォーマットのデータを示します。
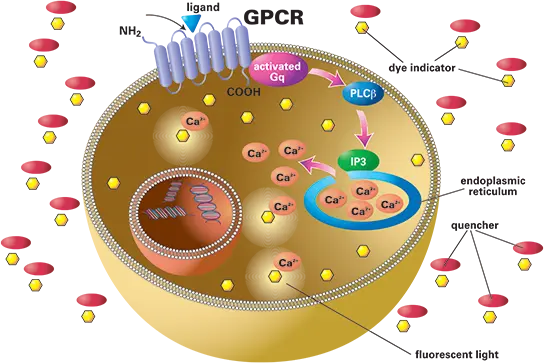
図1. カルシウム動員アッセイの原理。細胞質カルシウムの増加は、カルシウム感受性色素インジケーターを用いた蛍光測定によって検出できます。
材料
- ラットムスカリン(M1)レセプターをトランスフェクトしたCHO M1WT3細胞(American Type Culture Collection)
- 培地 Ham's F12 Media (Irvine Scientific) 10%, Fetal Bovine Serum (Hyclone Cat) 1%, Pen/Strep/Glutamine (Invitrogen), 50 µg/mL Geneticin (Invitrogen).
- カルシウムとマグネシウムを含まないPBS(Invitrogen)
- VERSENE ® 1:5000 (Invitrogen)
- トリプシン-EDTA 1X 溶液(Irvine Scientific)
- 10X Hank's Balanced Salt Solution(HBSS、Invitrogen)
- 滅菌水(Irvine Scientific)
- HEPES (Invitrogen)
- プロベネシド(Sigma)
- FLIPR カルシウム測定キット(モレキュラーデバイス)
- AquaMax ® DW4 Dispenser and Washer(モレキュラーデバイス)
- FLIPR Tetraシステム(モレキュラーデバイス)
方法
細胞の調製
ステップ1:アッセイ用の培養液を調製します。CHO M1WT3細胞を1:30に分割し、培地で週2回培養し、37℃、5% CO2でインキュベートします。
ステップ2:セルプレートを準備します。フラスコ内の細胞単層をカルシウムとマグネシウムを含まないPBSで洗浄します。
ステップ3:フラスコをVERSENE 1:5000(またはTrypsin-EDTA)で37℃、5分間インキュベートし、血清を封じ込めた培養液で軽くすすぎ、フラスコの側面をタッピングして細胞を取り除きます。
ステップ4:細胞を400 x gで5分間遠心します。培地に再懸濁し、数を数えます。黒壁透明底マイクロプレートに細胞を播種し、37℃、5% CO2で一晩培養します。推奨細胞濃度とウェル容量を表1に示します。モレキュラーデバイスのAquaMax DW4を用いて、1536ウェルマイクロプレートに細胞を分注しました。
| プレートサイズ | CHO M1WT3 | 細胞/ウェル容量(µL) | プレートカタログ番号(ブラックウォール、クリアボトム、TC、滅菌済み) |
|---|---|---|---|
| 96-Well | 50,000 | 100 | 3904(コーニング) |
| 384-Well | 12,500 | 25 | 3702(コーニング) |
| 1536-Well Low Base | 2,000 | 4 | 783092 (Greiner) |
表 1. FLIPR Tetraシステムを用いたFLIPRカルシウム測定キットのプレーティングフォーマットと細胞数。
細胞内カルシウム濃度の変化を観察するためには、細胞にカルシウム感受性の蛍光色素を負荷する必要があります。モレキュラーデバイスのFLIPRカルシウム測定キットは、シンプルで信頼性の高い「混合&測定」形式を採用しているため、色素のロードや洗浄の手順で起こりがちな細胞の剥離やカルシウムシグナルの減弱を大幅に低減または完全に排除することができます。取り込まれなかった細胞外色素からの蛍光シグナルは、特許取得済みのクエンチベース技術(QBT™)により減衰し、高いSB比が得られます。
FLIPR カルシウム測定キットのプロトコール
ステップ1:100 mL の 10X HBSS を 880 mL の注射用滅菌水で希釈し、ローディングバッファーの調製を開始します。
ステップ2:20 mLの1M HEPESを加えます。最終濃度は20 mMです。
ステップ 3:250 mM のプロベネシド(PBC)ストック溶液を 5 mL の 1N NaOH と 5 mL のローディングバッファーで調製します。
ステップ 4:96-well および 384-well アッセイでは、ローディングバッファー 98mL に 250mM PBC 2mL を加え、ローディングバッファー + 5mM PBC を調製します。1536ウェルアッセイでは、67mLのローディングバッファーに2.01mLのPBCを加え、ローディングバッファー+7.5mM PBCを調製します。
ステップ 5:pH を 7.4 に調整します。
ステップ6:色素ローディングバッファーを調製するために、ステップ4および5で調製したPBC入りローディングバッファーにバルクキットバイアル1本分を完全に溶解します。10mLのPBC入りローディングバッファーでボルテックスし、まずバイアル内の色素を溶かします。
ステップ7:セルプレートをインキュベーターから取り出し、各ウェルに適切な量のDye Loading Bufferを加えます。推奨量は表2をご参照ください。
注:1536ウェルマイクロプレート用のDye Loading Bufferは、AquaMax DW4 Systemまたは同等品を用いてマイクロプレートに添加します。
| プレートサイズ | ウェルあたりの細胞培養量(µL) | 染料ローディングバッファー量 配合量(mL)キットバイアルあたり | ウェルあたりの染料ローディングバッファー量(µL) |
|---|---|---|---|
| 96-Well | 100 | 100 | 100 |
| 384-Well | 25 | 100 | 25 |
| 1536-Well Low Base | 4 | 69 | 2 |
表 2. 推奨カルシウム測定キット希釈容量。
ステップ 8:プレートを 5%CO2、37℃で 1 時間、その後室温で 10 分間インキュベートします。
注:アッセイ前にプレーティングは行いません。
ステップ9:インキュベーション後、プレートを直接FLIPR Tetra Systemに移し、カルシウム動員アッセイを開始します。色素調製、セルおよび実験パラメータに関する詳細は、FLIPRカルシウムアッセイキット製品添付文書を参照するか、モレキュラーデバイスまでお問い合わせください。
化合物プレートの調製
細胞内カルシウム測定は、急速に変化する細胞のカイネティクスを可視化するため、迅速に行う必要があります。最適なピペッターの容量、高さ、速度はFLIPR Tetraシステムで簡単に設定できます。細胞単層を乱すことなくリガンドを細胞に供給するため、液量は最終液量の約10-30%が添加されるように調整します。リガンド濃度はそれに応じて調整する。この実験では、96ウェルおよび384ウェルフォーマットでは20%、1536ウェルフォーマットでは14.3%のリガンドを添加します。
注意:溶解にDMSOを必要とするスクリーニング化合物は、アッセイ中の最終濃度が1%以下になるように希釈することを推奨します。
FLIPR Tetraシステムの設定
FLIPRシステムの機能をベースに、FLIPR Tetraシステムのピペットヘッドはユーザーが簡単に交換できるようになりました。使い捨てのピペットチップを使用する96ヘッドと384ヘッドとは対照的に、1536ウェルの液体移送は、ステンレス製カニューレチップブロックとモレキュラーデバイスの新しいエラストマー技術を組み合わせたピペッターヘッドで行われます。ScreenWorks® ソフトウェアはユーザーフレンドリーなインターフェースで、アッセイパラメーターを簡単に設定できます。推奨されるインストゥルメンテーション、設定、アッセイパラメーターの詳細については、『 FLIPR Tetraシステムユーザーガイド』を参照してください。アッセイ容量、高さ、速度は、ウェル底から細胞が外れることなく最適な混合が得られるよう、細胞の種類ごとに実験的に決定されます。CHO M1WT3細胞で使用した推奨設定は表3をご参照ください。
| プレートサイズ | 384-Well | 96-Well | 1536-Well |
|---|---|---|---|
| 励起波長(nm) | 470-495 | 470-495 | 470-495 |
| LED 強度 (%) | 80 | 80 | 80 |
| LED 強度 (%) | 515-575 | 515-575 | 515-575 |
| カメラゲイン | 80 | 80 | 80 |
| 露出(秒) | 0.4 | 0.4 | 0.4 |
| インターバル(秒) | 1 | 1 | 1 |
| 分注量(µL) | 50 | 12.5 | 1 |
| ディスペンス高さ (µL) | 180 | 40 | 2 |
| ディスペンス速度(µL/秒) | 50 | 35 | 6 |
| チップ上昇速度(mm/秒) | 10 | 10 | 10 |
| ウェル内のチップ | No | No | No |
表3. FLIPRカルシウム測定キットのFLIPR Tetraシステムパラメータ。
結果
アッセイ開始時(すなわち、化合物添加前)に、色素負荷細胞の基底蛍光を確認するために「シグナリングテスト」を実施します。細胞の基底蛍光シグナルは 200~1500RFU が最適です。詳しくはFLIPR Tetraシステムユーザーガイドの「シグナルテストの実行」のセクションを参照してください。FLIPR TetraシステムとFLIPRカルシウム測定キットを用いて、カルバコールによるカルシウム動員によって誘発される相対光単位の変化を測定します。
図2は、FLIPR TetraシステムでFLIPRカルシウムアッセイキットを用いて作成した3種類のフォーマットにおけるカルバコール用量反応曲線を示しています。96ウェルおよび1536ウェルマイクロプレートアッセイのEC50は、それぞれ17.9 nMおよび18.0 nMでした。384ウェルマイクロプレートアッセイのEC50は14 nMでした。
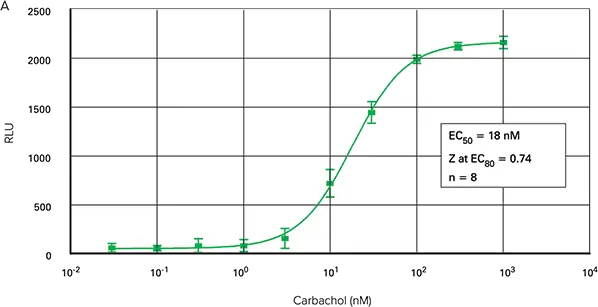
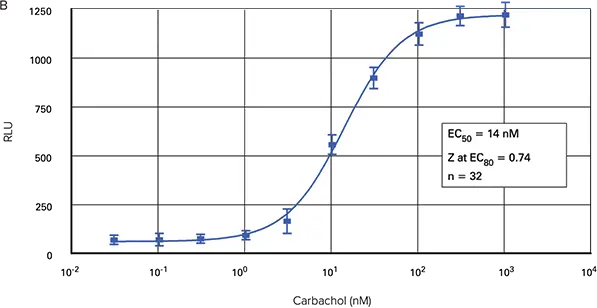
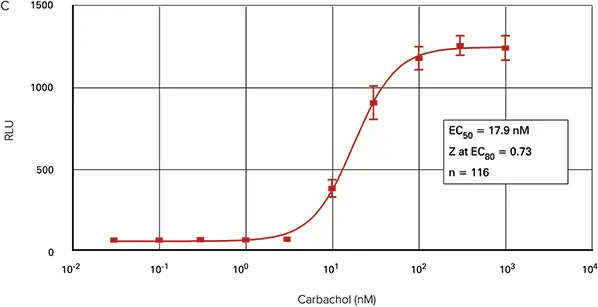
図2. カルバコール用量反応曲線。FLIPR TetraシステムのFLIPRカルシウム測定キットを用いて、96ウェル(A)、384ウェル(B)および1536ウェル(C)のマイクロプレートにプレーティングしたCHO M1WT3細胞におけるカルバコール誘発カルシウム動員。
蛍光シグナルの最大振幅は96ウェルマイクロプレートで最も大きかったです。384ウェルプレートと1536ウェルプレートからの蛍光シグナルは非常に類似していました。
EC80のZ値は、3種類のマイクロプレートとも0.70以上でした。384ウェルでのカルバコールに対する蛍光シグナルのシグナルトレースを図3に示します。
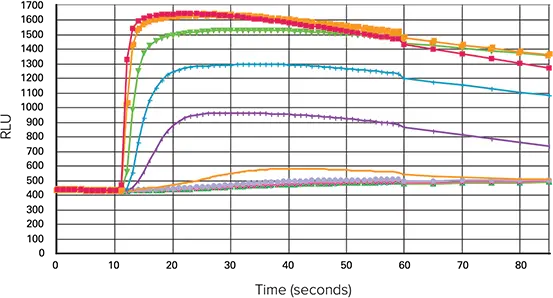
図3. 384ウェルマイクロプレートにおけるカルバチョールの平均トレース。カルバコールによって刺激されたカルシウム動員アッセイの平均ウェルトレース(FLIPR Tetraシステムで作成)。
結論
FLIPR Tetraシステムは、96ウェル、384ウェル、1536ウェルフォーマットのリアルタイムカイネティックセルベースアッセイに対応するスクリーニングプラットフォームを提供します。FLIPR Tetraシステムのマイクロプレートプラットフォームを選択しても、本試験で得られたEC50およびZ値から明らかなように、同等の結果が得られます。
PDF版(英語)