Application Note FlexStation 3プレートリーダーとFLIPR Tetraシステムの
Photina発光カルシウム動員アッセイの比較
- 創薬プロセスにおけるリード化合物の早期同定のための柔軟な中・高スループットソリューション
- FlexStation 3 プレートリーダーは蛍光および発光アッセイのリアルタイム測定を可能にします
- FLIPR Tetraシステム(イクオリンオプション、ICCDカメラ付き)は、蛍光・発光アッセイに最適化されています
PDF版(英語)
はじめに
Gタンパク質共役受容体(GPCR)は創薬研究において最も重要な治療ターゲットの一つです。GPCRは細胞膜に局在するタンパク質で、細胞シグナル伝達において重要な役割を果たしています。受容体がリガンドによって活性化されると、受容体の構造が変化し、細胞内のGタンパク質が活性化されます。活性化したGタンパク質は、カルシウムを含むさまざまな細胞内伝達物質の連鎖反応を引き起こす可能性があります。
カルシウム活性化発光タンパク質は、哺乳類細胞におけるカルシウムの動員を伴う受容体を介したシグナル伝達イベントを検出するための重要なツールです。発光タンパク質の大きな利点のひとつは、カルシウムがコエレテラジン-光タンパク質複合体に結合すると、即座にフラッシュ発光を示すことです。イクオリン測定のバックグラウンドシグナルはゼロに近く、高いシグナル/バックグラウンド比が得られます。さらに、コエレテラジンの酸化によって放出される光は、光励起に依存しないため、自家蛍光の問題がありません。
現在では発光タンパク質発現細胞株の商業的供給源が数多くあり、この技術がより広く利用できるようになっています。これらのアッセイ法は文献1や米国特許6,872,538号、欧州特許1,145,002号にも記載されています。特許された方法にご興味のある方は、これらの特許を評価する際に法律顧問に相談されることをお勧めします。
モレキュラーデバイス FlexStation® 3 マルチモードマイクロプレートリーダーは、蛍光および発光性の細胞ベースのアッセイをリアルタイムで測定できる統合流体制御を内蔵しています。最大8ウェル(96ウェルフォーマット)または16ウェル(384ウェルフォーマット)のウェルを、化合物添加前、添加中、添加後に同時にモニターすることができます。アッセイは、ユーザー定義のディスペンス高さ、化合物添加速度、試薬源の位置、および各添加のチップ選択により、簡単に最適化できます。使い捨てのピペットチップを使用することで、添加と実験間のクロスコンタミネーションの機会を減らし、(インジェクターと比較して)プレートのデッドボリュームを減少させ、貴重な試薬を節約します。
モレキュラーデバイスのFLIPR Tetra®システムは、GPCRおよびイオンチャネルの活性をモニタリングするための市場をリードする装置であり、創薬プロセスにおいてリード化合物を早期に同定するための信頼性と柔軟性に優れたHTS/uHTSソリューションです。FLIPR Tetraシステムには、蛍光と発光の両方のアッセイに最適化された新しいICCDカメラ技術を搭載したaequorinオプションが加わりました。さらに、細胞浮遊システムにより、96ウェル、384ウェル、1536ウェルフォーマットの接着細胞および浮遊細胞ベースのアッセイに対応します。
このアプリケーションノートでは、FlexStation 3 プレートリーダーとICCDカメラ付きFLIPR Tetraシステムを用いた付着性イクオリンアッセイを実施するための基本プロトコルを示します。両装置を使用して、CHO mito-Photina/H3 細胞における IMETIT の濃度反応を様々な細胞濃度で測定しました。
材料
- CHO mito-Photina/H3細胞(Axxam SpA)。H3細胞株は、CHO-K1細胞に、ミトコンドリア膜を標的としたキメラ光タンパク質であるPhotina、Ga16、およびヒスタミンH3遺伝子を安定的にトランスフェクトすることにより作製。
- 培地 15mMのHEPES、1.35mMのピルビン酸ナトリウム、10%のFBS、1%のペニシリン/ストレプトマイシン、500μg/mLのGeneticin、および1%のL-グルタミンを添加したダルベッコのMEM/Nutrient Mix F12、すべてInvitrogenより。
- カルシウムとマグネシウムを含まないPBS(Invitrogen)
- VERSENE 1:5000(Invitrogen)
- DMSO(Sigma)および1mMグルタチオン(Sigma)で希釈した11mMのネイティブコエンテラジン(PharmaTech Int. )ストック溶液。
- アッセイバッファー フェノールレッドを含まないDMEM/HAM's F12(Invitrogen)と15mM HEPES(Invitrogen)および0.1% BSA(Sigma)。
- ヒスタミンH3アゴニスト:IMETIT(Sigma)
- 384ウェル黒壁透明底マイクロプレート (Corning)
- ICCDカメラオプション付きFLIPR Tetraシステム(モレキュラーデバイス)
-
FlexStation 3 マルチモードマイクロプレートリーダー(モレキュラーデバイス)
測定方法
アッセイプレートの調製
アッセイプレートを作成するために、CHO mito-Photina/ H3 細胞を VERSENE を用いて回収し、選択抗生物質無添加の培地に再懸濁し、384 ウェル、ブラックウォール、クリアボトムプレートに 25 µL の細胞濃度(625, 1250, 2500, 5000 cells/well)でプレーティングし、5% CO2、37℃で一晩インキュベートしました。
アッセイプレートをインキュベーターから取り出し、培地を除去し、5μMのネイティブコエンテラジンを含む25μLのアッセイバッファーと交換しました。コエリンテラジンを添加したプレートを、暗所で5時間、室温でインキュベートしました。
化合物プレートの調製
ポリプロピレン製 384 ウェルプレートを用いて、H3- ヒスタミン受容体アゴニストである IMETIT の 2 倍濃度系列をアッセイバッファー中で調製しました。
装置のセットアップとデータ解析
コエレテラジンとのインキュベーション後、アッセイプレートをFlexStation 3 プレートリーダーまたはFLIPR Tetraシステムにセットした。プロトコールは、SoftMax® Pro ソフトウェア(FlexStation 3)または ScreenWorks® ソフトウェア(FLIPR Tetra)で、それぞれ表1および表2に示すパラメーターを用いて作成しました。
| Parameter | Setting |
|---|---|
| Read Type | Flex |
| Read Mode | Luminescence, Bottom Read |
| Wavelengths | All |
| Run Time | 90 Sec. Total |
| Interval | 1.14 sec |
| Autocalibrate | On |
| Assay Plate Type | 384 W Corning Clear/Flatbottom |
| Compound Source | Greiner Polypropylene V Base (384-Well) |
| Compound Addition | |
| Initial Volume | 25 µL |
| Pipette Height | 20 µL |
| Volume | 25 µL |
| Rate | 8 (31 µL/sec) |
| Time Point | 21 sec |
表1. FlexStation 3 プレートリーダー: Photina assay setup parameters.
| Parameter | Setting |
|---|---|
| Reading Mode | Luminescence |
| Excitation/Emission | None/None |
| Camera Gain | 140000 |
| Gate Open | 100% |
| Exposure Time | 0.4 sec |
| Read Interval | 1 sec |
| Dispense Volume | 25 µL |
| Dispense Height | 10 µL |
| Dispense Speed | 50 µL/sec |
| Removal Speed | 10 mm/sec |
| Expel Volume | 0 µL |
表2. FLIPR Tetraシステム(ICCDカメラオプション付き): Photina assay setup parameters.
ルミネッセンス測定値は、ベースライン測定値を得るため に15秒間測定され、その後、装置に搭載された流体制御システム を用いて、異なる濃度の特異的リガンド(IMETIT)を分注し、ルミネッセンスの変化を同時にモニターしました。平均RLU(max-min)、標準偏差、EC50、EC80におけるZ factorの計算、および濃度応答曲線のグラフ化はすべて、SoftMax Proソフトウェアを用いて行いました。FlexStation 3 プレートリーダー用の事前設定済みイクオリンアッセイプロトコルは、 SoftMax Proソフトウェアで入手できます。
結果
CHO mito-Photina/H3トランスフェクト細胞におけるIMETIT刺激カルシウムフラックスは、フラッシュ発光を用いてモニターすることができます。発光シグナルは、FlexStation 3 プレートリーダーと FLIPR Tetra システムの両方で、アッセイ中の時間に対する相対発光単位 (RLU)として測定されます。平均RLU(max-min)をIMETIT濃度に対してプロットし、濃度反応曲線(図1、FlexStation 3プレートリーダーのデータ;図2、FLIPR Tetra システムのデータ)を作成し、EC50値を算出しました。
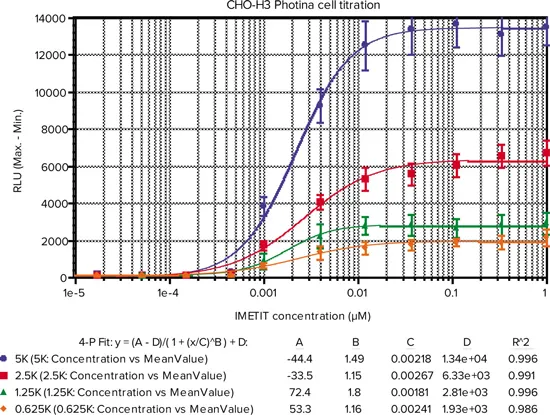
図1. FlexStation 3 プレートリーダーで測定したアゴニスト反応。CHO mito-Photina/H3細胞を、選択抗生物質無添加の384ウェル黒色壁透明底プレートに、細胞濃度を変えて(5000(●)、2500(■)、1250(▲)、625(♦)細胞/ウェル)プレーティングし、5% CO2中37℃で一晩インキュベートしました。培地を除去し、細胞を5μMのネイティブ・コエレ ンテラジンを含む25μL緩衝液中で5時間、暗所、室温で インキュベートしました。FlexStation 3 プレートリーダーは、表1の設定に従い、リアルタイム 発光検出中にアゴニストを添加しました。結果は約16反復の平均です。
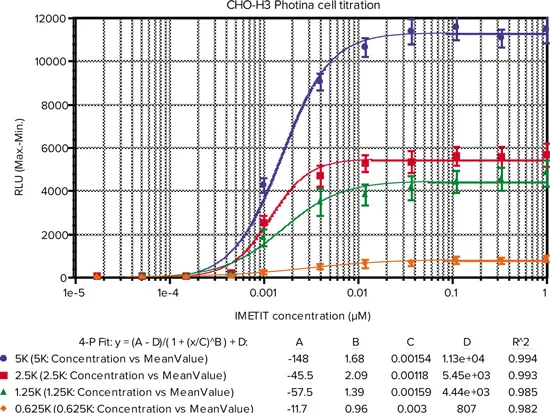
図2. ICCDカメラオプション付きFLIPR Tetraシステムで測定したアゴニスト反応。図1に記載のCHO mito-Photina/H3 cell assay(5000(●)、2500(■)、1250(▲)、625(♦)細胞/ウェル)。ICCDカメラオプション付きFLIPR Tetraシステムは、表2の設定に従い、発光読み取りモード中にアゴニストを添加しました。結果は約32反復の平均値です。
IMETIT EC50およびEC80におけるZ-factorを表3および表4にまとめた。FlexStation 3マイクロプレートリーダーを用いたIMETITの EC50値あ1.81~2.67 nMであったのに対し、FLIPR Tetraシステム(ICCDカメラオプション付) ではEC50値は1.18~3.00 nMでした。どちらの結果も、公表されているEC50値3.43 nMに近いです。EC80におけるZ factor値も両装置間で同等でした。
| 細胞数/ウェル |
EC50 IMETIT (nM) |
Z factor at EC80 |
|---|---|---|
| 5000 | 2.18 | 0.68 |
| 2500 | 2.67 | 0.63 |
| 1250 | 1.81 | 0.54 |
| 625 | 2.41 | 0.43 |
表3. FlexStation 3プレートリーダーを用いたフォティナ固着アッセイ結果のサマリー。
| 細胞数/ウェル |
EC50 IMETIT (nM) |
Z factor at EC80 |
|---|---|---|
| 5000 | 1.54 | 0.86 |
| 2500 | 1.18 | 0.67 |
| 1250 | 1.59 | 0.58 |
| 625 | 3.00 | 0.35 |
表4. ICCDカメラオプション付きFLIPR TetraシステムによるPhotina接着アッセイ結果のサマリー。
結論
FlexStation 3 プレートリーダーとFLIPR Tetraシステム(イクオリンオプ ション(ICCDカメラ)付き)を用いて、フォティナ接着 発光細胞アッセイを測定しました。FlexStation 3 プレートリーダーとFLIPR Tetraシステム(ICCDカメラオプション付き)のいずれを用いても、接着発光アッセイ用のフォティナ細胞の調製法と処理法は同じです。このことは、得られるデータの相関性 とともに、低スループットのフォティナアッセイにFlexStation 3 プレートリーダーを使用することをサポートします。さらに、この装置はハイスループットのスクリーニングを目的としたFLIPR Tetraシステムに簡単に移行できるアッセイ法の開発にも使用できます。
謝辞
本研究のためにフォティナ細胞株を提供してくれたAxxam社に感謝するとともに、データを快くレビューしてくれたAxxam社のSabrina Corazza氏とSilvia Bovolenta氏に感謝します。また、FLIPR Tetra システム アッセイを手伝ってくれたLaurence Monnet、Maki Kato、Kristin Prasauckas、Irina Osetinsky、Kasia Paczynaに感謝します。
参考文献
- Boie, et al., Eur J Pharmacol 340(2-3):227-241 (1997).
FlexStation 3マルチモードマイクロプレートリーダーについてさらに詳しく >>
PDF版(英語)