Application Note 蛍光ラベル不要:
自動イメージングによる細胞カウント
- 蛍光染色細胞および非染色細胞のいずれにも対応
- 複数の細胞種やサイズの違いを自動でカウント
- アッセイ実施前にピペッティングの異常や細胞増殖の不均一性を検出
PDF版(英語)
はじめに
Jayne Hesley|イメージングアプリケーションサイエンティスト|モレキュラーデバイス
多検体マイクロプレート内の細胞数を正確に定量できることは、細胞の健康状態や増殖を評価するさまざまな生物学的アプリケーションにおいて重要です。これらのアプリケーションでは、蛍光染色された核をイメージングするエンドポイントアッセイを用いる場合もあれば、非染色の生細胞または固定細胞に対する透過光イメージングの高い再現性が求められる場合もあります。いずれの場合も、ソフトウェアによる細胞のセグメンテーションを通じた細胞数のカウントは、高速かつ信頼性の高いものである必要があります。ImageXpress® Pico 自動細胞イメージングシステムと CellReporterXpress™ 画像取得・解析ソフトウェアは、蛍光染色細胞にもラベルフリー細胞にも対応した細胞定量に最適です。本アプリケーションノートでは、ユーザーが選択可能な透過光セグメンテーション(解析)アルゴリズムが、多様な細胞種のカウント精度をどのように向上させるかを示し、核染色を用いた場合の結果との比較を行います。
方法
本実験では、複数の細胞種を96ウェルプレートに1:2の段階希釈で播種し、一晩培養しました。その後、37°C、5% CO₂のインキュベーター内で、5 µMのHoechstまたはDRAQ5による核染色を30~60分間行いました。プレートは、ImageXpress Pico システムを用いて、4xまたは10xのPlan Fluor対物レンズで1ウェルあたり1視野を撮影しました。蛍光画像と透過光画像は連続して取得され(透過光が先)、細胞数はオンザフライ解析によりカウントされました。オンザフライ解析とは、画像取得と同時に解析を実行する機能です。

細胞に最適な透過光モジュールを選択
CellReporterXpress ソフトウェアには、透過光画像から細胞をカウントするための3種類のモジュールが搭載されています。「Transmitted Light Cell Count, General」モジュールは、過度にコンフルエントでも希薄でもない、CHO、HeLa、PC-12などの単層培養細胞に対して良好に機能します。しかし、図1で示す実験では、細胞を96ウェルプレートに播種する際、完全にコンフルエントな状態から、1ウェルあたり数個の細胞しか存在しない状態まで、さまざまな密度で播種しました。これに対応する透過光モジュールは、最も広い細胞密度範囲において、核染色を用いた定量結果と最もよく一致する細胞数を示しました。HepG2のようにクラスター状に増殖する細胞では、高密度条件下で正確なセグメンテーションが難しい場合があります。そのため、より正確な結果を得るには、「Cell count(細胞数)」ではなく「Area covered(被覆面積)」の測定を使用することが推奨されます。
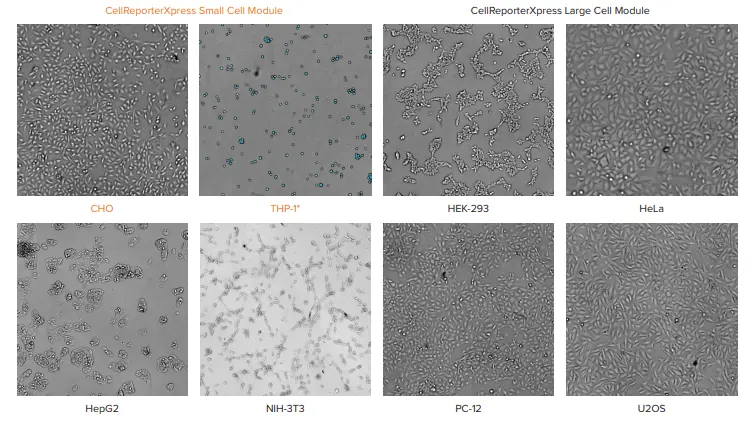
図1. 各種細胞タイプの比較(156~20,000 cells/well)CellReporterXpress ソフトウェアに搭載されたモジュールのうち、透過光画像を最も正確にセグメント化できたものを示しています 透過光画像は、10x対物レンズを使用し、zオフセット -40 µm で取得されました。 *THP-1は浮遊性細胞です。
接着細胞または浮遊細胞のカウント
接着性の単層細胞や浮遊細胞は、細胞サイズに基づいた3種類の透過光(TL)細胞カウント解析プロトコール、または蛍光染色された核を検出する「Cell Count」モジュールを用いて定量することができます(図2および図3)。染色された核と非染色細胞の検出結果を比較したところ、過度にコンフルエントでないウェルにおいては、両者の結果が一貫して一致していることが確認されました(図4)。

図2. HeLa細胞における蛍光画像と透過光画像を用いた細胞カウントの比較 上段の画像は、10x対物レンズで取得した接着性HeLa細胞の蛍光画像(左:青色の核染色)と、その解析マスク(右:オレンジ)を示しています。下段は、同じ領域を透過光で撮影した画像(左)と、その解析によるセグメンテーション結果(右:白)です。核染色によるカウントでは細胞数は1710個、透過光画像によるカウントでは1790個でした。
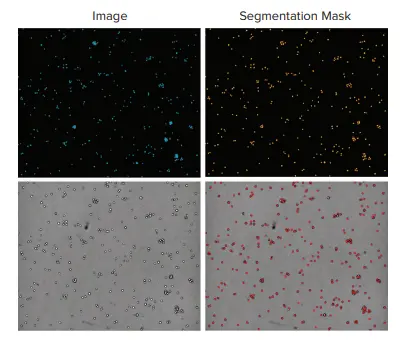
図3. 浮遊性細胞における蛍光画像と透過光画像を用いた細胞カウントの比較 上段の画像は、10x対物レンズで取得したTHP-1白血球の蛍光画像(左:青色の核染色)と、その解析マスク(右:オレンジ)を示しています。下段は、同じ領域を透過光で撮影した画像(左)と、その解析によるセグメンテーション結果(右:赤)です。核染色によるカウントでは細胞数は325個、透過光画像によるカウントでは320個でした。
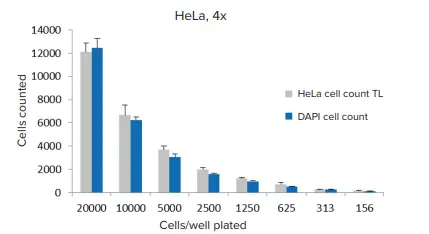
図4. 透過光セグメンテーションとHoechst染色核による細胞定量の比較 4x対物レンズを用いて、1ウェルあたり1画像(n=6 wells)を取得し、CellReporterXpress ソフトウェアのプリセットモジュールを使用して解析を行いました。
プレート全体のサムネイル画像を使用してピペッティングアーティファクトを検出
プレート全体は、低倍率の透過光(または染色されている場合は蛍光)でスキャンすることができます。CellReporterXpress ソフトウェアを使用することで、細胞層の不均一性を示すウェルを視覚的に確認することも、オンザフライで検出することも可能です(図5)。

図5. プレート全体を低倍率でスキャンしてピペッティングアーティファクトを特定(左) Hoechstで核染色した細胞のプレートモンタージュ画像。384ウェルプレートを4倍対物レンズで撮影したモンタージュ画像では、ピペッティングアーティファクトが容易に確認できます。(右)透過光画像(上)はセグメント化が可能で、解析結果(下の緑のマスクオーバーレイ)により、細胞数が均一でないウェルを強調表示できます。
結論
ImageXpress Pico システムは、付属の CellReporterXpress ソフトウェアと組み合わせることで、オンザフライ解析に対応した論理的なワークフローにより、多様なライブセルおよび固定細胞の定量を可能にします。低倍率スキャン法を使用することで、播種の均一性を即座に確認することができます。さらに、化合物処理や試薬添加による細胞密度への影響を観察することで、実験結果の検証精度をさらに高めることができます。
PDF版(英語)