Application Note 細胞毒性評価のためのLive/Deadアッセイ
ImageXpressシステムによる自動化手法
- 細胞生存率を測定するために、効率的なウォッシュ不要の均質アッセイプロトコールを利用します
- 生細胞または死細胞を正確に定量します
- 事前設定された解析モジュールを使用して、統計的に有意な結果を迅速に生成します
PDF版(英語)
Matthew Hammer|アプリケーションサイエンティスト|モレキュラーデバイス
Oksana Sirenko, PhD|Sr.アプリケーションサイエンティスト|モレキュラーデバイス
はじめに
Live/Deadアッセイは、さまざまな化合物や処理、遺伝子発現変化による細胞毒性効果の調査を含む幅広い研究用途で利用されています。自動細胞イメージングと解析は、細胞生存率および細胞死を評価するための最適な方法を提供します。ここでは、ImageXpress® Pico 自動細胞イメージングシステムとCellReporterXpress® 自動画像取得・解析ソフトウェアを使用し、EarlyTox™ Live/Deadアッセイキットで処理した細胞をイメージングする方法をご紹介します。
EarlyTox Live/Deadアッセイキットには、哺乳類の生細胞および死細胞を識別するためのマーカーが含まれています。生細胞は、Calcein AMによって細胞質内で強い緑色蛍光に染色されます。非蛍光性のCalcein AMは、細胞膜を透過し、細胞内エステラーゼによってアセトキシメチル(AM)基が切断され、蛍光性のCalcein分子が生成されます。死細胞マーカーであるEthidium homodimer-III(EthD-III)は、非蛍光性であり、健全な細胞膜を透過しません。細胞死に伴い細胞膜の完全性が損なわれると、EthD-IIIが細胞内に侵入し、核酸に結合して死細胞に明るい赤色蛍光を発します。この方法を用いることで、細胞膜の完全性に影響を与える細胞毒性イベントを正確に評価できます。このアッセイキットは、試験化合物の濃度依存性応答プロファイルの特徴付けを可能にします。ウォッシュ不要の均質アッセイにより、死細胞や死にかけた細胞を洗い流してしまう洗浄工程を排除します。CalceinおよびEthD-IIIからの蛍光シグナルは、ImageXpress PicoシステムとCellReporterXpressソフトウェアを使用して高品質な画像と解析を生成するために利用できます。
材料
- EarlyTox Live/Deadアッセイキット
- エクスプローラーキット(2プレートサイズ、モレキュラーデバイス #R8340)
- バルクキット(10プレートサイズ、モレキュラーデバイス)
- HeLa細胞(ATCC)
- HeLa培地
- 最小必須培地(グルタミンおよび血清添加完全培地
- スタウロスポリン(Sigma)
- マイトマイシンC(Sigma)
- 384ウェル黒色透明底マイクロプレート(Corning Falcon)
- ImageXpress PicoSystem および CellReporterXpress ソフトウェア
方法
HeLa細胞を黒色の384ウェル透明底マイクロプレートに1ウェルあたり5,000細胞で播種し、37°C、5% CO₂インキュベーターで一晩培養しました。細胞は、スタウロスポリン(一般的なプロテインキナーゼ阻害剤であり、抗がん治療薬候補)またはマイトマイシンC(強力なDNA架橋剤であり、化学療法薬)で24時間処理しました。処理は四重複で行い、最高濃度10 μMのスタウロスポリンおよび300 μMのマイトマイシンCから1:3の段階希釈を開始しました。
化合物処理後、細胞はLive/Deadアッセイキット試薬とHoechst 33342核染色剤(Thermo Fisher Scientific)を組み合わせて染色しました。各ウェルの半分の容量を除去し、Calcein AMおよびEthD-IIIの2X染色液に置換しました。最終濃度はCalcein AMが2 μM、EthD-IIIが3 μMでした。プレートは37°C、5% CO₂で30分間インキュベートし、その後Hoechst(最終濃度6 μM)を添加しました。細胞はさらに15分間インキュベートしました。最終インキュベーション直後、プレートはImageXpress Picoシステムでイメージングされ、10X Plan Fluor対物レンズおよびFITC、Texas Red*、DAPIチャンネルを使用して、それぞれCalcein AM、EthD-III、Hoechst染色をイメージングしました。この倍率では、1枚の画像で最大4,000~4,500細胞を撮影でき、統計的に有意な結果が得られます。
※元データはTexas Redが利用できなかったためTRITCフィルターを使用して生成されました。Live/DeadアプリケーションにはTexas Redフィルターが推奨されます。
画像解析(Cell Scoringモジュール使用)
画像はCellReporterXpressソフトウェアのCell Scoring解析モジュールを使用して解析しました。このモジュールは、生細胞と死細胞を識別・分類します。Hoechst染色は総細胞数の識別に使用され、その後、Calcein AMまたはEthD-IIIの特定染色に対して陽性または陰性として細胞をスコアリングしました。**図1は、スタウロスポリン処理あり・なしの陽性および陰性コントロールの画像と、陽性・陰性細胞を示す解析マスクを示しています。**別々の解析を行い、生細胞(Calcein AM陽性)および死細胞(EthD-III陽性)の数と割合を定義しました。
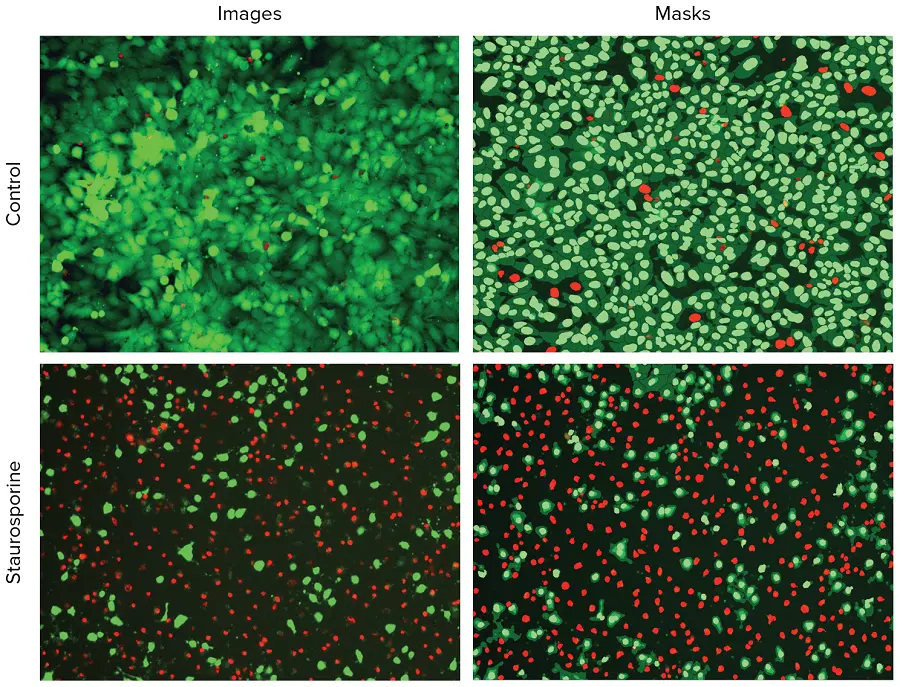
図1. スタウロスポリン0.1 μMで処理した細胞と陰性コントロール細胞の代表的な画像。左:Hoechst核染色(青)、Calcein AM染色(緑)、EthD-III染色(赤)のHeLa細胞の10X画像。右:解析マスクは、生細胞の核を緑、死細胞の核を赤で示します。
EC₅₀毒性計算(用量反応曲線から)
生細胞と死細胞はイメージングされ、Calcein AM(緑蛍光)またはEthD-III(赤蛍光)に陽性の細胞に基づいて定量的なCell Scoring解析が実施されました(図1)。スタウロスポリンおよびマイトマイシンCで処理したHeLa細胞は、死細胞の割合の濃度依存的増加と生細胞の割合の濃度依存的減少を示しました。図2に示す用量反応曲線は、化合物濃度に対する生細胞の割合をプロットし、スタウロスポリンで0.569 μM、マイトマイシンCで223 μMのEC₅₀値を示しました。死細胞の割合の曲線では、スタウロスポリンで0.492 μM、マイトマイシンCで6.305 μMのEC₅₀値が得られました。
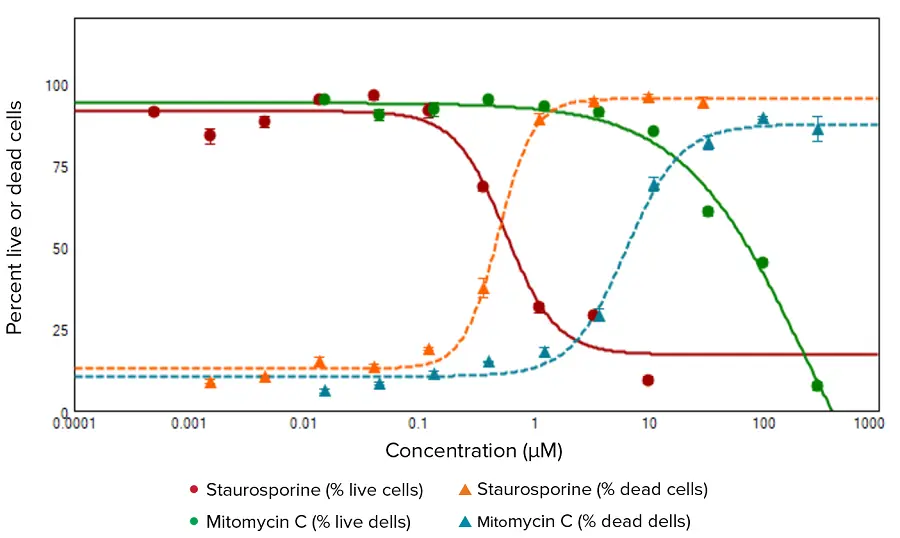
図2. スタウロスポリンまたはマイトマイシンCの異なる濃度で処理したHeLa細胞における生細胞および死細胞の割合の濃度依存性。平均値と標準偏差は四重複から算出しました。これらの曲線から得られたEC₅₀値は、生細胞割合でスタウロスポリン0.569 μM、マイトマイシンC223 μM、死細胞割合でスタウロスポリン0.492 μM、マイトマイシンC6.305 μMです。
結論
EarlyTox Live/Deadアッセイキットは、ImageXpress PicoシステムおよびCellReporterXpressソフトウェアと組み合わせることで、簡便かつ効率的なワークフローで生細胞と死細胞を正確に測定できます。この自動イメージングと定量解析により、細胞毒性化合物の試験が可能となり、さまざまな生物学的アッセイにおける細胞生存率評価に適しています。
PDF版(英語)