Application Note 細胞内の細胞毒性: SpectraMax Lマイクロプレートリーダーで
Lonza ViaLight PlusとToxiLight BioAssaysを使用した簡単な測定法
PDF版(英語)

はじめに
Claire Scholfield Ph.D, Tracy Simmons Ph.D, Susan Gill M.Sc., Lonza Walkerville, Inc、Cathy Olsen Ph.D、モレキュラーデバイス。
生物発光を用いた細胞毒性評価アッセイは、検出限界、スピード、精度が向上し、よく知られています(Crouch et al., 1993)。健康な細胞は培養中、高いATP濃度を一定に保っています。増殖中、培養中の総ATPは細胞数に応じて増加します。逆に、死にかけた細胞は、合成がうまくいかなくなるため、高いATPレベルを維持することができなくなり、レベルが低下します。培養物中に存在するATPのレベルは、存在する生存細胞数を示していて、ATPアッセイは最も予測可能な一般的細胞毒性評価アッセイの一つであることが示されています。
細胞毒性の別の指標は、細胞膜の損傷です。これにより、薬剤が細胞内に侵入し(ヨウ化プロピジウムなど)、細胞成分が周囲の培地に漏出します。細胞膜の損傷が起こると放出される酵素のひとつがアデニル酸キナーゼ(AK)であり、すべての真核細胞に存在するユビキタス・プロテインです(Squirrell and Murphy, 1997)。
Lonzaが開発したViaLight® PlusおよびToxiLight® 細胞毒性アッセイは、細胞のこのような特性を利用し、生物発光法を用いた変化の検出を可能にします。どちらのアッセイも典型的な感度は<10細胞数/ウェルである。ViaLight Plusアッセイは、細胞数に依存しない線形減衰率を有する長時間の発光シグナルを生成するように設計されています。ToxiLightアッセイはホモジニアスで非破壊的なアッセイであり、生細胞と非生細胞の混合集団を含むウェルの直接アッセイを可能にします。このアッセイは、実験ウェルから採取した培養液のサンプルにも使用でき、必要に応じて残りの培養液を別の方法でアッセイできます。これは、サンプルが貴重で複数回の分析が望ましい場合に有用な機能です。
方法
K562ヒト白血病細胞を完全培地で連続希釈し、100µLのアリコートをトリプリケートして白色壁ルミノメータープレートにプレーティングしました。各ウェルのATPレベルをViaLight Plusアッセイを用いて測定しました。簡単に説明すると、50μLの細胞溶解試薬を加え、10分間インキュベート(室温)することで、各ウェルの細胞を溶解しました。溶解後、100μLのATPモニタリング試薬プラスを各ウェルに加え、混合液を2分間平衡化させました。プレートをSpectraMax® Lマイクロプレートリーダーにセットし、SoftMax® Proソフトウェアで事前に設定したプロトコル(表1に示す設定)を使用して、各ウェルの1秒間の読み取りを行いました。結果を図1に示します。
| 表1. ViaLightおよびToxiLightアッセイ用のSpectraMax Lマイクロプレートリーダーの設定 | |
|---|---|
| Parameter | Setting |
| Read Mode | Luminescence |
| Integration Time | 1 sec |
| Sensitivity | PMT Setting: AutoRange Target Calibration Wavelength: 570 nm |
| Assay Plate Type | 96-Well Standard |
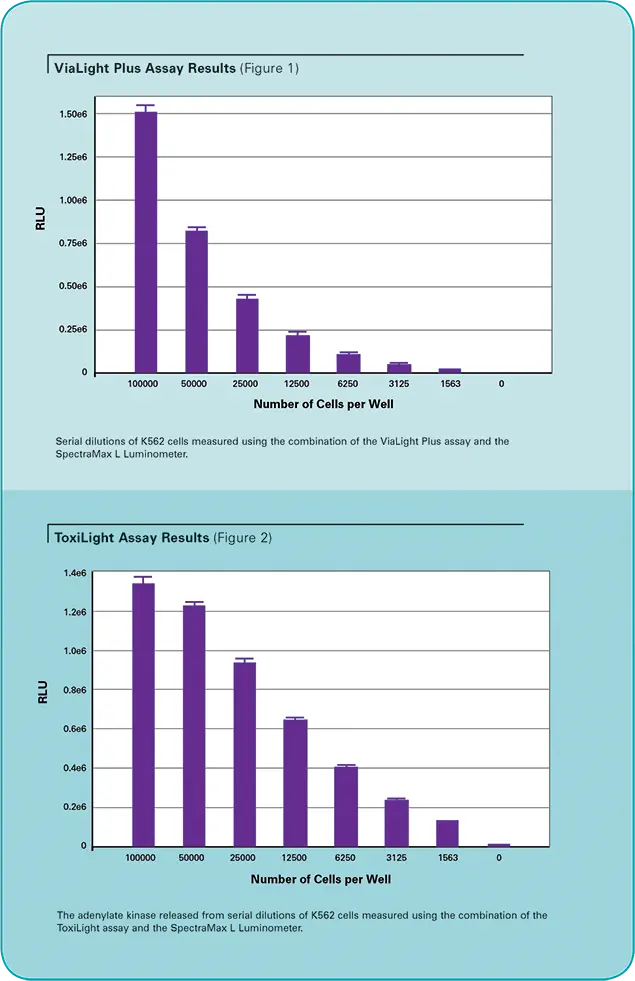
ToxiLightアッセイでは、連続希釈したK562細胞の100μLサンプルを白色壁のルミノメータープレートにプレーティングしました。このアッセイは通常細胞に対して非破壊的であるが、アッセイ感度を示す目的で、細胞を溶解して全アデニル酸キナーゼ(AK)を放出させました。ToxiLight 100%溶解試薬5μLを各ウェルに添加し、室温で10分間インキュベートしました。放出されたAKはToxiLightアッセイを用いて測定しました。簡単に説明すると、AK検出試薬100μLを各ウェルに添加し、混合液を5分間インキュベートしました。プレートをSpectraMax Lマイクロプレートリーダーにセットし、SoftMax Proソフトウェアで事前に設定したプロトコルを用いて各ウェルの1秒間の読み取りを行いました(表1)。結果を図2に示します。
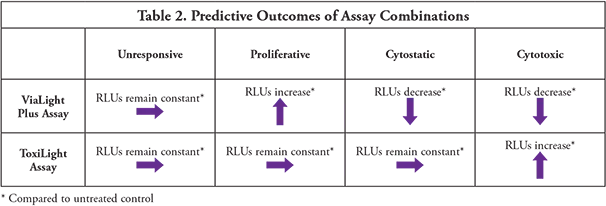
どちらのアッセイも優れた感度と再現性を提供します。両アッセイはロバスト性があり、使い方が簡単で、それぞれ独自の利点があります。ViaLightアッセイは、溶解後に放出されるATPを測定することにより、生存細胞の数を表示します。ViaLightアッセイは、未処理のコントロールと比較して、増殖と細胞毒性の両方を示すことができます。ToxiLightアッセイは、損傷細胞から放出されるAKのみを測定する非破壊アッセイであるため、細胞毒性のより正確な指標となります。一度AKを放出するようになった細胞は回復しません。このアッセイは、健康な細胞や増殖した細胞を示すことはありません。
ToxiLightアッセイの非破壊的サンプリングプロトコールは、他のアッセイと並行して使用することを可能にし、実験デザインの柔軟性を提供します。このことを実証するために、U937ヒト白血病細胞をDNAトポイソメラーゼI阻害剤であるカンプトテシンで処理し、ViaLight PlusとToxiLight試薬の両方を用いて以下のようにアッセイしました。
U937細胞(5x105cells/mL)の100μLサンプルを96ウェルプレートにプレーティングし、濃度の増加する薬剤camptothecinを培養物に添加し、24時間インキュベートしました。インキュベーション工程の後、サンプリングプロトコールに従い、ToxiLight試薬を用いてサンプルをアッセイしました。20μLの細胞上清を白色壁96ウェルプレートのウェルに移しました。その後、各ウェルにAK検出試薬を100µL添加し、室温で5分間インキュベートしました。残りの培養サンプルは、上記のように ViaLight Plus アッセイを用いてアッセイしました。アッセイプレートをSpectraMax Lマイクロプレートリーダーにセットし、SoftMax Proソフトウェアで事前に設定したプロトコルを使用して、各ウェルについて1秒間の読み取りを行いました(表1)。合成結果を図3に示します。
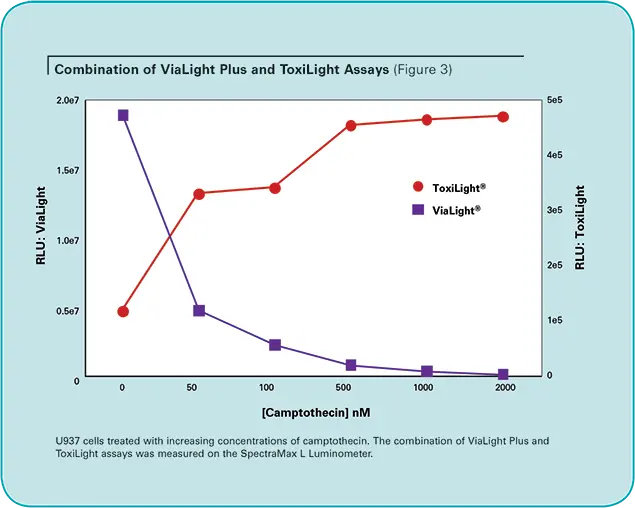
生存細胞の減少が細胞毒性イベントの結果であるという仮定は、必ずしも正しいとは限りません。ViaLightアッセイとToxiLightアッセイの組み合わせは、これを検証するために不可欠なツールです。この実験では、ViaLight Plusアッセイで示されるRLUの減少は、ToxiLightアッセイで測定されるアデニル酸キナーゼの流出量の増加を伴っています。これらのアッセイを組み合わせることで、余分な労力を最小限に抑えながら、より完全な情報を得ることができます(表2)。これらのアッセイは同じサンプルで実施されるので、データをウェル間で直接比較することができ、必要であればToxiLightアッセイのサンプリング手順を拡張することで、細胞死のカイネティクスの有用な指標を提供することができます。
結論
どのアッセイが自分のアプリケーションに最も適しているかはユーザー次第ですが、ここで示しましたように、ViaLight PlusとToxiLightアッセイの組み合わせは非常に多くの情報を提供するので、慎重に検討すべきです。モレキュラーデバイスのSpectraMax LマイクロプレートリーダーとSoftMax Proソフトウェアは、Lonza社のViaLight PlusおよびToxiLightアッセイと相性が良く、細胞死分野における迅速かつ高感度なテクノロジーの組み合わせを研究者にご提供します。高感度で検出範囲が広いため、細胞毒性を容易に検出することができます。
モレキュラーデバイスのその他ソリューション
SoftMax Pro GxP ソフトウェアは、FDA 21 CFR Part 11 要件の GLP/GMP コンプライアンスを実証する必要があるユーザー向けに、追加のツールと機能をご提供します。オプションのハードウェアおよびソフトウェアバリデーションツールを使用することで、データ収集および解析のコンプライアンスを簡単に実証できるようになり、バリデーションプロセスを迅速化および簡素化できます。
スループットの向上が必要な場合、モレキュラーデバイスのStakMax® マイクロプレートスタッカーは、SpectraMaxマイクロプレートリーダーと統合し、20、40、50マイクロプレートのバッチ処理を自動化することができます。
詳細については、www.moleculardevices.co.jpをご覧ください
参考文献
- . Crouch S, Kozlowski R, Slater K and Fletcher J. (1993). The use of ATP bioluminescence as a measure of cell proliferation and cytotoxicity. J. Immunol. Meth. 160(1) 81–8.
- Squirrel D and Murphy J. (1997). Rapid detection of very low numbers of micro-organisms using adenylate kinase as a cell marker. A Practical Guide to Industrial Uses of ATP Luminescence in Rapid Microbiology P107–113.
PDF版(英語)