Application Note GLP-1受容体のKd測定
Tag-lite HTRFによる結合解析
- 洗浄不要で高精度な飽和結合アッセイを実施できます
- CisbioのHTRFツールボックスに含まれる多様な試薬を用いてアッセイを構築できます
- 認証済みのHTRF互換性により、装置の性能を確実に保証します
PDF版(英語)
Caroline Cardonnel |シニア・アプリケーション・サイエンティスト|モレキュラーデバイス
はじめに
CisbioのTag-lite HTRFプラットフォームは、HTRF蛍光体を用いて目的のタンパク質を特定部位で効率的にラベル化できます。細胞膜受容体はSNAPタグプラスミドに挿入可能です。細胞はこの構築体でトランスフェクションされ、タグ付き受容体を発現します。その後、SNAP-lumi4-Tb基質を添加することで、受容体はテルビウム(Tb)クリプテートで共有結合的にラベル化されます。結合アッセイを行うために、受容体のリガンドはHTRFアクセプター蛍光体(例:d2)でラベル化されます。d2ラベル化リガンドがテルビウムでラベル化された受容体に結合すると、受容体からリガンドへの時間分解蛍光共鳴エネルギー移動(TR-FRET)が発生し、HTRF対応マイクロプレートリーダーで測定できます(図1)。
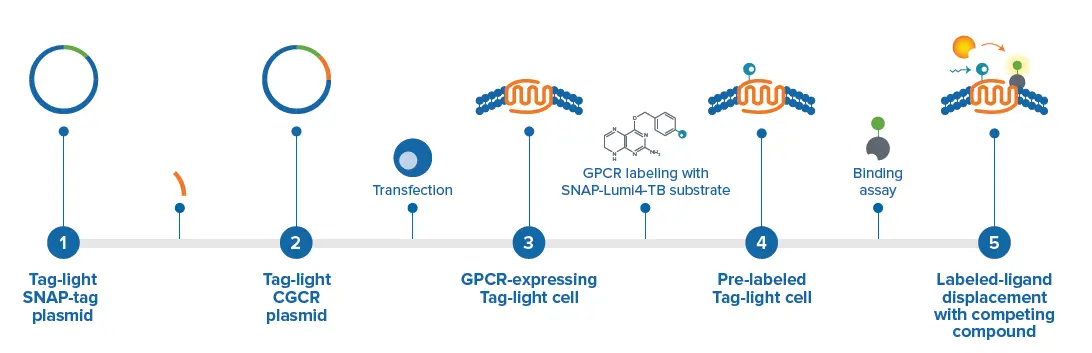
図1. Tag-lite細胞膜結合アッセイの例。まず、目的のGPCR遺伝子をSNAPタグプラスミドに挿入します。次に、細胞をトランスフェクションし、Tag-lite GPCRを発現させます。その後、GPCRをクリプテートドナー(SNAP-lumi4-Tb基質)で共有結合的にラベル化します。最後に、ラベル化リガンドを用いて結合アッセイを実施します。
Cisbioは、タグや目的タンパク質をコードするさまざまなプラスミド、さらにこれらの構築体でトランスフェクション済みの凍結細胞を提供しています。これらの構築体により、テルビウムクリプテートでラベル化可能なタグ付きタンパク質(例:受容体)を発現できます。一方、受容体リガンド(アゴニストまたはアンタゴニスト)はアクセプター蛍光体でラベル化されます。Tag-liteプラットフォームは、受容体二量体形成、リガンド結合アッセイ、セカンドメッセンジャー評価など、幅広いアプリケーションに最適です。結合速度解析により、薬物-タンパク質複合体の結合および解離速度を研究でき、これは創薬候補のin vivo有効性を最適化するために不可欠なステップです *1。
グルカゴン様ペプチド-1受容体(GLP1R)は膵β細胞に発現し、その活性化によりアデニリルシクラーゼ経路が刺激され、インスリンの合成と分泌が増加します。したがって、GLP1Rは糖尿病治療の潜在的ターゲットとして提案されています *2。また、GLP1Rは脳にも発現し、食欲制御に関与し、記憶や学習のメカニズムにおいて重要な役割を果たす可能性があります。
ここでは、SpectraMax® i3xおよびSpectraMax® iD5マルチモードマイクロプレートリーダーを用いて、HTRFによる洗浄不要の高精度な飽和結合アッセイを実施する方法をご紹介します。GLP1Rリガンド結合は、HTRF認証済みのSpectraMax i3xおよびiD5プレートリーダーでTag-liteテクノロジーを使用して評価しました。
飽和結合アッセイ
リガンド結合アッセイは、特定のリガンドが目的受容体に対して持つ親和性を推定するために重要であり、リガンドと受容体間の相互作用メカニズムを理解する上で不可欠です。結合研究は、ターゲットに選択的かつ特異的に結合する薬剤設計を支援する創薬プロセスの一部です。結合親和性は、単一の生体分子(例:受容体)とそのリガンド(例:アゴニスト)間の結合相互作用を定義し、通常は飽和アッセイで測定され、平衡解離定数(Kd)で表されます。Kdは、リガンドとターゲット間の結合強度を評価・ランク付けするために使用されます。Kd値が小さいほど、リガンドのターゲットに対する結合親和性は高くなります。競合または阻害試験でIC₅₀や阻害定数(Ki)を正確に決定するには、適切なリガンド濃度を使用することが重要です。通常、Kd値と同程度またはやや低い濃度が許容されます。Kd値より高いリガンド濃度を使用すると、薬剤がin vivoで実際よりも低効力に見える可能性があります *1。
飽和結合アッセイでは、増加するリガンド濃度に対する総結合および非特異的結合を測定します(図2)。蛍光リガンドを固定量のラベル化細胞を含む溶液に滴定し、平衡に達するまでインキュベートします。蛍光リガンドが受容体に結合するとTR-FRETが発生し、HTRF認証済みマイクロプレートリーダーで測定されます。得られたHTRF比は総結合を表します。非特異的結合は、非ラベル化リガンドを用いたネガティブコントロールで測定され、ラベル化リガンドが受容体、非受容体分子、またはマイクロプレートに非特異的に結合する影響を補正します *2。
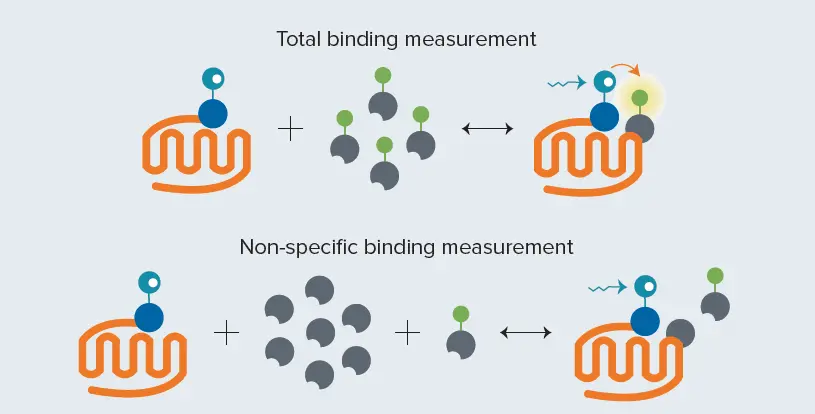
図2. Tag-lite飽和結合アッセイ。総結合の測定:蛍光リガンドが受容体に結合すると、TR-FRETが発生します。非特異的結合の測定:非ラベル化リガンド(過剰量)と蛍光ラベル化リガンドがラベル化GPCRへの結合を競合します。非ラベル化リガンドが受容体に結合すると、TR-FRETは発生しません。
この測定では、蛍光ラベル化リガンドを固定量のラベル化細胞と、非ラベル化リガンドの100倍モル濃度を含む溶液に滴定します。ラベル化リガンドと非ラベル化リガンドはラベル化GPCRへの結合を競合します。非特異的リガンドが過剰に存在するため、受容体に結合し、TR-FRETは発生しません。この滴定から得られるHTRF比は非特異的結合を表します。特異的結合は、各蛍光ラベル化リガンド濃度における総結合から非特異的結合を差し引いて算出します。
材料
- Tag-lite GLP1R 発現、テルビウム標識、凍結保存したそのまま使用可能な細胞 (Cisbio)
- Tag-liteバッファー(Cisbio)
- GLP1受容体レッドアゴニスト(Cisbio)
- エクセンジン4(Sigma-Aldrich)
- 白色低容量384ウェルマイクロプレート(Greiner)
- SpectraMax i3x マルチモードマイクロプレートリーダー(モレキュラーデバイス、#i3x)、HTRF検出カートリッジ付き(モレキュラーデバイス、#0200-7011)
- SpectraMax iD5マルチモードマイクロプレートリーダー(モレキュラーデバイス、#iD5)、HTRF検出システム(モレキュラーデバイス、#6590-0144)付き。#6590-0144、Enhanced TRFモジュールおよびHTRFフィルターを含む)
方法
細胞
細胞は製品インサートに従って調製しました *3。凍結細胞を37°Cで解凍し、5 mLの1X Tag-liteバッファー(TLB)を含むチューブに移しました。チューブを4°Cで1200 × gで5分間遠心し、上清を除去後、細胞ペレットを2.7 mLの1X TLBに再懸濁しました。
ラベル化(蛍光)リガンド
GLP1受容体レッドアゴニストは、赤色蛍光HTRFプローブでラベル化されたExendin 4誘導体です。400 nMのレッドアゴニスト濃度は、ストック濃度を1X TLBで希釈して調製しました(ストック濃度はキットインサート参照)。さらに、1X TLBを用いて10段階の1:2希釈を行い、最終濃度は100 nMから0.097 nMまでとしました。
非ラベル化リガンド
非ラベル化Exendin 4リガンドの最終濃度40 μMは、ストック濃度を1X TLBで希釈して調製しました(ストック濃度は製品インサート参照)。これは、最大ラベル化リガンド濃度400 nMの100倍モル過剰に相当します。
アッセイプレートのセットアップ
試薬はCisbioのリガンド結合プロトコールに従って分注しました(図3)。GLP1受容体細胞10 μLを384ウェルホワイトプレートの各ウェルに分注しました。総結合ウェルにはTLBを5 μL、非特異的結合ウェルには非ラベル化リガンドを5 μL添加しました。最後に、GLP1受容体アゴニストExendin 4-redを5 μLすべてのウェルに添加しました。アッセイプレートは室温(RT)で2時間インキュベートし、SpectraMax i3xおよびiD5リーダーで最適化された装置設定(表1)を用いて測定しました。最適なアッセイ感度とダイナミックレンジを確保するため、マイクロプレートの最適化と読み取り高さの調整を実施しました。
| SpectraMax i3x プレートリーダー | SpectraMax iD5 プレートリーダー | |
|---|---|---|
| 追加コンポーネントが必要 | HTRF 検出カートリッジ: P/N 0200-7011 | HTRF検出システム: P/N 6590-0144 |
| 励起 | 340 nm / 80 nm | 340 nm / 70 nm |
| 発光 | ドナーフィルター: 620 nm アクセプターフィルター:665 nm |
ドナーフィルター: 616/10 nm アクセプターフィルター: 665/10 nm |
| フラッシュ数 | 30 | 30 |
| 積分遅延時間 | 30 μs | 20 μs |
| 積分時間 | 400 μs | 200 μs |
| その他の設定 | リードハイトは、さまざまな容量やプレート形式に合わせて簡単に最適化できます。 | |
表1 テルビウムドナーと赤色アクセプターを用いたHTRFの装置設定
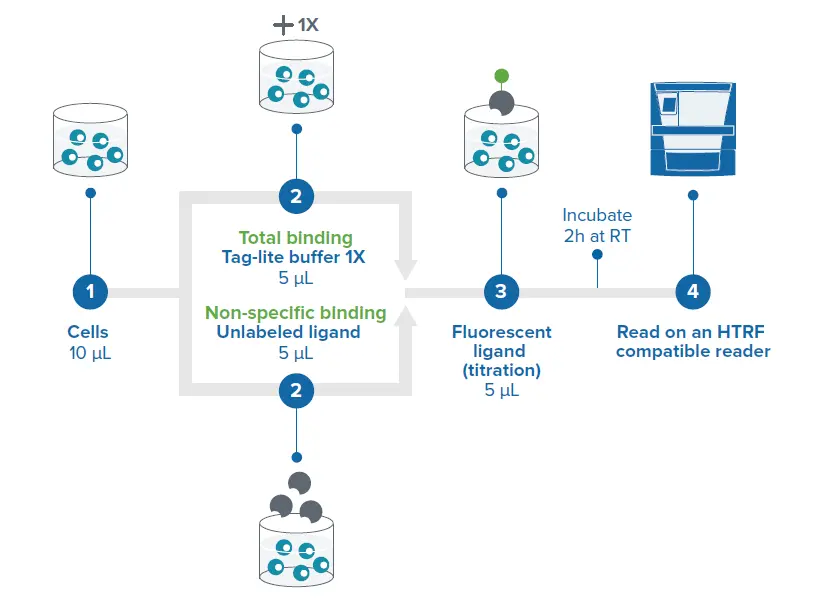
図3. 384ウェル低容量プレートのアッセイセットアップ。プレートはカバーされ、室温で2時間インキュベートしました。TR-FRETはSpectraMax i3xおよびiD5リーダーで測定しました(装置設定は表1参照)。
データ解析
HTRFアッセイの解析には、Cisbioの特許取得済み比率低減法が使用されます。この方法は検出された2つの発光波長に基づきます。ドナー発光616 nmは内部参照として使用され、アクセプター発光665 nmは測定対象の生物学的反応(結合)の指標として使用されます。この比率測定(アクセプター蛍光とドナー蛍光の比)は、ウェル間のばらつきを低減し、化合物干渉を排除します。以下のステップ4で計算されるDelta Fは、アッセイのシグナル対バックグラウンドを反映し、アッセイ間比較に有用です。結果は665 nm / 616 nmの比率から計算され、Delta Fとして次のように表されます:
データはSoftMax® Proソフトウェアを使用して生成・解析しました。このソフトウェアには、検出と解析を簡素化するためのHTRFプロトコールがあらかじめ設定されています。
結果
HTRF比は、総結合ウェルおよび非特異的結合ウェルにおける各ラベル化リガンド濃度で測定しました。特異的結合は、各蛍光リガンド濃度における総結合から非特異的結合を差し引いて算出しました。データは前述の方法で解析され、SoftMax Proソフトウェアを用いて二重長方形双曲線フィットでグラフ化しました(図4)。最良の結果は、表1に示すリーダー設定で得られました。SpectraMax i3xプレートリーダーは、SpectraMax iD5プレートリーダーで得られたものと類似した飽和曲線(ここでは非表示)を生成しました。二重長方形双曲線フィットにより、特異的結合飽和曲線のフィットパラメータBとしてKdを算出できます。Cisbioは、赤色アクセプターを用いたTag-liteアッセイをマイクロプレートリーダーで正確に測定できることを確認するため、Kd値が5 nM以下であることを基準としています。SpectraMax i3xリーダーのKd値は0.816 nM、SpectraMax iD5プレートリーダーのKd値は2.347 nMでした(表2)。これにより、両装置がTag-liteアッセイを検出できることが確認されました。
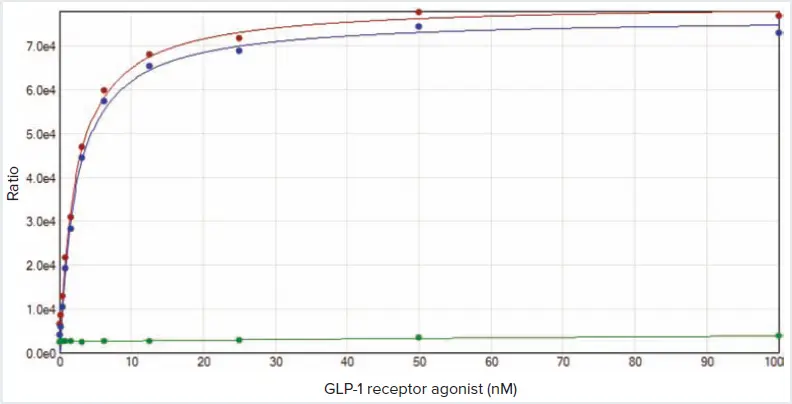
図4. SpectraMax iD5プレートリーダーで測定した飽和結合曲線。飽和結合アッセイは、平衡状態で増加するリガンド濃度に対する総結合および非特異的結合を測定します。特異的結合比(青い曲線)は、各濃度における総結合比(赤い曲線)から非特異的結合比(緑の曲線)を差し引いて算出します。
| パラメータ | Cisbioの規定値 | SpectraMax i3x プレートリーダー | SpectraMax iD5 プレートリーダー |
|---|---|---|---|
| Kd(nM) | 5 | 0.816 | 2.34 |
表2. Tag-lite結合飽和曲線の結果概要
結論
SpectraMax i3xおよびiD5プレートリーダーは、それぞれHTRF検出カートリッジまたはEnhanced TRFモジュールとフィルターを搭載できます。両プレートリーダーは、テルビウムドナーと赤色アクセプターの組み合わせによるHTRFシグナルを検出できることを示し、Tag-liteテクノロジーを用いた飽和試験に利用可能です。SoftMax Pro 7.0.3(またはそれ以降)ソフトウェアを使用することで、HTRFプロトコールが事前設定されており、データ取得と解析が簡素化されます。
参考文献
- https://www.htrf.com/htrf-technology
- http://learn.cisbio.com/hubfs/cisbio-ls/docs/application-notes/Determination%20of%20association%20(kon)%20and%20 dissociation%20(koff)%20rates%20constants%20using%20the%20Tag-lite%20platform.pdf?hsCtaTracking=10f4759a-f255-4f21-aa95- b03c24b839e9%7C736c51a4-4301-4256-ab76-a10df00e9593https://cisbio.wistia.com/medias/i2eup2dah5
- https://fr.cisbio.eu/media/asset/c/i/cisbio_dd_pi_c1tt1glp1.pdf
PDF版(英語)