Application Note FluoroBlokインサートで細胞移動を評価
SpectraMax MiniMax
- 細胞移動を非破壊で高品質にイメージングできます
- セルカウントを直接行うことで正確なデータを取得できます
- SoftMax Proソフトウェアのポイント&クリックツールで細胞を迅速に識別できます
PDF版(英語)
Cathy Olsen博士、Hoang Ha|アプリケーション・サイエンティスト|モレキュラーデバイス
はじめに
細胞移動は、細胞がある場所から別の場所へ移動する現象であり、胚発生や創傷治癒など多様なプロセスにおいて重要です。また、がん細胞が元の場所から体内の異なる部位へ広がる転移においても重要なパラメーターです。転移には、腫瘍細胞の浸潤、血管への侵入、遠隔部位での定着が含まれます *1。 in vitroでは、細胞は栄養素などの化学シグナルに応答して移動し、このケモアトラクションを利用して細胞移動のメカニズムを研究できます。がん細胞移動のメカニズムを理解することで、転移を阻害する新しい治療薬の開発が可能になります。
Corning社の特許技術であるFluoroBlok™インサートは、ポリエチレンテレフタレート(PET)膜を介して細胞懸濁液とケモアトラクタントを含む溶液を分離し、細胞移動や浸潤を測定できます。PET膜は400~700 nmの光透過を遮断します。蛍光ラベル化された細胞は膜の8.0 µmの孔を通過してケモアトラクタントに到達し、これらの細胞はボトムリード型マイクロプレートリーダーやイメージングシステムで容易に検出できます(図1)。移動中の細胞はアッセイ中も生存しているため、エンドポイント測定とタイムコース測定の両方が可能です。
FluoroBlokインサートを用いた細胞移動測定には、プレート底面からの蛍光読み取りが利用できますが、この方法には制限があります。RFU測定を標準化するために細胞の標準曲線が必要であり、蛍光ラベル化のばらつきやバックグラウンド蛍光などの条件がデータ品質に悪影響を与える可能性があります。細胞を直接カウントすることで、研究者は正確な細胞移動データを取得できます。
ここでは、SpectraMax® i3xマルチモードマイクロプレートリーダーとSpectraMax® MiniMax™ 300イメージングサイトメーターを使用し、FluoroBlokインサートを用いた細胞移動測定とイメージングによる細胞カウントの方法をご紹介します。
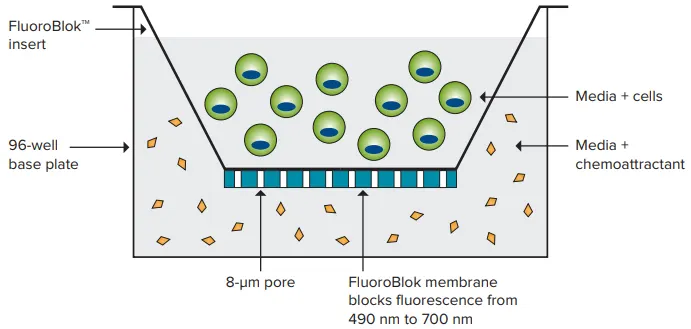
図1. FluoroBlokテクノロジー 蛍光ラベル化された細胞はFluoroBlokインサート内に播種され、8 µmの孔を通過してケモアトラクタントに到達し、底面から検出されます。
材料
- FluoroBlok HTS 96ウェルマルチウェル透過性支持システム(8.0µm高密度PET膜付き)(コーニング社、商品番号351163
- SpectraMax i3x マルチモードマイクロプレートリーダー(モレキュラーデバイス、商品番号 i3x)
- SpectraMax MiniMax 300 イメージングサイトメーター(モレキュラーデバイス、商品番号 5024062)
- NIH3T3細胞 (ATCC)
- 最小必須培地(MEM, コーニング)
- ウシ胎児血清 (FBS、Gemini Bio-Products)
- 0.05% トリプシン EDTA (Corning)
- EarlyTox™ Live Cellアッセイキット(モレキュラーデバイス cat.R8342)
| パラメータ | セルカウントの設定 |
|---|---|
| 光学構成 | MiniMax |
| 読み取りモード | イメージング |
| 読み取りタイプ | エンドポイント 発光 = 520 nm |
| 波長設定 | 541 nm(緑色蛍光) |
| イメージング部位数 | 9 |
| 画像取得設定 | 541露光: 10 ms 541フォーカス調整:240 µm |
| 画像解析設定 | 解析タイプ 個別オブジェクト オブジェクトを見つけるための波長 541 |
表1. 取得および解析設定
方法
NIH3T3細胞は10% FBSを含むMEM(完全MEM)で培養しました。細胞をトリプシン処理後、無血清培地に再懸濁し、EarlyTox™ Live Cellアッセイキットの4 µMカルセインAMで染色しました。染色後、細胞をFluoroBlokインサートにウェルあたり20,000細胞で分注しました。FBSを含む培地を細胞移動のケモアトラクタントとして使用し、無血清培地をネガティブコントロールとしました。
SoftMax ProソフトウェアでFluoroBlokインサートの寸法に対応するカスタムプレート設定を作成しました。設定画面のPlate Typeウィンドウで「Edit Plate」を選択し、Corning社提供の寸法に基づいて修正しました。修正後のプレート定義は新しい名前で保存し、今後のFluoroBlok実験で使用可能です。
MiniMaxサイトメーターを用いて、PET膜を通過するNIH3T3細胞の画像を取得しました。画像は20時間のタイムコースで複数の時点で取得し、取得設定は表1に記載されています。リーダーの内部温度は37°Cに設定し、測定中の細胞の健全性を最大化しました。
移動中のNIH3T3細胞はSoftMax Proソフトウェアで識別・定量しました。Image Analysis Settingsで解析タイプとしてDiscrete Object Analysisを選択しました。蛍光強度とサイズに基づいて細胞を識別するカスタム設定を作成しました(図2)。4~6個の代表的な細胞をクリックすることで、しきい値が自動設定され、ソフトウェアが細胞を識別しました。移動細胞数はソフトウェアでグラフ化しました。
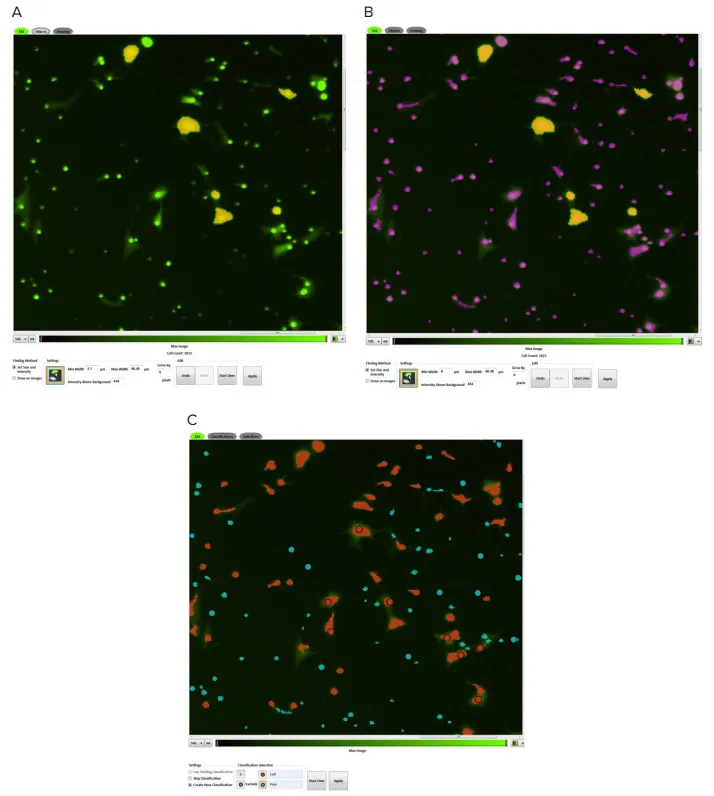
図2. オブジェクト識別 NIH3T3細胞はSoftMax Proソフトウェアの取得エディターでポイント&クリック機能を使用して識別しました。図Aでは、既知の細胞(黄色でマーク)をクリックして蛍光サイズと強度を設定できます。ソフトウェアで識別されたオブジェクトは紫色で表示されます(B)。分類ツールを使用して、細胞(赤マスク)と膜の小孔(青マスク)を区別できます(C)。
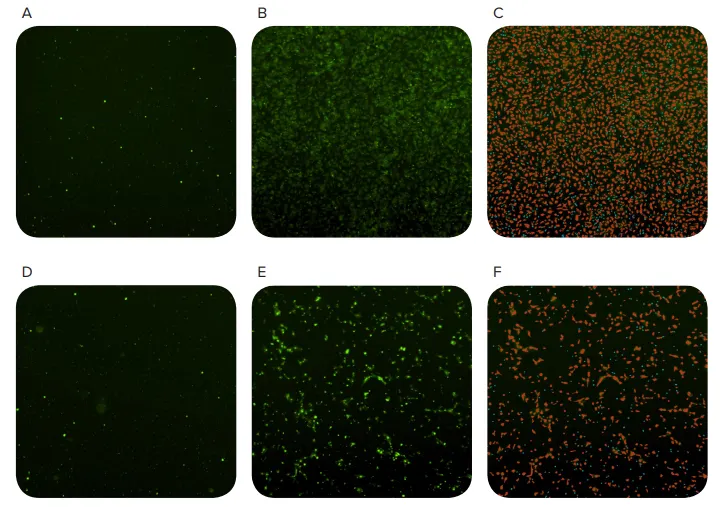
図3. MiniMaxサイトメーターによる細胞移動の追跡 細胞播種後0時間(AおよびD)、20時間後(BおよびE)の画像、およびソフトウェアで識別されたオブジェクト(CおよびF)。赤マスクは細胞として分類されたオブジェクト、青マスクはFluoroBlok膜の小孔として分類されたオブジェクトを示します。上段はケモアトラクタントを含むウェル、下段はネガティブコントロールのウェルを示します。
結果
蛍光染色された細胞は、MiniMaxサイトメーターとSoftMax Proソフトウェアを使用してFluoroBlokプレートを通過する際に識別されました(図3)。ケモアトラクタントを含まないウェルでも一部の移動が見られましたが、20時間後にはケモアトラクタント存在下で細胞移動が約3倍に増加しました(図4)。
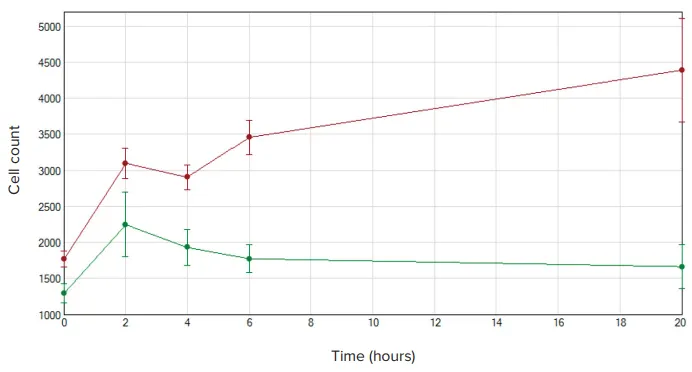
図4. 細胞移動のセルカウント NIH3T3細胞数はSoftMax Proソフトウェアでグラフ化しました。ケモアトラクタントを含むウェルは赤、ネガティブコントロールのウェルは緑で表示されています。両条件とも最初の2時間で移動が見られましたが、ケモアトラクタントを含むウェルでは時間とともに細胞数が増加し続けました。
結論
SpectraMax i3xプレートリーダーとMiniMaxサイトメーターは、FluoroBlok細胞培養インサートと組み合わせて、高品質な画像から細胞を直接カウントし、細胞移動を経時的に測定できます。SoftMax Proソフトウェアは、ポイント&クリックの簡単なユーザーインターフェースでセルカウント解析を迅速に設定できます。画像解析は、細胞染色レベルやバックグラウンド蛍光の影響を受けやすい生蛍光測定と比較して、正確なデータを提供します。SoftMax Proソフトウェアの画像取得・解析機能と96ウェルFluoroBlokフォーマットを組み合わせることで、研究者はがん研究やその他の生物学分野における細胞移動データを迅速に評価できます。
参考文献
- Chambers, Ann F., Alan C. Groom, and Ian C. MacDonald. Metastasis: dissemination and growth of cancer cells in metastatic sites. Nature Reviews Cancer 2.8 (2002): 563.
PDF版(英語)