Application Note EarlyTox Cell Viabilityアッセイキットを用いた
GM-CSFおよびTNFα誘導性アポトーシスの評価
- 添加と測定のワークフローが容易なホモジニアスアッセイ
- 蛍光マイクロプレートリーダーに最適化
- マイクロプレートリーダーフォーマットによるスループットの向上
- SoftMax Proソフトウェアで設定済みのプロトコル
PDF版(英語)
はじめに
腫瘍壊死因子α(TNFα)は主要な炎症性サイトカインの一つであり、いくつかの細胞経路において様々な事象を調節します。TNFαは、細胞内カスパーゼカスケードの活性化を介して、U937のような造血細胞のアポトーシスを誘導することが知られています。一方、顆粒球マクロファージコロニー刺激因子(GM-CSF)は、増殖や分化を促進する造血成長因子の一つです。しかし、U937細胞はGM-CSFに反応して増殖抑制やアポトーシスを示すことが報告されています。TNFαとGM-CSFはともにU937細胞にアポトーシスを誘導しますが、その時間経過はこれら2つのサイトカイン間で異なるようでした。2つのサイトカインを併用すると、高い相乗効果が観察されました。
EarlyTox™ Cell Viabilityアッセイキットは、生存率や様々なアポトーシスイベントを含む様々な細胞状態を評価するための試薬ファミリーです。これらの試薬は、蛍光マイクロプレートリーダーに最適化された均一性無洗浄アッセイ用に設計されています。ここでは、Live/Dead Assay、Caspase-3/7 R110 Assay、Caspase-3/7 NucView 488 Assayの3種類のキットを用いて、U937細胞に対するTNFαおよびGM-CSF処理の影響を測定しました(図1)。
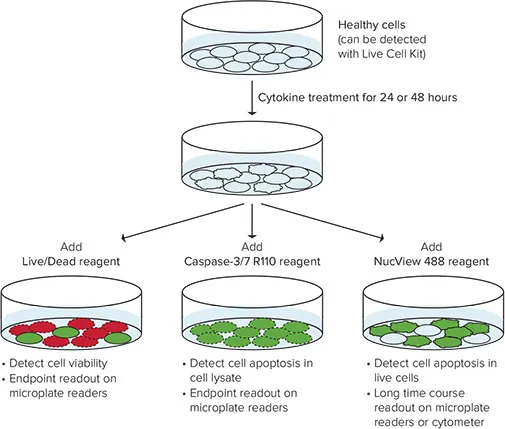
図1. GM-CSFとTNFαによるアポトーシスの評価。
- EarlyTox™ Live/Deadアッセイキットには、哺乳類細胞での使用に適した2種類の生細胞/死細胞マーカーが封入されています。カルセインAMは広く使用されている生細胞マーカーであり、エチジウムホモダイマー-III(EthD-III)は損なわれた膜から細胞に入り、DNAに結合して死細胞で明るい赤色蛍光を発します。
- EarlyTox™ Caspase-3/7 R110アッセイキットは、アポトーシスプロセスのエンドポイント解析のために細胞溶解を必要とするワンステップの均一性アッセイをご提供します。
- EarlyTox™ Caspase-3/7 NucView 488 アッセイキットは、NucView 488 Caspase-3基材を使用することにより、インタクトな細胞集団におけるアポトーシスの検出を可能にします。この試薬は細胞に対して毒性がなく、アポトーシスのカイネティクス研究に使用できます。
この細胞ベースの試験では、SpectraMax® i3x マルチモードマイクロプレートリーダーを用い、ウェルスキャン機能で底から蛍光シグナルを測定しました。この機能は、潜在的な細胞増殖の不均一性によるウェル間のばらつきを避けるため、ウェルの底を横切る12点(ユーザー定義可能)のシグナルを平均化します。
材料
- U937細胞(ATCC)
- サイトカイン
◦ヒト TNFα (Peprotech)
◦ヒト GM-CSF (Peprotech) - EarlyTox Cell Viabilityアッセイキット(モレキュラーデバイス):
◦EarlyTox Live/Dead アッセイキット (Cat.# R8340)
◦EarlyTox Caspase-3/7 R110 アッセイキット (Cat.# R8346)
◦EarlyTox Caspase-3/7 NucView 488アッセイキット (Cat.# R8348) - PBS
- 96ウェル、フラット、クリアボトム、黒色TC処理マイクロプレート(Corning)
- SpectraMax i3x マルチモードマイクロプレートリーダーおよびSpectraMax® MiniMax 300イメージングサイトメーター
方法
細胞の培養と処理
U937細胞は、10%FBSとペニシリン/ストレプトマイシンを添加したRPMI1640培地で培養しました。
実験当日、細胞は100,000個/80μL/ウェルで播種しました。20μLの5倍濃度のサイトカインを各ウェルに加え、最終濃度を1倍、容量を100μLとしました。処理は5% CO2、37℃のインキュベーターで24時間または48時間行いました。
細胞生存率およびアポトーシスアッセイ
処理後、試薬を調製し、以下のように各ウェルに添加しました。
For Live/Dead アッセイ: カルセインAM/EthD-IIIの2X作業溶液は、カルセインAMとEthD-IIIのストック溶液をPBSに加え、各色素の濃度が6μMになるように調製しました。100μLの2X作業溶液を各アッセイウェルに加え、最終容量を200μLとし、各染料の最終濃度を3μMとしました。プレートを遮光し、室温で1時間インキュベートしました。SpectraMax i3xリーダーで、表1に示した設定を用いて蛍光を測定しました。
For Caspase-3/7 R110 アッセイ: 酵素基質(AC-DEVD)2-R110(2mM)を細胞溶解/アッセイバッファーに50μL/1mLの割合で加えて基質アッセイバッファーを調製しました。100μLの基質アッセイバッファーを各ウェルに加え、最終体積をウェルあたり200μL、最終基質濃度を50μMとしました。その後、サンプルを遮光して室温で1時間インキュベートしました。SpectraMax i3xリーダーで、表1に示した設定を用いて蛍光を測定しました。
Caspase-3/7 NucView 488アッセイ: NucView 488基質の10μM 2X作業溶液をPBSで調製した。100μLの作業用基材溶液を、100μLの細胞と培地を封じ込めたウェルに直接加え、最終濃度を5μMとしました。細胞を遮光し、室温で1時間インキュベートしました。イメージングをSpectraMax MiniMaxサイトメーターで541 nmの緑色蛍光チャンネルを用いて行うか、SpectraMax i3xプレートリーダーで検出しました。プレートリーダーの設定については表1をご参照ください。
| Live/Dead | Caspase-3/7 R110 | Caspase-3/7 NucView 488 | |
|---|---|---|---|
| Parameter | Setting | Setting | Setting |
| Read mode | Fluorescence | ||
| Read type | Well Scan | ||
| Wavelengths |
Live Excitation = 495 nm
Dead |
Excitation = 490 nm Emission = 520 nm |
Excitation = 490 nm Emission = 520 nm |
| PMT and optics |
Flashes per read:6 |
||
| Well Scan setting |
Pattern: Fill |
||
表1. プレートリーダーの設定。
結果
その結果、TNFαで処理すると、U937細胞は用量依存的、時間依存的にアポトーシスを起こしました。GM-CSFの処理は48時間までU937に影響を与えなかったです。しかし、細胞をTNFαとGM-CSFの組み合わせでインキュベートすると、48時間後に明らかに相乗効果が観察されました。GM-CSF単独では、caspase 3-like 経路を介してU937細胞にアポトーシスを誘導することが、TNFαに比べて遅い時間経過(72時間後)で報告されていますが、これら2つのサイトカインの相乗効果は24時間で観察されました。私達の研究では、相乗効果は48時間まで明らかではなかったです。図2-5をご参照ください。
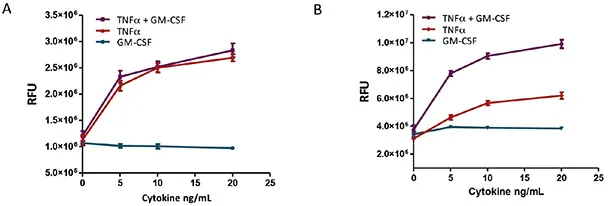
図2. Caspase-3/7 R110アッセイを用いたU937におけるTNFαおよびGM-CSF誘導アポトーシスの濃度反応。アポトーシスアッセイは、指定された時点でCaspase-3/7 R110試薬をウェルに直接添加し、室温で1時間インキュベートしました。
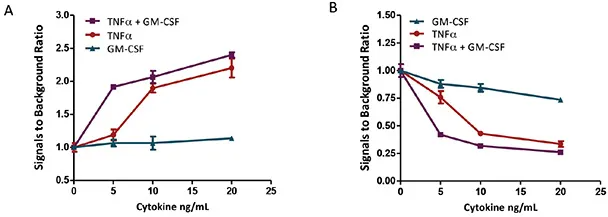
図3. TNFαとGM-CSFがU937細胞に誘導するアポトーシスの濃度反応とLive/Deadアッセイ。U937細胞を5% CO2、37℃のインキュベーターで48時間サイトカイン処理しました。Live/Deadアッセイは、48時間後にLive/Dead試薬をウェルに直接添加し、室温で1時間インキュベートすることにより行いました。結果は無処置のコントロールで正規化しました。(A) デッドセル数。(B) Live/Dead比。
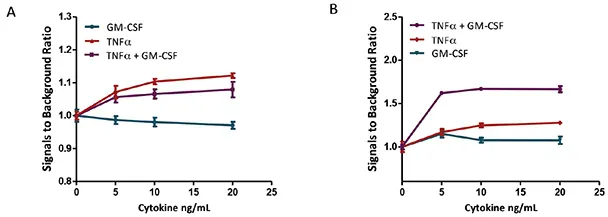
図4. Caspase-3/7 NucView 488アッセイによるU937のTNFαとGM-CSFによるアポトーシス誘導の濃度反応。U937細胞を5%CO2、37℃のインキュベーターで24時間(A)または48時間(B)サイトカインで処理しました。アポトーシスアッセイは、指定された時点でNucView Caspase-3/7 Kit試薬をウェルに直接添加し、室温で1時間インキュベートすることにより行いました。
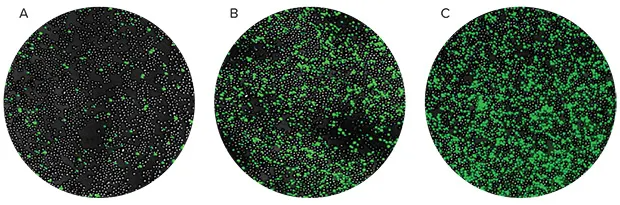
図5. SpectraMax MiniMaxサイトメーターを用いたCaspase-3/7 NucView 488アッセイによるU937のアポトーシス誘導に対するTNFαとGM-CSFの相乗効果。U937細胞を5%CO2、37℃のインキュベーターで48時間サイトカインで処理しました。アポトーシスアッセイは、NucView Caspase-3/7 Kit試薬を指定された時点でウェルに直接添加し、室温で1時間インキュベートすることにより行いました。画像データはサイトメーターで得ました。A)GM-CSF、(B)TNFα、または(C)TNFα+GM-CSFで処理した細胞を示します。
結論
アポトーシスの異なる出力値を測定する3つの異なる試薬を用いて、懸濁細胞のアッセイプロセスを簡略化する混合-測定プロトコルを実証しました。SpectraMax i3xプレートリーダーのウェルスキャン機能は、ウェル間のばらつきを低減し、ウェル間の細胞の不均一な増殖や分布を補正しました。細胞生存率試薬ファミリーは、アポトーシスや細胞死に関連する細胞事象を研究するための様々なツールを研究者にご提供します。
参考文献
Okuma E., Saeki K., Shimura M., Ishizaka Y., Yasugi E., Yuo A. Induction of apoptosis in human hematopoietic U937 cells by granulocyte-macrophage colony-stimulating factor: possible existence of caspase 3-like pathway. Leukemia (2000) 14, 612-619.
EarlyTox Cell Viabilityアッセイキットについての詳細はこちら >>
PDF版(英語)