Application Note カルシウムオシレーションや
収縮パターンの測定による心機能の解析
- 2Dおよび3D心筋細胞サンプルにおけるカルシウムオシレーションの記録と心機能解析
- 複雑なキネティックパターンの解析
- 時間経過に伴う蛍光変動の測定
- マルチパラメトリックなピークデータの生成
- 高密度マイクロプレートでの心機能に対する化合物の影響をスクリーニング
PDF版(英語)
はじめに
Matthew Hammer|アプリケーションサイエンティスト|モレキュラーデバイス
Oksana Sirenko, PhD|上級研究員|モレキュラーデバイス
創薬プロセス初期における心臓への薬剤影響の理解は、安全性向上のために極めて重要です。心毒性は、前臨床および臨床試験における薬剤開発中止の主な原因のひとつと考えられています *1,*2。また、環境化学物質への曝露は心血管疾患のリスク因子であるにもかかわらず、多くの環境因子は毒性影響について十分に評価されていません *3。
ヒトiPSC由来心筋細胞は、初代心筋細胞のフェノタイプや機能性に類似しており、初代細胞使用時に生じるばらつきを回避できるため、in vitroモデルとして非常に有用です。iPSC由来心筋細胞は自発的かつ同期した収縮を示し、薬剤や化学物質によってその収縮が変化するため、生物学的に関連性の高いモデルといえます。機械的収縮は透過光で記録可能ですが、Ca²⁺感受性色素を用いたカルシウムオシレーションパターンの乱れも、心筋細胞の拍動頻度やパターンへの影響を測定する手法として有効であることが示されています*5,*6。iPSC由来心筋細胞におけるカルシウムオシレーションをタイムラプスイメージングとImageXpress® Micro ハイコンテントイメージングシステムを用いて記録・解析する方法は、すでに報告されています *4–*6。
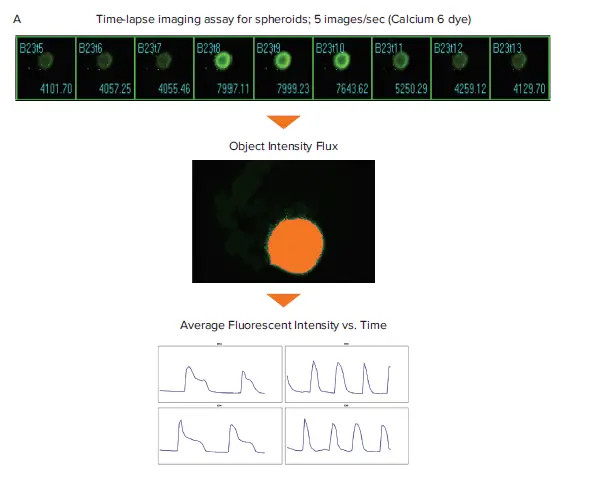
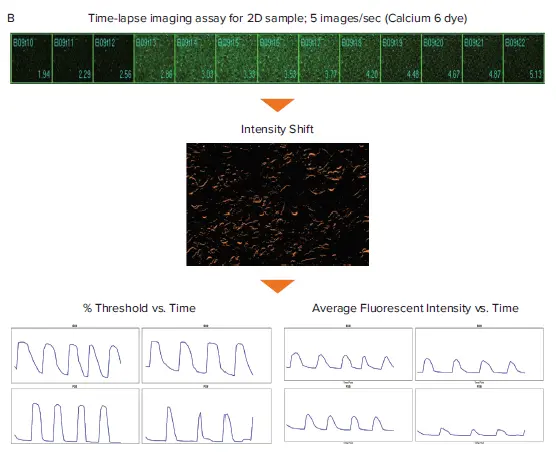
図1. Ca²⁺振動グラフの生成に関する概略図(スフェロイドおよび2D心筋細胞)スフェロイドおよび2D iPSC由来心筋細胞にカルシウム6色素を染色し、タイムラプスイメージのフィルムストリップを取得しました。(A) Object Intensity Flux解析:最大蛍光強度画像を用いてセグメンテーションマスクを作成し、対象スフェロイドの全タイムポイント画像に適用することで、時間経過に伴う蛍光強度の変化を測定します。(B) Intensity Shift解析:蛍光シグナルの再分布を時間経過で測定し、しきい値の割合および平均蛍光強度を算出します。
本テクニカルノートでは、2Dおよび3D心筋細胞サンプルにおけるCa²⁺振動シグナルトレースの可視化および解析におけるMetaXpress Peak Analysisツールの有用性を紹介します。iPSC由来心筋細胞スフェロイドに対して実施したObject Intensity Flux解析による蛍光強度データの生成方法を説明するとともに、拍動頻度、ピーク幅、振幅、規則性などのマルチパラメトリックなピーク出力を得るための手順をまとめています。
材料
- iCell Cardiomyocytes 2(富士フイルムセルラーダイナミクス)
- iCell Cardiomyocytes Plating Medium(富士フイルムセルラーダイナミクス)
- iCell Cardiomyocytes Maintenance Medium(富士フイルムセルラーダイナミクス)
- 384ウェルマイクロプレート(コーニング)
- 384ウェル、低付着性、U字型マイクロプレート(コーニング)
- 0.1%ゼラチン(Sigma)
- EarlyTox 心毒性キットまたはCalcium 6 dye(モレキュラーデバイス)
- ImageXpress®Micro Confocalハイコンテントイメージングシステム、MetaXpress®画像取得・解析ソフトウェア、バージョン6.5(モレキュラーデバイス)。
方法
ヒトiPSC由来心筋細胞は、製造元のプロトコールに従って、2Dまたは3Dアッセイフォーマットで培養されました。従来の2D培養では、ゼラチンでコーティングした384ウェルマイクロプレートに7,000細胞/ウェルで播種しました。3Dフォーマットでは、5,000細胞をゼラチン存在下で低接着性U字型384ウェルマイクロプレートに播種しました(既報の方法に準拠)。播種から4〜5日後、心筋細胞は100〜0.3 µMの濃度範囲で、既知の心機能活性化合物および心毒性化合物に1時間、24時間、5日間曝露されました *6。その後、心筋細胞はEarlyTox 心毒性キットまたはCalcium 6色素で染色されました。これらは細胞質内カルシウム濃度の変化を測定するものであり、心筋細胞の収縮を示すキネティック指標です。タイムラプスイメージングプロトコールでは、露光時間3〜10 ms、撮影間隔0.1〜0.3秒、総撮影ポイント数60〜100で、1ウェルごとに全タイムシリーズを取得してから次のウェルに移動しました *6。この高速キネティックイメージングは、ImageXpress Micro Confocalシステムの広視野モードで、10X対物レンズとFITCチャンネルを使用して実施されました。
MetaXpressのObject Intensity FluxおよびIntensity Shiftジャーナルは、iPSC由来心筋細胞のタイムラプス画像に対して実行され、平均蛍光強度またはしきい値割合データを生成しました。ジャーナルとは、MetaXpressソフトウェア内のマクロであり、カスタムの画像取得・処理・解析ワークフローを自動化するために使用できます。これらのジャーナルはワンクリックで実行可能で、さまざまな細胞やアッセイタイプにおけるオシレーション挙動の解析を行えます。Object Intensity Flux解析では、対象を検出し、蛍光強度のオシレーションを解析します(図1Bは心筋スフェロイド画像での解析例)。Intensity Shift解析では、画像の蛍光または透過光強度の再分布を時間経過で測定します。適切な正規化オプションを選択することで、透過光で取得したラベルフリーの心筋細胞記録にも、蛍光サンプルの記録にも適用可能です(図1Bは2D心筋細胞画像でのIntensity Shift解析例)。蛍光強度およびしきい値割合データはグラフ化され、Ca²⁺オシレーション(心拍を示す)に関するマルチパラメトリック解析に使用されました(図2および図3)*6。
画像解析
細胞の蛍光強度の変動を時間経過で測定
心筋細胞の拍動解析は、2Dおよび3D心筋細胞サンプルの単一平面画像に対して実施されました。この例では、iPSC由来心筋細胞のスフェロイドを0.2秒間隔で60タイムポイント取得し、ImageXpress Micro Confocalシステムで撮像しました。MetaXpressソフトウェアのObject Intensity Flux解析を用いて解析を行いました。この解析では、タイムポイント画像のスタックから最大強度のスフェロイド画像を特定し、そのしきい値を用いてスフェロイドをセグメント化します。このセグメンテーションは、対象ウェルの全タイムポイント画像に適用され、平均蛍光強度を測定します(図1)。
データ解析
Peak Analysisトレースを用いた複数パラメータの生成
MetaXpressソフトウェアで「平均蛍光強度 vs. 時間」のグラフを作成することで、化合物に対する細胞内Ca²⁺変動のフェノタイプ応答を容易に観察できます。図2に示されたオシレーション強度グラフは、Peak Analysis設定の最適化に使用されました(図3A)。ウェル間で強度にばらつきがある場合は、「Dynamic Threshold」機能を選択することで、ピークの振幅や傾きのしきい値を自動調整し、すべてのウェルで正確にピークを検出できます(図3A)。「Smooth Width」値はピークデータの平滑化に使用されるデータポイント数であり、ノイズを除去してピーク検出を安定させるために十分な値が必要です。値が大きすぎると実際のピークがカウントされなくなり、小さすぎるとノイズがピークとして誤認される可能性があります。ノイズのない理想的なデータの場合、「Smooth Width」は1に設定できます。
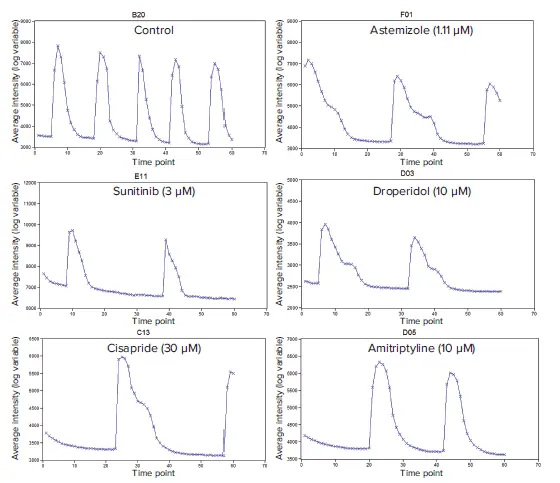
図2. 心毒性化合物に対する代表的なカルシウムフラックスシグナルトレース(平均蛍光強度)表示されているトレースは、典型的なフェノタイプ応答を示しています。DMSOコントロールでは規則的なCa²⁺フラックスパターンが維持されており、アステミゾール、スニチニブ、ドロペリドール、シサプリド、アミトリプチリンでは影響を受けたパターンが観察されました。これらのトレースは、心筋スフェロイドを24時間化合物処理した際の応答を示しています。
Fit Widthはピークの幅を構成するデータポイント数であり、振幅やピーク幅などのピーク測定に使用されます。
MetaXpress Peak Analysisツールで生成された測定値は、スプレッドシートやテキストファイルに簡単にエクスポート可能です。測定項目には、拍動頻度、ピーク振幅、ピーク幅、立ち上がり時間、減衰時間、規則性などが含まれ、化合物処理による心拍頻度やパターンの変化を詳細に評価できます(図3B)。
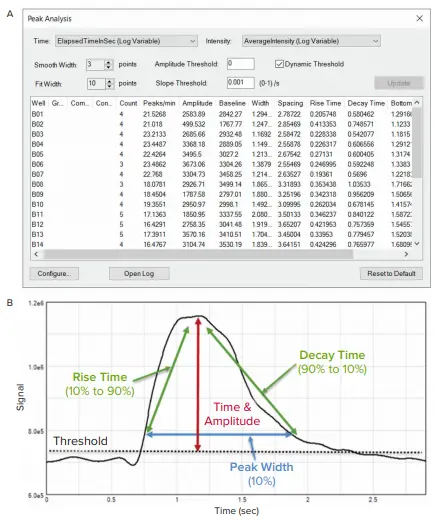
図3. MetaXpress Peak Analysisによるカルシウムフラックスシグナルトレース(平均蛍光強度)の解析 (A) ユーザーインターフェースの設定画面と算出された出力のスクリーンショット。Smooth WidthおよびFit Widthは、表示された心拍グラフのトレースを最適に表現するように設定されています。 (B) ピーク解析における各測定項目の説明。
結論
MetaXpressソフトウェア(バージョン6.5以降)は、細胞収縮を反映するカルシウムオシレーションを含む複雑なキネティックパターンの記録と解析を可能にします。ImageXpress Microシステムによる2Dおよび3D心筋細胞培養の高速キネティック蛍光イメージングと、MetaXpress Peak Analysisツールによる解析により、高密度マイクロプレートでの化合物スクリーニングおよび心機能研究が可能になります。このオールインワンパッケージは、イメージング、解析、グラフおよびデータの生成をシームレスに統合し、未処理および処理済みサンプルにおける心拍プロファイルを包括的に可視化します。これにより、薬剤候補の早期評価や、環境因子による心毒性影響の検証に貢献します。
参考文献
- Berridge BR, Hoffmann P, Turk JR, Sellke F, Gintant G, Hirkaler G, Dreher K, Schultze AE, Walker D, Edmunds N, Halpern W, Falls J, Sanders M, Pettit SD. Integrated and translational nonclinical in vivo cardiovascular risk assessment: Gaps and opportunities. Regul Toxicol Pharmacol. 2013;65:38–46. Web.
- Laverty H, Benson C, Cartwright E, Cross M, Garland C, Hammond T, Holloway C, McMahon N, Milligan J, Park B, Pirmohamed M, Pollard C, Radford J, Roome N, Sager P, Singh S, Suter T, Suter W, Trafford A, Volders P, Wallis R, Weaver R, York M, Valentin J. How can we improve our understanding of cardiovascular safety liabilities to develop safer medicines? Br J Pharmacol. 2011;163:675–693. Web.
- Judson R, Richard A, Dix DJ, Houck K, Martin M, Kavlock R, Dellarco V, Henry T, Holderman T, Sayre P, Tan S, Carpenter T, Smith E. The toxicity data landscape for environmental chemicals. Environ Health Perspect. 2009;117:685–695. Web.
- Sirenko O, Crittenden C, Callamaras N, Hesley J, Chen YW, Funes C, Rusyn I, Anson B, Cromwell EF. Multiparameter in vitro assessment of compound effects on cardiomyocyte physiology using ipsc cells. J Biomol Screen. 2013a;18:39–53. Web.
- Sirenko O, Cromwell EF, Crittenden C, Wignall JA, Wright FA, Rusyn I. Assessment of beating parameters in human induced pluripotent stem cells enables quantitative in vitro screening for cardiotoxicity. Toxicol Appl Pharmacol. 2013b;273:500–507. Web.
- Sirenko O, Hancock MK, Crittenden C, Hammer M, Keating S, Carlson CB, Chandy G. “Phenotypic Assays for Characterizing Compound Effects on Induced Pluripotent Stem Cell-Derived Cardiac Spheroids.” Assay Drug Dev Technol. 2017 Aug/Sep;15(6):280-296. Web.
PDF版(英語)