Application Note iPSC由来3D神経オルガノイドにおける
自発的カルシウム振動の機能解析と神経活性化合物への応答評価
- ハイスループットスクリーニング – 多数の化合物を迅速にスクリーニング可能で、短期間で加速された評価が可能
- 生理学的に関連性の高いモデルによるリアルタイム機能評価 – 薬剤効果をより正確に反映する生理学的に妥当なオルガノイドを使用
- 自動化されたモニタリングと培養管理 – オルガノイドの健康状態を最適に維持し、手作業を最小限に抑えた管理が可能
PDF版(英語)
はじめに
Krishna Macha、Oksana Sirenko、Jeffrey Tang|モレキュラーデバイス,
Leon Chew|STEMCELL Technologies Inc.
ヒト人工多能性幹細胞(iPSCs)由来の神経オルガノイドは、脳の発生、疾患、障害を多様な遺伝的背景のもとで理解するための有望な技術として急速に発展しています。本研究では、カルシウム振動を指標とした神経オルガノイドの自発的活動の機能的特徴づけに焦点を当てました。神経オルガノイドは、STEMCELL™ Technologies社の標準化された試薬およびプロトコルを用いて作製され、アッセイ実施前にモレキュラーデバイスへ輸送されました。
3Dオルガノイドの形態評価は明視野イメージングにより行われ、直径は1800〜2000 µmの範囲でした。神経マーカー(MAP2およびGAFP)の発現はRT-qPCR解析により確認されました。神経活動の機能評価はカルシウム振動アッセイにより実施され、FLIPR® Pentaハイスループットセルベーススクリーニングシステムを用いてカルシウムシグナルの高速動態変化を記録しました。カルシウム振動の可視化および解析はScreenWorks® Peak Pro 2ソフトウェアにより行われ、さらにImageXpress® Micro Confocalシステムにて動態イメージングも取得されました。使用したカルシウム感受性色素には、バックグラウンド蛍光をマスキングする技術が搭載されており、洗浄工程なしで高感度なカルシウム振動検出が可能です。カルシウム振動パターンはピーク数や振幅など複数の指標に基づいて解析されました。大多数のオルガノイドは安定した自発的カルシウム振動を示しましたが、一部のオルガノイドでは同期的な活動が見られず、4-アミノピリジン(4-AP)やAMPAによる刺激により活動が誘導されました。
薬理学的な機能応答を評価するため、複数の化合物を用いて解析を行いました。AMPAおよび4-APの添加によりカルシウム振動の頻度が濃度依存的に増加し、GABAの添加では振幅が減少しました。これらの結果から、iPSC由来3D神経オルガノイドとハイコンテントイメージングおよびカルシウム振動の詳細解析を組み合わせた本生物学的システムは、化合物評価における有望なツールであることが示されました。
方法
mTeSR™ Plusで維持されたヒトiPS細胞(H-iPSCs)を解離し、Seeding Medium(Formation Medium + 10 µM Rhoキナーゼ阻害剤(ROCKi))を用いてAggreWell™ 800プレートに3×10⁶ cells/wellの密度で播種しました。培養はFormation Mediumで毎日給餌されました。6日後、オルガノイドはExpansion Mediumを用いて6ウェルプレートに移し、70 RPMの軌道振とう(INFORS HT Celltron)で培養を継続しました。25日目までは2〜3日ごとにExpansion Mediumで給餌し、その後43日目まではDifferentiation Mediumで培養しました。43日目以降はMaintenance Mediumで2〜3日ごとに給餌を行い、60日目に神経オルガノイドを輸送し、以降もMaintenance Mediumで給餌を継続しました。
アッセイ当日には、細胞スフェロイドにFLIPR Calcium 6染色液(2倍濃度、モレキュラーデバイス)を添加し、2時間インキュベートしました。FLIPR Pentaシステム(モレキュラーデバイス)に搭載された高速EMCCDカメラを用いて、3D神経オルガノイドの自発的カルシウム波形のパターンと頻度を測定しました。ベースライン記録は10分以上取得し、その後30〜90分間薬剤を添加して応答を評価しました。ピーク解析はScreenWorks Peak Pro 2ソフトウェア(モレキュラーデバイス)により実施され、一次および二次ピーク、複雑なカルシウム振動パターンの特徴づけが可能となりました。ImageXpress Micro Confocalシステム(モレキュラーデバイス)によるハイコンテントイメージングでは、スフェロイドの3D構造の取得および生存率評価が行われました。
CellXpress.aiによる自動給餌およびモニタリング
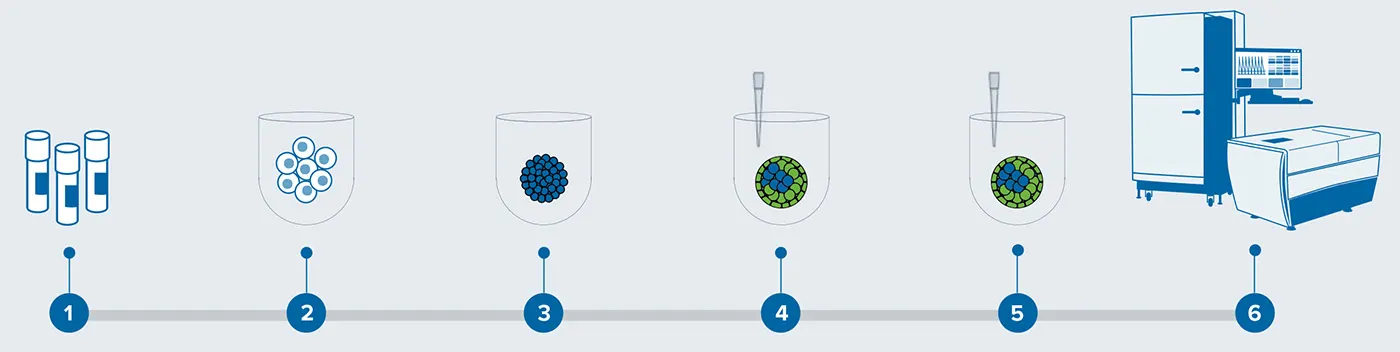
図1. プロセスワークフローの模式図 (1–4) STEMCELL™ Technologies社の製品を用いて、ヒト多能性幹細胞からオルガノイドを形成・分化(播種、形成、拡張培地、分化培地)、(5) モレキュラーデバイスにてMaintenance Mediumを用いてオルガノイドを維持、(6) FLIPR PentaシステムおよびImageXpress Micro Confocalシステム(いずれもモレキュラーデバイス)を用いてアッセイおよび撮像を実施
結果
3D神経オルガノイドの形成と特性評価
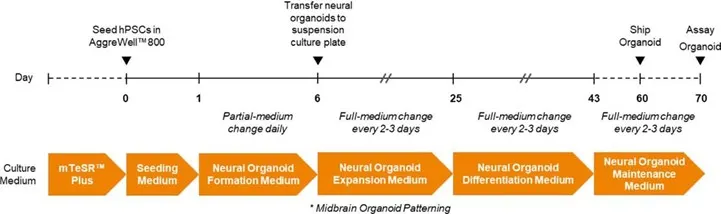
図2. STEMdiff™ Dorsal Forebrain Organoid Kit(STEMCELL™ Technologies、カタログ番号08620)およびSTEMdiff™ Midbrain Organoid Differentiation Kit(カタログ番号100-1096)を用いて、ヒト多能性幹細胞(hPSCs)株SCTi003-A(カタログ番号200-0511)から背側前脳オルガノイドおよび中脳オルガノイドをそれぞれ製造元プロトコールに従って作製いたしました。mTeSR™ Plusで維持されたhPSCsを解離し、Seeding Medium(Formation Medium + 10 µM Rhoキナーゼ阻害剤(ROCKi))を用いてAggreWell™800プレートに3×10⁶細胞/ウェルの密度で播種しました。培養はFormation Mediumで毎日給餌されました。6日後、オルガノイドをExpansion Mediumを用いて6ウェルプレートに移し、70 RPMの軌道振とう(INFORS HT Celltron)で培養を継続しました。25日目までは2〜3日ごとにオルガノイドをExpansion Mediumで給餌し、その後43日目まではDifferentiation Mediumで培養しました。43日目以降はMaintenance Mediumで2〜3日ごとに給餌を行い、60日目に神経オルガノイドを輸送し、以降もMaintenance Mediumで給餌を継続いたしました。
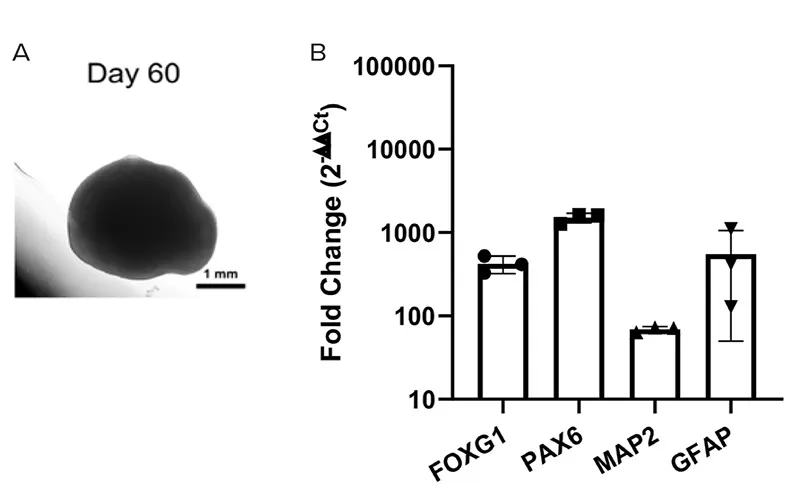
図3. (A) STEMdiff™ Dorsal Forebrain Organoid Kitを用いて作製された60日目の背側前脳オルガノイドの代表的な明視野画像。(B) 60日目の背側前脳オルガノイドに対するRT-qPCR解析。結果は、前脳特異的マーカーFOXG1、前駆細胞マーカーPAX6、神経マーカーMAP2、グリアマーカーGFAPの発現上昇を示しています。結果はLog₁₀(Fold Change:2-∆∆Ct法)として表示されており、平均値 ± 標準誤差(n = 3オルガノイド)で示されています。データはTBPに対して正規化され、未分化のhPSCコントロールと比較されています。
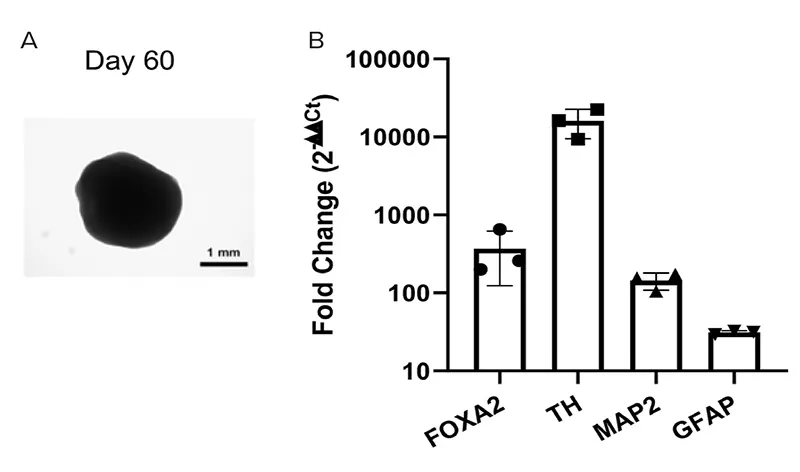
図4. (A) STEMdiff™ Midbrain Organoid Kitを用いて作製された60日目の中脳オルガノイドの代表的な明視野画像。(B) 60日目の中脳オルガノイドに対するRT-qPCR解析。結果は、中脳前駆細胞マーカーFOXA2、ドーパミン作動性ニューロンマーカーTH、神経マーカーMAP2、グリアマーカーGFAPの発現上昇を示しています。結果はLog₁₀(Fold Change:2-ΔΔCt法)として表示されており、平均値 ± 標準誤差(n = 3オルガノイド)で示されています。データはTBPに対して正規化され、未分化のhPSCコントロールと比較されています。
オルガノイドを用いた化合物評価
ハイコンテントイメージングによる細胞生存率および形態への化合物影響の評価
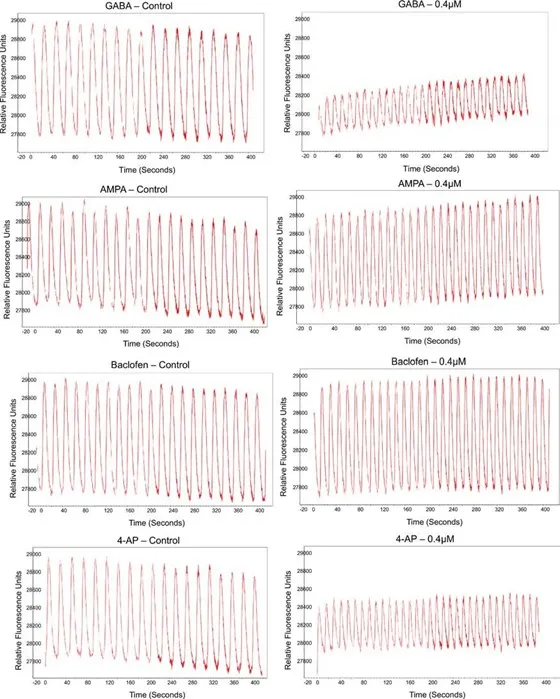
図5. 背側前脳オルガノイドにおけるベースラインのカルシウム振動と薬剤応答。Ca²⁺波形はFLIPR Pentaシステムによる動態カルシウムイメージングで記録され、Peak Pro 2ソフトウェアで解析されました。化合物添加前には安定したベースライン活動が確認され(左パネル)、化合物(4段階濃度、ここでは0.4 µM)添加後には波形パターンが変化しました(右パネル)。
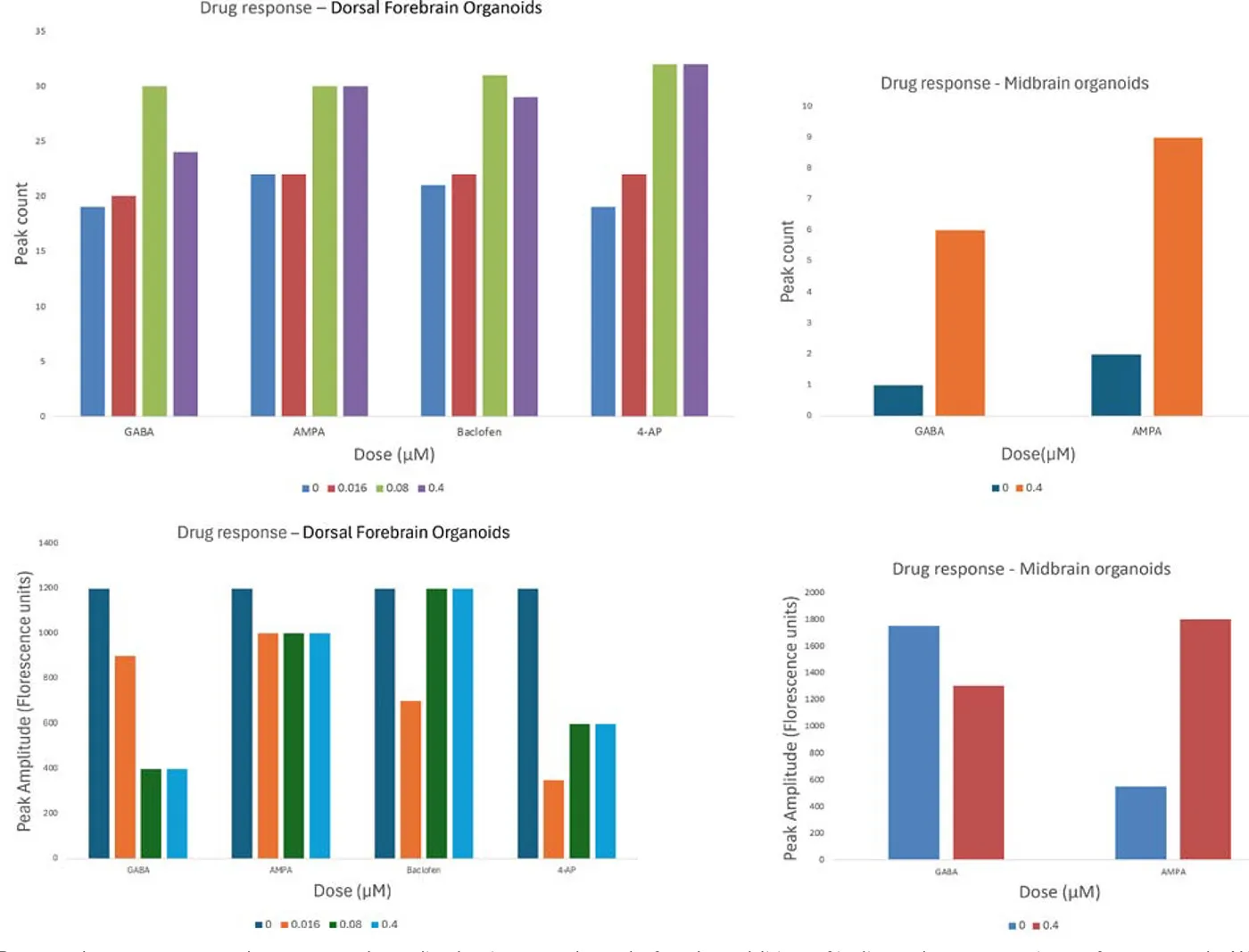
図6. バープロットは、コントロールおよび各濃度の化合物添加後におけるピーク数と振幅を示しています。4-APおよびAMPAの添加によりカルシウム振動の頻度が増加するという予測された表現型応答が確認されました。興味深いことに、GABAおよびバクロフェンは振動の振幅を低下させつつ、頻度に若干の増加をもたらしました。
CellXpress.ai自動細胞培養システムによる自動モニタリングと培地交換
神経オルガノイドの継続的な培養は労力を要するため、CellXpress.ai™自動細胞培養システムを用いた自動イメージングおよび培地交換プロトコールを開発しました。一部のオルガノイドをCellXpress.aiシステムに導入し、96ウェルフォーマットで10日間培養し、24時間ごとにイメージングと培地交換を実施しました。イメージングは透過光で行い、培地交換は液体ハンドラーにより培地の2/3を置換する形で行われました。
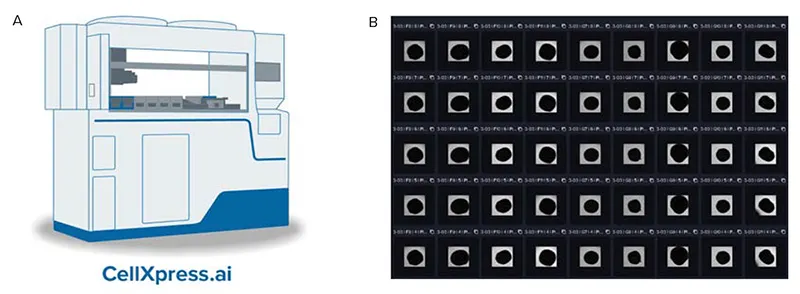
図7. A. CellXpress.ai 自動細胞培養システムの模式図 B. 神経オルガノイドを培養した96ウェルプレートの一部の画像
まとめ
本研究では、ヒト多能性幹細胞(hPSCs)由来の3D神経オルガノイドを用いて、神経毒性および化合物による神経機能への影響を評価する高度なモデルを提示しました。オルガノイドは動態カルシウムイメージングにより解析され、自発的カルシウム振動をリアルタイムで追跡することで、神経ネットワーク活動の指標として機能いたします。FLIPR Pentaハイスループットセルベーススクリーニングシステムを活用することで、カルシウム振動の頻度や振幅の変化など、詳細な機能データを取得し、化合物が神経活動や健康に与える影響を明らかにすることが可能となります。FLIPR Pentaアッセイでは、化合物処理後にカルシウム振動のピーク数および振幅に明確な変化が認められました。通常、GABAおよびバクロフェンは抑制性作用によりピーク数の減少と振幅の増加を引き起こすとされていますが、本研究では予期せぬ傾向が観察され、これらの化合物がピーク頻度をわずかに増加させ、振幅を低下させる結果となりました。これは、神経活動のより複雑な調節機構を示唆するものです。一方、4-APおよびAMPAは濃度依存的にピーク頻度を増加させ、神経興奮性の亢進を示しました。これらのユニークなピークデータは、各化合物が神経ネットワーク動態に与える影響をより深く理解する手がかりとなり、脳機能に対する治療的または毒性的影響の識別に貢献いたします。長期的なオルガノイド培養におけるスケーラビリティおよびスループットの課題に対応するため、本研究ではCellXpress.ai自動細胞培養システムも活用しています。このシステムは、培地交換および日次イメージングといった主要工程を96ウェルプレートフォーマットで自動化し、手作業を削減しつつ最適な培養条件を維持します。FLIPR Pentaによる機能評価とCellXpress.aiによる自動培養管理を組み合わせることで、本統合アプローチは薬剤効果、神経毒性、神経回路の研究において、スケーラブルかつ再現性の高いプラットフォームを提供します。このワークフローは、従来の2Dシステムよりも生理学的に妥当性の高いモデルを用いて、創薬および毒性評価の加速に貢献するものです。
結論
- ヒト多能性幹細胞を用いて作製されたin vitro 3D神経オルガノイドは、神経毒性および各種神経調節因子の神経活性効果を評価するための有用な細胞ベースアッセイを提供します。
- 本アッセイプラットフォームは、化合物の影響評価およびin vitroにおける神経毒性の早期検出において有望であることが示されました。
- 動態カルシウムイメージング解析により、神経オルガノイドの自発的活動が確認され、機能的な神経活動の指標として利用可能であり、表現型変化や化合物の影響評価にも活用できます。
- オルガノイド培養は自動化に適しており、アッセイのスケールアップおよびスループット向上が可能です。
PDF版(英語)