Application Note MetaXpressおよびAcuityXpressソフトウェアとTransfluorアッセイシステムを用いた
GPCR活性化のハイコンテントスクリーニング
PDF版(英語)
Susan Catalano, Ph.D(アキュメン・ファーマシューティカルズ)、Sylvia de Bruin, Joe Bosworth, Ph.D., Neal Gliksman, Ph.D., Kimberly Best, Ph.D. and Paula Rickert, Ph.D.(モレキュラーデバイス)
はじめに
Gタンパク質共役型受容体(GPCR)は医薬品の標的として最も大きなクラスであり、その結果、GPCR受容体のアゴニストやアンタゴニストを検出するためのアッセイはスクリーニング業務において重要な役割を担っています。最近、Xsira Pharmaceuticals社は、GPCRの脱感作とリサイクリングを測定することによりGPCRの活性化をモニターする新規のハイコンテントアッセイであるTransfluor®アッセイを発表しました。Transfluor Assayは現在、モレキュラーデバイスから独占的に入手可能です。
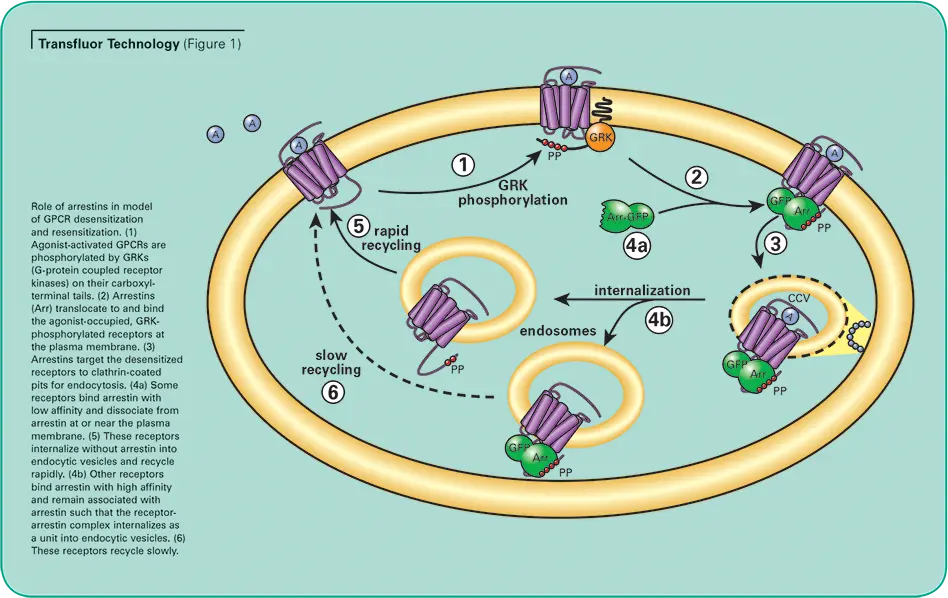
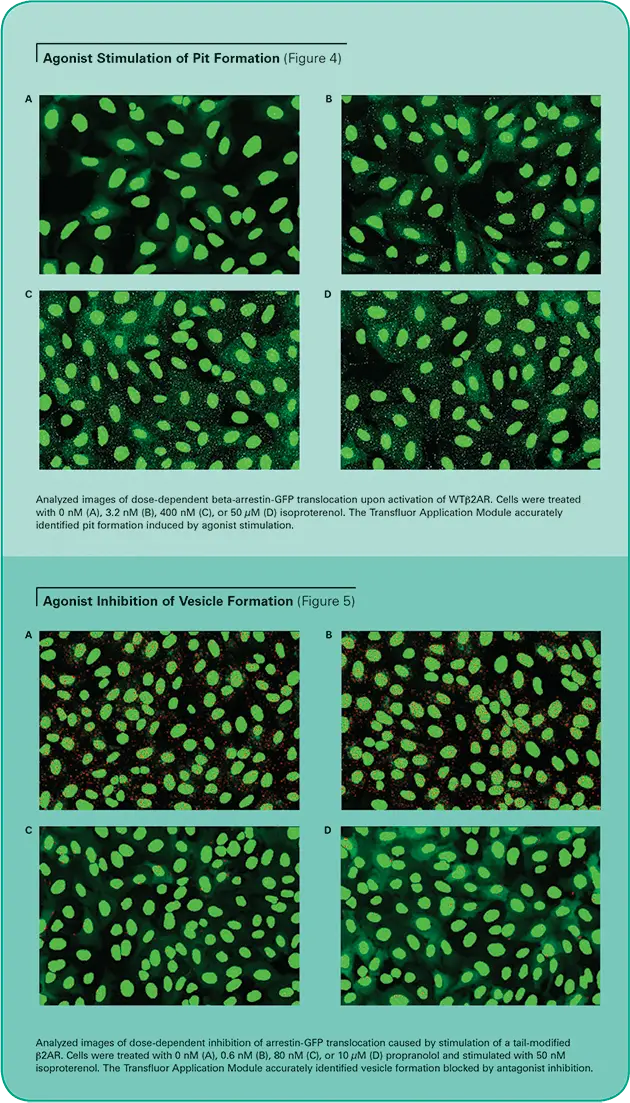
90以上の異なるGPCRで検証されたTransfluorアッセイは、事実上すべてのGPCRとGタンパク質のクラスを代表するすべてのGPCRに共通する、下流のGタンパク質シグナル伝達とは独立した共通の経路を使用します。このアッセイは、活性化後に目的の受容体と会合するGFPタグ付きβ-アレスチンの内在化を画像解析で定量します(図1参照)。
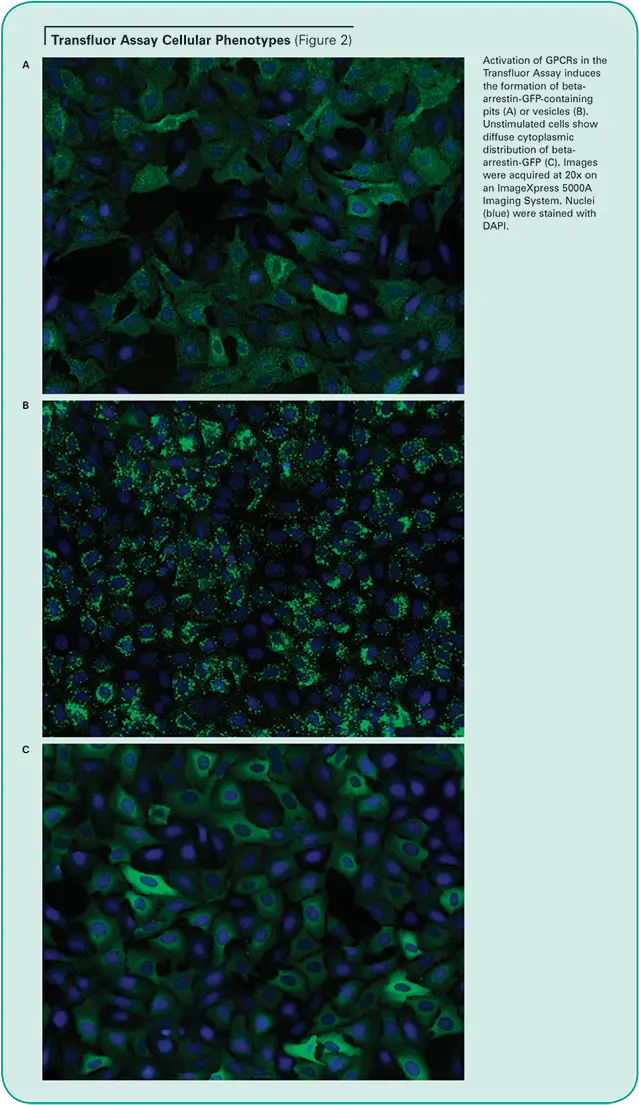
刺激されていない細胞は、細胞質にβ-アレスチン-GFPの蛍光が散在しています。過剰発現されたGPCRが活性化されると、β-アレスチンはレセプターを標的として内在化し、その結果、小さな蛍光を発するクラスリンコートピットが出現します。受容体がβアレスチンに対して高い親和性を持つ場合、細胞はその後、ピットよりも大きく明るい蛍光エンドサイトーシス小胞を形成します。(Transfluor Assayは、GPCR活性化の下流で起こる生理学的事象の機能的測定法として、多くの医薬品創薬業務において、一次および二次スクリーニングとして広く採用されています(図2参照)。
MetaXpress®画像取得・解析ソフトウェアは、ImageXpress® 5000AおよびDiscovery-1™インストゥルメントを含むモレキュラーデバイスのすべてのハイコンテントスクリーニングシステムでTransfluorアッセイの画像取得と解析を完全に自動化します。オプションのアプリケーションモジュールは、一般的なハイコンテントアッセイのアッセイ特異性ターンキー解析を提供します。このアプリケーションノートで説明するTransfluorモジュールは、Transfluorアッセイからの画像を解析するために特異的に設計され、最適化されています。
MetaXpress®ソフトウェアは、画像、細胞ごとのセグメンテーション結果、アノテーションを管理するためのエンタープライズレベルのMDCStore™データベースと統合されています。AcuityXpress Cellular Informatics PlatformもMDCStoreデータベースとシームレスに統合されており、カーブフィット処理、アッセイクオリティの評価、ヒット、偽陽性、異常値、トレンドの同定のための強力なデータ可視化および統計ツールを提供します。MetaXpress®、AcuityXpress®ソフトウェアとTransfluor Assayを併用することで、スクリーニングの可能性を高め、GPCRモジュレーターを迅速に発見することができます。
カスタムセルバイセル解析
MetaXpress®画像解析ソフトウェアには、セグメンテーションパラメーターを簡単かつインタラクティブに最適化するために設計されたアッセイ特異性アプリケーションモジュールがオプションで含まれています。簡素化されたインターフェースにより、特定のアッセイに合わせた解析設定の簡単な設定とテストが可能です。(図3、パネルA参照)。
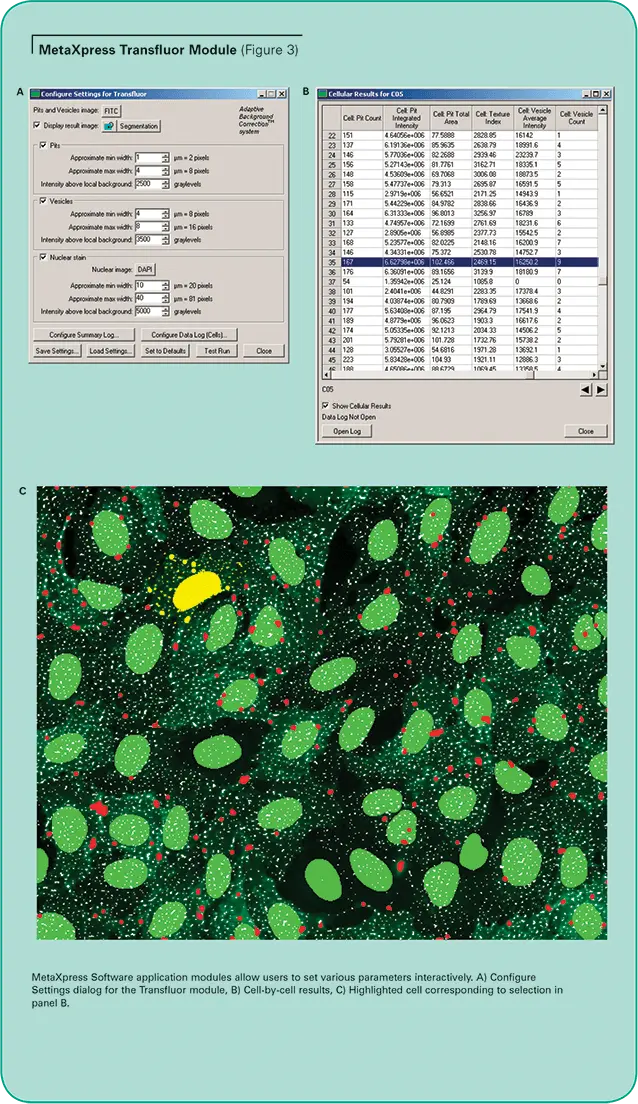
MetaXpress Transfluorモジュールは、特許取得済みのAdaptive Background Correctionシステムを使用して、ピット、小胞、核を周囲から区別するため、染色やタンパク質発現レベルにばらつきがあっても、選択的に測定・カウントすることができます。ピットの強度はバックグラウンドよりわずかに高いことがあり、GFPタグ付きβ-アレスチンの発現レベルは細胞によって異なることがあるため、これは通常の閾値処理法では難しいです。
Transfluorデータの細胞間解析用に設計されたTransfluorモジュールを使えば、ピットと小胞を同時に検出し、区別することができます。オプションの核検出は、データ正規化のための正確なセルカウントを提供します。画像解析には、ユーザーが調整可能な3つのパラメーターが利用されます。おおよその最小幅 "と "おおよその最大幅 "パラメーターは、ピット、小胞または核の予想されるサイズに応じて必要に応じて変更されます。Intensity above local background "パラメータは、各ピットまたは小胞をローカルバックグラウンドから最適に識別するために調整されます。これにより、画像内のセル間で強度が異なる場合でも、実際のピットや小胞形成を識別し、正確に定量化する能力が大幅に向上します。
ピットまたは小胞の数、ピットまたは小胞に覆われた総面積、顆粒の平均および積分強度、核の面積および強度など、複数の測定値をデータベースに記録できます。結果は細胞ごとに提供されるほか、画像や部位ごとに要約されます。細胞結果の表の行をハイライトすると、対応する細胞とオーバーレイが画像内で即座にハイライトされます。(図3のパネルBとCを参照)。
材料
注意:すべての溶液は、各実験の直前に新しく調製してください。
- β-アレスチン-GFPおよびβ2-アドレナリン受容体(β2AR)発現U2OS細胞(モレキュラーデバイス)
- Corning Costar 384ウェルマイクロプレート
- U2OS培地 10%熱不活性化FCS(Gibco)、10 µg/mLゲンタマイシン(Gibco)、10 mM HEPES(Gibco)、0.4 mg/mL Zeocin(Gibco)および0.4 mg/mL G418(Gibco)を添加したMEM(Gibco)
- アスコルビン酸培地: 5.7mMのアスコルビン酸溶液(L-アスコルビン酸ナトリウム、SIGMA )
- イソプロテレノール原液 アスコルビン酸培地中の(-)-イソプロテレノール(+)-酒石酸塩の175 µMストック溶液(SIGMA)
- プロプラノロール原液: (s)-(-)-プロプラノロール塩酸塩(SIGMA)の125 µM溶液、血清および抗生物質不含培地(10 mM HEPESを含むMEM)
- DPBS(SIGMA)
- 4%メタノールフリーホルムアルデヒド:16%メタノールフリーホルムアルデヒド(Polysciences)
- DAPI、希釈液(Molecular Probes)
方法
アゴニスト用量反応アッセイ
ステップ1. 25μLのU2OS培地に4,500個/ウェルの細胞をプレーティング。37℃、5% CO2で一晩培養します。
ステップ2. アスコルビン酸培地でイソプロテレノール原液の5倍連続希釈を10回行い、3.5倍イソプロテレノール用量反応溶液の11点系列を形成します。陰性対照としてアスコルビン酸培地のみを使用します。(表1参照)。
| 3.5X Concentration | Final Concentration |
|---|---|
| 175 µM | 50 µM |
| 35 µM | 10 µM |
| 7 µM | 2 µM |
| 1.4 µM | 400 nM |
| 280 nM | 80 nM |
| 56 nM | 16 nM |
| 11.2 nM | 3.2 nM |
| 2.2 nM | 640 pM |
| 448 pM | 128 pM |
| 89.6 pM | 25.6 pM |
| 17.9 pM | 5.1 pM |
| 0 µM | 0 µM |
1. アゴニスト用量反応アッセイに必要なイソプロテレノール3.5倍溶液の濃度
ステップ3. 適切なイソプロテレノール3.5X用量反応溶液または陰性コントロールを各ウェルに10μLずつ加えます。
ステップ4. 37℃、5% CO2で40~45分間(小胞形成剤)または30分間(ピット形成剤)インキュベートします。
アンタゴニスト用量阻害アッセイ
ステップ1. 23μLのU2OS培地に4,500個/ウェルの細胞をプレーティングします。37℃、5% CO2で一晩培養します。
ステップ2. 175μMイソプロテレノールストックをアスコルビン酸培地で1:1000に希釈し、175nM 3.5Xイソプロテレノール刺激液を調製します。
ステップ 3. プロプラノロール原液をHepes入りMEMで10回5倍連続希釈し、一連の12.5倍プロプラノロール用量阻害溶液とします。陰性対照としてMEM/Hepesのみを用います。(表2参照)。
| 12.5X 濃度 | 最終濃度 |
|---|---|
| 125 µM | 10 µM |
| 25 µM | 2 µM |
| 5 µM | 400 µM |
| 1 µM | 80 nM |
| 200 nM | 16 nM |
| 40 nM | 3.2 nM |
| 8 nM | 640 nM |
| 1.6 nM | 128 pM |
| 320 pM | 25.6 pM |
| 64 pM | 5.1 pM |
| 12.8 pM | 1.0 pM |
| 0 µM | 0 µM |
2. アンタゴニスト用量阻害アッセイに必要なプロパノール12.5倍溶液の濃度
ステップ4. 各ウェルに適切な12.5Xプロプラノロール用量阻害溶液または陰性対照を2 µL加えます。
ステップ5. 37℃、5% CO2で30分間インキュベートします。
ステップ6. 175nMイソプロテレノール刺激液またはアスコルビン酸培地(非刺激対照)を各ウェルに10μLずつ加えます。
ステップ7. 37℃、5% CO2で40~45分間(小胞形成細胞)または30分間(ピット形成細胞)インキュベートします。
サンプルの固定と染色
ステップ1. 各ウェルに35µLの4%メタノールフリーホルムアルデヒドを添加してアッセイを停止します。蓋をし、室温で45分間インキュベートします。
ステップ 2. 各ウェルを50µLのDPBSで洗浄します。
ステップ3. 各ウェルに0.05mg/mL DAPIを8μLずつ添加します。室温で15分間インキュベートします。
ステップ4. 75 µL DPBSでウェルを2回洗浄し、75 µL DPBSに残します。
ステップ5. プレートをプレートシールで覆い、画像取得まで遮光して4℃で保存します。
画像取得
ステップ1. MetaXpress®ソフトウェアを使用し、DAPIおよびFITCフィルターセットと20x Plan FluorまたはPlan Fluor ELWD対物レンズを用いて、ImageXpress 5000AまたはDiscovery-1イメージングシステムで非ビニング画像を取得します。ここに記載した結果は、1ウェルあたり2部位をイメージングしたものです。
画像解析
ステップ1. MetaXpress®ソフトウェアで、データベースから目的の画像を取り出し、Transfluor Assay Application Moduleで解析します。ピット/小胞染色と核染色の両方について、適切なソース画像、最小幅と最大幅、ローカルバックグラウンド以上の強度を選択します。
ステップ2. AcuityXpressソフトウェアで、プレートに適切な化合物と濃度を注釈します。
ステップ3. 目的のプレートを封入したデータセットを作成し、カーブフィット処理を行って各化合物のEC50値とIC50値を求めます。
アッセイ結果
β-アレスチン-GFPとwild-type β2AR(ピット形成因子)またはenhanced β2AR(小胞形成因子)を発現するU2OS細胞を、イソプロテレノール(アゴニスト)またはプロプラノロール(アンタゴニスト)で処理しました。enhanced β2ARは、β-アレスチンとの親和性を高めるために修飾されたC末端テールがあり、蛍光小胞の形成を引き起こしました。
画像は上記のようにImageXpress 5000Aシステムで取得し、Transfluorアプリケーションモジュールで解析しました。同様の結果がDiscovery-1システムでも得られました(データは示さず)。モジュールの精度を図4(ピット表現型)と図5(小胞表現型)に示します。この画像は、様々な濃度のアゴニスト・イソプロテレノールで刺激された細胞について、アルゴリズムがどちらの表現型でもピットと小胞を適切に同定していることを示しています。非刺激細胞は、最小限のピットや小胞を示します。
用量反応と用量阻害の解析
ピット形成細胞株と小胞形成細胞株の両方において、アゴニストであるイソプロテレノールの用量反応とアンタゴニストであるプロプラノロールの用量阻害を、MetaXpress®ソフトウェアTransfluorアプリケーションモジュールを用いて測定しました。各用量は、6つの複製ウェルにわたって実行されました。図6は、AcuityXpressソフトウェアによって作成されたプレートのヒートマップで、アッセイの用量依存的な反応を示しています。
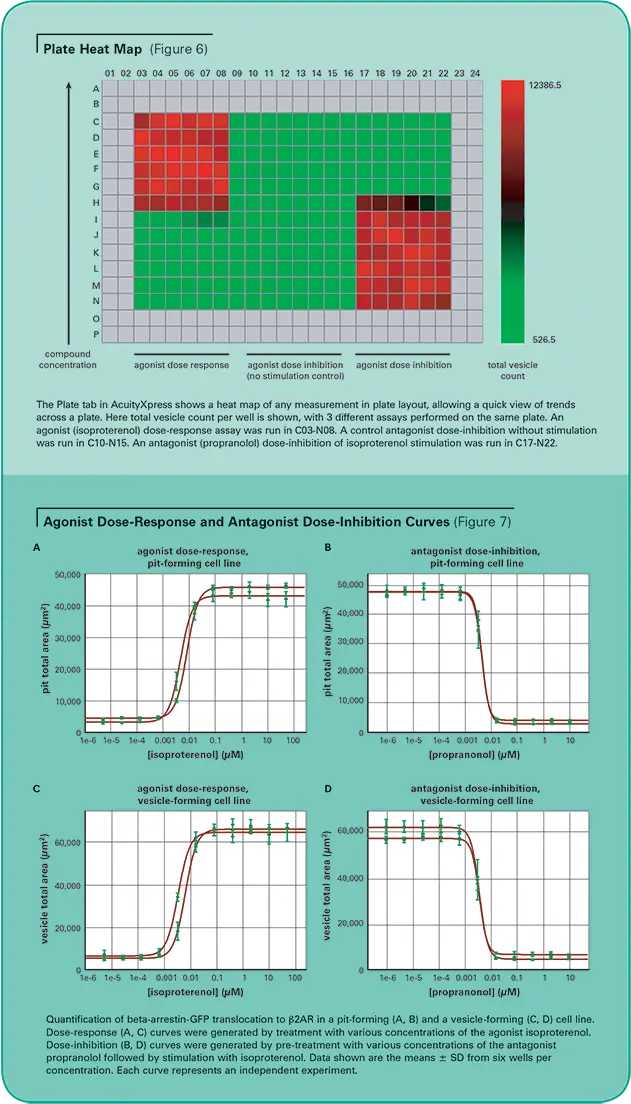
EC50およびIC50の計算では、プレート上のすべてのレプリケートウェルで平均した細胞あたりのピットまたは小胞面積を化合物濃度に対してプレーティングし、ヒルカーブフィット処理を行いました。AcuityXpressは、必要に応じて複数の化合物および複数のプレートを含むデータセット全体のカーブフィット処理を自動的に生成します(図7参照)。(表3は、2つの独立した実験から得られた両細胞株のアゴニストEC50とアンタゴニストIC50の要約です(図7参照)。これらの値は、イソプロテレノールによるβ2アドレナリン受容体の刺激(EC50=1-10 nM)、およびプロプラノロールによる拮抗作用(IC50=0.5-5 nM)に関する文献2の報告とよく一致しています。
| イソプロテレノール EC50 (nM) | プロプラノロール IC50 (nM) | |
|---|---|---|
| ピット表現型 | ||
| 実験1 | 4.7 | 4.3 |
| 実験2 | 8.1 | 4.3 |
| 小胞表現型 | ||
| 実験1 | 3.4 | 3.7 |
| 実験2 | 6.3 | 3.7 |
表3. β2-アドレナリン受容体刺激および阻害のEC50およびIC50の測定値
アッセイの統計的サマリー
アッセイ品質の指標であるZ' factorは、データのばらつきとシグナルのダイナミックレンジの両方を反映します。本実験で測定されたZ' factorは0.6以上であり、細胞ベースイメージングアッセイとして望ましい範囲内にあります。
| 表4. アゴニスト刺激とアンタゴニスト阻害のZ'統計的要約 | ||
|---|---|---|
| アゴニスト用量反応 Z' | アゴニスト用量阻害 Z' | |
| ピット表現型 | ||
| 実験1 | 0.8 | 0.9 |
| 実験2 | 0.9 | 0.8 |
| 小胞表現型 | ||
| 実験1 | 0.8 | 0.8 |
| 実験2 | 0.7 | 0.9 |
表4. アゴニスト刺激とアンタゴニスト阻害のZ'統計的サマリー
ディスカッション
MetaXpress®ソフトウェア Transfluorアプリケーションモジュールは、Transfluorアッセイにおいて、活性化GPCRへのβ-arrestinGFPトランスロケーションによって形成されるピットと小胞のセル同定と測定に成功した。野生型と高産生なβ2アドレナリン受容体を用いた独立した実験では、高いZ' factorで一貫したEC50とIC50値が得られました。これらの結果は、MetaXpress®ソフトウェアによって解析されたTransfluorアッセイが、GPCR活性化のための非常にロバスト性と再現性の高いアッセイであることを示しています。
MetaXpress®ソフトウェアとAcuityXpress®ソフトウェアの迅速なデータ取得、解析、可視化機能は、Transfluor Assayの普遍性と相まって、GPCRモジュレーターのスクリーニングにユニークで強力なアプローチをご提供します。
参考文献
- Oakley, R.H., Hudson, C.C., Cruickshank, R.D., Meyers, D.M., Payne, R.E. Jr., Rhem, S.M., Loomis, C.R. The cellular distribution of fluorescently labeled arrestins provides a robust, sensitive, and universal assay for screening G-protein-coupled receptors. Assay Drug Devel Tech 2003;1:21–30.
- Oakley, R.H., Laporte, S.A., Holt, J.A., Barak, L.S., Caron, M.G. Association of beta-arrestin with G-protein-coupled receptors during clathrin-mediated endocytosis dictates the profile of receptor resensitization. J Biol Chem 1999;274:32248–32257.
- Zhang, J.H., Chung, T.D., Oldenburg, K.R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J Biomol Screen 1999;4:67–73.
PDF版(英語)