Application Note 連続フロー型マイクロフルイディクスプレートを用いた
ハイスループットイメージング技術
- マイクロフルイディクスチャネルを活用し、臓器や生体組織系における流体の挙動をモデル化
- 96ウェルフォーマット内の深さの異なるウェルに対して、焦点の合った画像を一括取得
- リアルタイムでの流体の流れ、動的な細胞培養応答、区画間シグナル伝達をモニタリング
PDF版(英語)
はじめに
in vivo環境をより忠実に再現する細胞ベースアッセイへの継続的なニーズに応え、毛細管チャネルを利用して生理学的に関連する流体の流れを培養細胞に供給する革新的な細胞培養システム「SciFlow™ 1000 Fluidic Culture System」が開発されました。本アプリケーションノートでは、この新規培養システムのウェルをImageXpress® Micro ハイコンテントイメージングシステムで高精度に撮像し、細胞毒性曝露の動態を可視化・定量化する能力について紹介します。
SciFlow 1000システム(図1)は、SBSフォーマットに準拠した96ウェルデバイスであり、プレートリーダー、イメージングシステム、自動液体分注システムとの互換性を備えています。効率的な流体の流れを実現するために、ウェルの高さが左から右へと段階的に低くなるよう設計されており、各ウェルの底面は隣接するウェルより500 µmずつ低くなっています(z軸方向の高さ変化)。これにより、外部ポンプやチューブを使用せずに、システム全体で流体のカスケード流が可能になります。
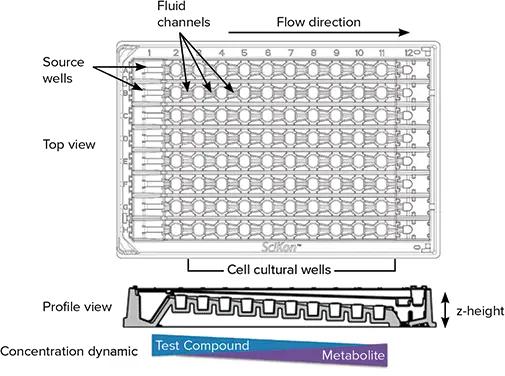
図1. SciFlow 1000システムの特徴:SciFlowの上面および側面図は、流体設計とマルチウェル構造の主要な特徴を示しています。側面図では各ウェルのz軸高さの違いに注目してください。試薬を供給ウェル(第1カラム)に添加することで、連続的な曝露が隣接ウェルに伝播し、化学物質濃度の勾配とともに代謝物や細胞応答がウェル列全体にわたって変化します。
ただし、プレート全体にわたるz軸高さの変化は、多くのイメージングシステムにとって、各ウェルでの焦点位置の正確な設定が困難であるという課題をもたらします。本アプリケーションノートでは、ImageXpress Microシステムが最大4000 µmの垂直範囲にわたって焦点位置を動的に適応させ、定量解析に適した鮮明な画像を迅速に取得できることを示します。
使用材料
- SciFlow 1000 Fluidic Culture System (SciKon)
- HepaRG細胞(Triangle Research Labs)
- 培地 MH100、MHTAP、MHMET (Triangle Research Labs)
- CellTox™ Green(Promega)
- Hoechst DNA Dye(Sigma)
- タモキシフェン(Sigma)
- フルオレセイン塩(Sigma)
- 装置 ImageXpress Micro ハイコンテントイメージングシステム(モレキュラーデバイス)
ImageXpress Microシステムを用いた焦点位置の最適化手法
各ウェルのz軸焦点位置を決定するために、SciFlow 1000システムにHepaRG細胞を播種し、Hoechstによる核DNA染色を行って解析しました。システムにおけるz軸高さの調整値は表1に示されており、カラム7がシステム中央の基準点(ゼロ参照点)として、撮像時のレーザーオートフォーカス設定に使用されました。
実験概要
本手法のワークフロー(図3)は、HepaRG細胞へのタモキシフェン処理の実験設計(図2)を示しています。HepaRG細胞は50 µLの培地で播種され、細胞が接着した後、細胞毒性インジケーターCellTox™ Greenを1:2000に希釈した培地と、Hoechst(0.5 µg/mL)を含む培地(100 µL/ウェル)に交換しました。次に、CellTox Greenを含む培地400 µLを供給ウェルに添加しました。プレートは30分間インキュベートされ、流体の流れを活性化し、マイクロフルイディクスチャネルの接続を促進しました。チャネルが完全に接続された後、試験化合物、ビークルコントロール、または1 µMフルオレセイン(流体トレーサーコントロール)をそれぞれの供給ウェルに100 µL添加しました。複数日にわたって流体の流れを維持するため、カラム11のウェルから100 µLを手動で除去し、新たな薬剤、ビークル、またはフルオレセイン標準液を1日3回供給ウェルに追加しました。これにより、4日間で培地が完全に入れ替わり、各処理群に対して試薬が継続的に供給されました。
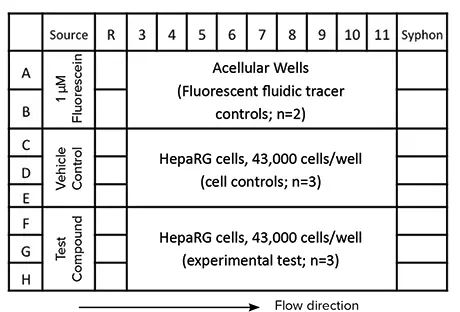
図2. SciFlow 1000システムの実験レイアウト例 単一のSciFlow 1000システムにおける実験レイアウトを示しています。細胞の播種と接着(50 µL)はカラム3〜11で行い、その後ウェル容量を100 µLに増加させることでウェル間の流体接続が可能になります。最後に、試験化合物をカラム1の供給ウェルに添加します。

図3. 手法のワークフロー
可変ウェル深度に対応するZ軸焦点調整を用いた自動イメージング
Hoechst(全細胞)およびCellTox Green(死細胞)による染色は、複数の時点でプレート全体を撮像することでモニタリングされました。化合物添加前と、その後4日間にわたる12回の時点でプレートを読み取りました。撮像の合間には、プレートをインキュベーター内に保管することで環境制御を維持しました。取得した画像は、MetaXpressソフトウェアのLive Deadアプリケーションモジュールまたはカスタムアプリケーションモジュールを用いて解析し、細胞生存率を定量化しました。
SciFlow 1000システムは、96ウェル培養フォーマットに類似した構成を持ち、隣接するカラム間で500 µmずつのz軸ステップを設けることで、カラム3から11の間で最大4 mmのz軸高さ変化を生じさせています(表1参照)。SciFlow 1000システムでは、流体が能動的に流れ、ウェル間でリアルタイムのシグナル伝達が起こるため、プレート全体を迅速にイメージングできることは大きな利点です。これは、時間的な毒性物質濃度勾配や親化合物と代謝物の相互作用によって引き起こされます。ImageXpress Microシステムはワイドフィールドモードで使用され、レーザーオートフォーカス(4X)および必要に応じて画像ベースのオートフォーカス(20X)を活用することで、SciFlow 1000システム全体にわたる大きなz軸高さ変化に対応しました。ImageXpress Microシステムでは、72ウェル(1視野/ウェル)を4Xで90秒、20Xで5分でイメージングしました。20Xでのイメージングには画像ベースのオートフォーカスが使用されました。
| SciFlow 1000 System z-height adjustments | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Column | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| microns | + 2000 | + 1500 | + 1000 | + 500 | 0 | - 500 | - 1000 | - 1500 | - 2000 |
表 1. ImageXpress Microシステムを使用したSciFlow 1000システムのZ高さ
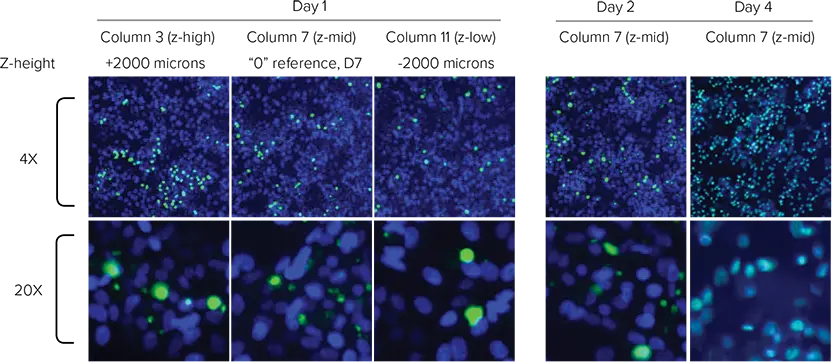
図4. 4Xおよび20Xでの細胞イメージング 青:全細胞、緑:死細胞。(左)Day 1:タモキシフェン流入開始前のRow D(ビークルコントロール)における濃度勾配。(右)Day 2〜4:Row Gにおけるタモキシフェン曝露のリアルタイム動態(濃度と時間の関係)。
まとめ
ハイコンテントイメージングの未来は、より複雑で生理学的に関連性の高い培養フォーマットへの対応能力にあります。非標準フォーマットのイメージングは、ワークフローの柔軟性を高めるとともに、研究ニーズに応える高品質な画像を提供します。SciFlow 1000 Fluidic Culture Systemはそのようなフォーマットの一例であり、リアルタイムの流体の流れ、直接的な細胞培養応答、区画間(ウェル間)での動的な細胞応答のシグナル伝達をモニタリングすることが可能です。ImageXpress Microシステムは、SciFlow 1000のような可変z軸高さフォーマットのプレートにも対応可能であることを示しました。4 mmを超えるz軸高さ変化にわたって自動イメージングを実現し、高品質かつ再現性の高いデータを迅速に取得することができました。
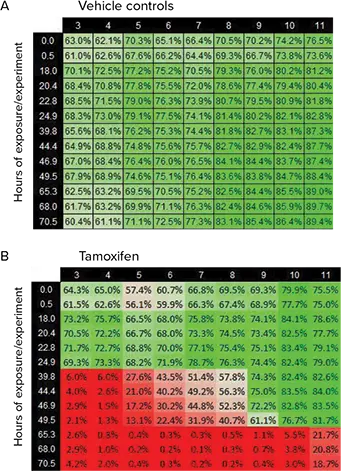
図5. タモキシフェンによる細胞毒性の測定 表データは、SciFlow 1000システムの各Rowにおける細胞生存率を示しています。表のカラムは、SciFlow 1000システムの対応するカラム(3〜11)を表し、表のRowは実験が測定された各時点を示しています。値はすべて4Xイメージングから取得されました。(A) この表は、ビークルコントロール細胞の生存率を時間経過に沿って示しています。値はRow C、D、Eの平均です。(B) この表は、タモキシフェン処理群の細胞生存率を示しています。値はRow F、G、Hの平均です。
PDF版(英語)