Application Note 均一型ハイスループットライブセルGPCR結合アッセイ
PDF版(英語)
ライブセルスクリーニングのために

はじめに
モレキュラーデバイスは、蛍光測定を用いてマルチウェルプレート内の細胞を多項目でスクリーニングするための強力な新しいプラットフォーム「ImageXpress® Velos システム」を開発しました。ImageXpress Velos システムの光学系は、検出領域をサンプル面近傍に限定することで、接着した生細胞からの蛍光シグナルのみを効率的に収集し、バックグラウンド蛍光を低減して、細胞結合シグナルの測定精度を向上させます。本システムは、フォーカス調整を必要とせず、10 µmの解像度でプレート全体を120秒以内にスキャン可能です。これらの特長により、ImageXpress Velos システムはハイスループットなライブセル結合アッセイに最適なプラットフォームとなっています。
本レポートでは、ImageXpress Velos システムのレーザースキャンプラットフォームを用いて、Cy3標識テレンゼピン(Cy3-TP)とM1ムスカリン性アセチルコリン受容体を発現するCHO細胞とのライブセル結合アッセイを実施しました。選択性の評価にはアトロピンを用い、GPCR(Gタンパク質共役受容体)ファミリーに属するこの重要な受容体に対するCy3標識非ペプチドリガンドの特異的結合、競合、置換を確認しました。
アッセイ手順
細胞播種およびCy3-TP結合アッセイ アッセイは、黒色壁付き96ウェルPackard Viewプレートを用いて実施しました。プレートには、M1ムスカリン性アセチルコリン受容体を発現するCHO細胞(Amgen社提供)を播種し、使用前に37℃・5% CO₂インキュベーターで培養しました。結合反応は室温で行いました。
オンレート測定 オンレート解析では、細胞に40 µLの結合バッファー(アトロピンあり/なし)を添加後、10 nM最終濃度となるように40 µLのCy3-TPを添加しました(アトロピンの最終濃度は1 µM)。プレートは、最初の30分間は5分ごとに、その後135分まで10分ごとにスキャンしました。
Cy3-TP結合の選択性評価 細胞にアトロピンを含む40 µLを添加後、8 nMのCy3-TPを含む40 µLを追加し、最終濃度4 nMで競合アッセイを実施しました。60分間の結合反応後にスキャンを行いました。
Cy3-TP結合の検出 ImageXpress Velos システムは、Ch3チャネル(560–610 nm、オレンジ帯域パスフィルター)を用いてCy3蛍光を1チャネルで取得するように設定されました。画像取得は5 × 5 µmのサンプリングで行い、96ウェルプレート全体をスキャンしました。
ライブセル染色とCMFDA検出 ライブセル蛍光色素5-クロロメチルフルオレセインジアセテート(CMFDA)(Invitrogen社製)を0.1 µMで使用し、結合反応後の細胞を染色しました。CMFDAの2倍濃度溶液をバッファー中に調製し、各ウェルに80 µL添加して最終体積160 µL/ウェル、最終濃度0.1 µMとしました。室温で30分間インキュベート後、Ch1チャネル(510–540 nm、緑色帯域パスフィルター)でスキャンしました。画像取得は5 × 5 µmのサンプリングで行いました。
結果と考察
オンレート結果 細胞は1ウェルあたり5,000細胞で播種し、選択されたウェルに結合バッファー(アトロピンあり/なし)を40 µL添加後、10 nMのCy3-TPを含む40 µLを追加しました。ImageXpress Velos システムを用いて、均一型フォーマットで複数のタイムポイントにおいてスキャンを実施しました。図1(上段)には、10 nM Cy3-TPでインキュベートした細胞の結合タイムコースの代表的な画像を示しています。Cy3-TPのシグナルは、各ウェル中央に直径4 mmの関心領域(ROI)を設定し、その中でCy3シグナルの閾値処理を行い、総蛍光量を積算し、背景シグナル(閾値以下の領域)を差し引くことで評価しました。その結果、アトロピン非添加(陽性対照)と1 µMアトロピン添加(陰性対照)との間で明確なシグナルの差異が観察され、10 nM Cy3-TPを用いた結合反応において優れた識別性が得られました(図1)。
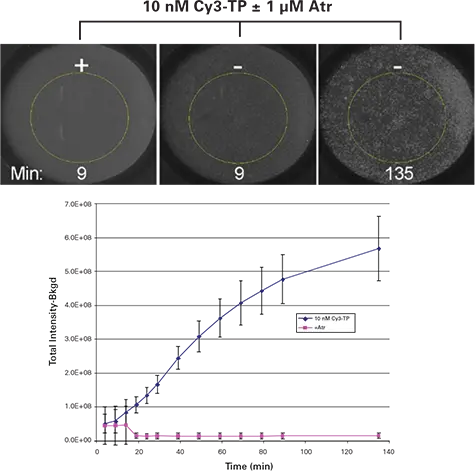
図1.
上段:ImageXpress Velos システムによる、Cy3-TPの均一型結合アッセイの画像。各ウェルには異なる濃度のCy3-TPが添加されています。黄色の円は、画像解析に使用された直径4 mmの関心領域(ROI)を示しています。下段グラフ:Cy3-TPの均一型結合アッセイの結果。各条件における4ウェルの平均値および標準偏差を示しています(Atr = アトロピン)。
Cy3-TP結合の選択性 Cy3-TPの均一型結合アッセイにおけるアトロピン濃度依存性を評価しました。アトロピン濃度に応じた明確な傾向が観察されましたが、低濃度アトロピンでのシグナル飽和は見られませんでした。これは、細胞数に基づく正規化手法の導入が、結合アッセイの精度向上に有効であることを示唆しています。細胞数に基づく正規化のため、細胞を3.7%ホルムアルデヒドを含むPBSで固定し、**\( \frac{0.1\,\mathrm{µg}}{\mathrm{mL}} \)のプロピジウムヨウ化物(PI)**で染色しました。プレートをスキャンし、650 nmロングパスフィルターを用いてPIシグナルを別チャネルで取得しました。これにより、Cy3シグナルとの明確な識別が可能となりました。PIシグナルに基づいて細胞を閾値処理で同定し、背景を差し引いたCy3の平均シグナルを算出しました。これにより、ウェル全体における正規化されたCy3-TP結合シグナルが得られました。図2には、10段階のアトロピン濃度およびブランク(視認性のため0.016 nMとしてプロット)の応答曲線を示しています。
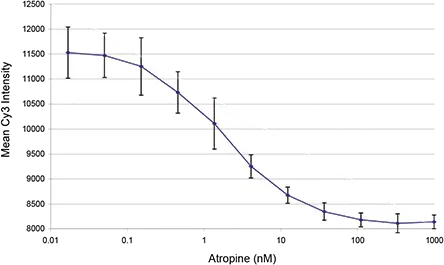
図2.
固定・染色細胞を用いたCy3-TP結合アッセイにおけるアトロピン濃度応答曲線。各条件における8ウェルの平均値および標準偏差を示しています。アトロピン無添加のコントロールは、視認性のため0.016 nMとしてプロットされています。
CMFDA染色による細胞数正規化 より効率的な正規化手法として、2倍濃度のCMFDAを含むバッファーを等量添加するワンステップ法を検証しました(図3)。結合反応後、細胞を0.1 µMのCMFDAで室温30分間染色し、510–540 nmのバンドパスフィルターを用いて別チャネルでCMFDAシグナルを取得しました。図3に示すように、CMFDAシグナルに基づいて細胞を閾値処理で同定し、背景を差し引いたCy3シグナルの平均値をROI内の細胞数で正規化することが可能となりました。
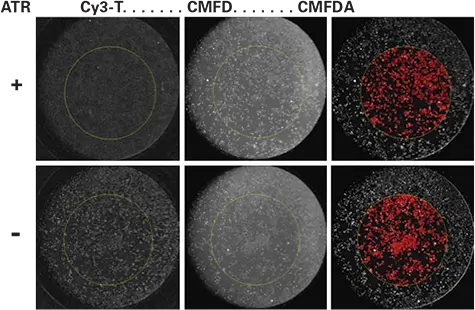
図3.
Cy3-TP結合の細胞数正規化。上段は2 µMアトロピン処理ウェル、下段はバッファーのみのウェル(いずれもCy3-TP添加前)。結合反応の最終濃度は、アトロピン1 µM、Cy3-TP 4 nM。左:結合反応後に取得したCy3-TP画像。中央:CMFDAで染色後、画像処理前の状態。右:画像処理後のCMFDA染色画像。赤色は、4 mmのROI内で閾値処理された細胞を示しています。この面積値を用いてCy3-TP結合量を正規化しました。
オフレート解析結果 オフレート解析は、1ウェルあたり2,500細胞で播種した細胞を用いて実施しました。細胞を4 nMのCy3-TPで1.5時間インキュベートした後、100 nMアトロピンからの1:3連続希釈系列を添加しました。均一型フォーマットで2時間にわたりデータを取得し、5分時点を基準としたCy3-TPシグナルの変化率を算出しました。その結果、アトロピン濃度の上昇に伴い、Cy3-TPシグナルの減少率が増加することが確認されました。高濃度アトロピンでは、Cy3-TPシグナルの直線的な減少傾向が観察されました(データ未掲載、論文準備中)。
結論
本レポートでは、ImageXpress Velos システムのレーザースキャンプラットフォームを用いて、M1ムスカリン性アセチルコリン受容体を発現するCHO細胞に対するCy3-TPのライブセル結合アッセイを実施しました。アトロピンを用いて、特異的結合、競合、置換を評価しました。取得したウェル全体の画像は、統合された画像解析プログラムにより処理され、競合結合曲線、オンレート、オフレートの解析が可能となりました。ROI内の細胞密度のばらつきによるデータ品質のばらつきを改善するため、細胞面積に基づくシンプルなワンステップ正規化法も提案しました。本研究の結果は、ImageXpress Velos システムが、マルチウェルプレートを用いたライブセルGPCRスクリーニングのためのハイスループットプラットフォームとして有用であることを示しています。本システムの独自の光学系とスキャンエンジンにより、シンプルな“プラグアンドプレイ”型アプリケーションの実現が可能です。
PDF版(英語)