Application Note SpectraMaxマルチモードマイクロプレートリーダー
による HTRF cAMP HiRangeアッセイ
- ロバスト性に優れた均一型アッセイ
- Z’因子 ≥ 0.9
- ハイスループットスクリーニング(HTS)に最適化された安定性と効率性
- SoftMax Proソフトウェアのプロトコールにより、迅速な結果取得が可能
PDF版(英語)
はじめに
本アプリケーションノートでは、SpectraMax® i3、SpectraMax® Paradigm®、および SpectraMax® M5e マルチモードマイクロプレートリーダーを用いて、ロバスト性に優れた高スループットの HTRF® アッセイを実施する方法をご紹介します。本手法では、優れた Z’ 因子および高い再現性を示す EC₅₀ 値が得られます。
HTRF は、Cisbio Bioassays によって開発された多用途な技術で、生体分子間相互作用の検出に用いられます *1。この技術は、蛍光共鳴エネルギー移動(FRET)と時間分解型蛍光(TRF)測定を組み合わせることで、短寿命のバックグラウンド蛍光を除去し、特異的な蛍光シグナルの検出を可能にします。 このアッセイでは、ドナー色素とアクセプター色素を使用します。ドナーとアクセプターが十分に近接している場合、ドナーが光源(例:フラッシュランプ)によって励起されると、アクセプターへエネルギーが転移し、特定の波長で蛍光を発します。
HTRF では、4 種類の特定の蛍光色素を用いて、互換性のあるドナー・アクセプターの TR-FRET ペアを構成します。ドナーには、長寿命蛍光を持つクリプテート化ユーロピウム(Eu³⁺)およびテルビウム(Lumi4™-Tb)が使用されます *1。アクセプターには、XL665 と d2 の 2 種類が開発されており、いずれも HTRF ドナーの発光スペクトルと重なる励起スペクトルを持ちます。両者は 665 nm にピークを持つ蛍光を発し、この波長ではドナーの発光がほとんどないため、特異的な検出が可能です。HTRF の初期アクセプターである XL665 は、紅藻由来のフィコビリンタンパク質色素です。第2世代のアクセプターである d2 は、XL665 の 100 分の 1 のサイズを持つ改良型アロフィコシアニンで、XL665 ベースのアッセイで生じる可能性のある立体障害の問題を軽減するために開発されました。
HTRF cAMP HiRange キットは、細胞サンプル中の環状 AMP(cAMP:サイクリックアデノシン 3’, 5’–モノリン酸)の定量を可能にします。cAMP は、G タンパク質共役型受容体(GPCR)シグナル伝達における主要なセカンドメッセンジャーです。リガンドが GPCR に結合すると構造変化が起こり、受容体が活性化され、続いて G タンパク質が活性化されます。シグナル伝達のさらなる進行は、活性化された G タンパク質の種類に依存します。Gs の活性化により、アデニル酸シクラーゼを介して cAMP の産生が促進されます。細胞によって産生された未標識の cAMP は、d2 標識された cAMP と抗 cAMP クリプテートとの結合を競合します。その結果、細胞内の cAMP 濃度が上昇すると FRET が減少し、665 nm における蛍光強度の低下として検出されます(図1)。
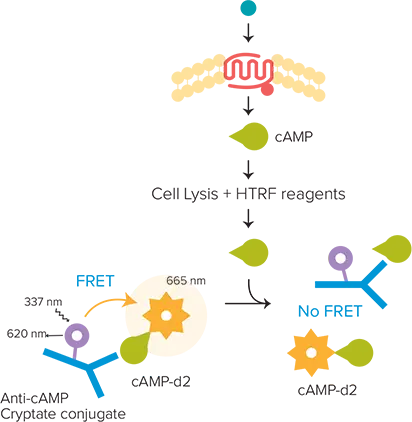
図1. cAMP アッセイの原理 細胞によって産生された未標識の cAMP は、d2 標識された cAMP と抗 cAMP クリプテートコンジュゲートとの結合を競合します。これにより、細胞内 cAMP の増加は FRET の減少を引き起こします。
材料
- cAMP HiRange 1000 テスト(Cisbio)
- 白黒低容量384ウェルマイクロプレート(Greiner)
- SpectraMax i3 マルチモードマイクロプレートリーダー(モレキュラーデバイス)
- SpectraMax Paradigmマルチモードマイクロプレートリーダー(モレキュラーデバイス)
- SpectraMax M5eマルチモードマイクロプレートリーダー(モレキュラーデバイス)
- HTRF検出カートリッジ(モレキュラーデバイス)
方法
HTRF cAMP HiRange キットは Cisbio Bioassays より提供されました。最終濃度が 0.17 nM から 2800 nM の範囲となる cAMP 標準液は、cAMP HiRange HTRF パッケージインサートの指示に従って調製しました。陽性コントロール(cAMP 非添加、最大 FRET)および陰性コントロール(cAMP および cAMP-d2 非添加)も含めました。試薬は、表1に示す通り、各ウェルあたり最終容量 20 μL で分注しました。
| 陰性コントロール | 陽性コントロール | 標準曲線 | アッセイコントロール |
|---|---|---|---|
| 5 µL 希釈液 | 5 µL 希釈液 | 5 µL cAMPスタンダード | 5 µL cAMP コントロール |
| 5 µL 希釈液 | |||
| 5 µL コンジュゲート&溶解バッファー | 5 µL cAMP-d2 | ||
| 5 µL 抗cAMP-クリプテート | |||
表1. 384ウェル低容量プレートにおけるアッセイ設定 プレートはカバーをかけ、室温で1時間インキュベートしました。時間分解型蛍光は SpectraMax マルチモードマイクロプレートリーダーで測定しました(装置設定については表2を参照)。SpectraMax i3 および SpectraMax Paradigm リーダーでは、アッセイ感度とダイナミックレンジを最適化するために、マイクロプレートの最適化および読み取り高さの調整を行いました。
データ解析
HTRF アッセイの解析には、Cisbio が特許を取得している比率解析法を使用します。この手法は、2つの蛍光波長の検出に基づいています。ドナーの発光(616 nm)は内部参照として使用され、アクセプターの発光(665 nm)は生物学的反応の指標として使用されます。この比率測定により、ウェル間のばらつきが軽減され、化合物による干渉が排除されます。以下のステップ4で計算される Delta F は、アッセイのシグナルとバックグラウンドの比率を反映しており、アッセイ間の比較に有用です。
結果は、665 nm / 616 nm の比率から算出され、Delta F として以下の式で表されます:
$$ \text{1. Ratio} = \frac{\text{Emission}_{665\text{nm}}}{\text{Emission}_{616\text{nm}}} \times 10^{4} $$ $$ \text{2. Mean Ratio} = \frac{\sum \text{ratios}}{2} $$ $$ \text{3. CV} = \frac{\text{Std deviation}}{\text{Mean ratio}} \times 100 $$ $$ \text{4. Delta F} = \frac{\text{Standard or sample Ratio} - \text{Ratio}_{\text{neg}}}{\text{Ratio}_{\text{neg}}} \times 100 $$ $$ \text{(Ratio}_{\text{neg}} = \text{Ratio of negative control)} $$
Z’ 因子の値は、陰性コントロール(cAMP 非添加、cAMP-d2 非添加)および陽性コントロール(cAMP 非添加)を用いて算出しました *2。
データは SoftMax® Pro ソフトウェアを使用して生成・解析しました。このソフトウェアには、検出と解析を簡素化するための複数の事前設定済み HTRF プロトコールが含まれています。
結果
データは前述の方法で解析され、SoftMax Pro ソフトウェアを用いて 4 パラメータカーブフィットでグラフ化しました。最良の結果は、表2に示すプレートリーダー設定で得られました。ディレイ時間、積分時間、パルス数を増加させると、DF% の顕著な低下が観察されました。黒色の低容量 384 ウェルマイクロプレートを使用した場合、白色プレートと比較してアッセイウィンドウが 3020 から 3253 に増加しました(図2)。ただし、Z’ 因子(アッセイウィンドウと陽性・陰性コントロールの標準偏差を考慮)および EC₅₀ 値は、両方のプレートタイプでほぼ同等でした(表3)。
※SpectraMax M5e マルチモードマイクロプレートリーダーを使用する場合は、白色プレートが必要です
| SpectraMax i3およびSpectraMax Paradigm | |
|---|---|
| 光学構成 | HTRF検出カートリッジ |
| リードモード | TR-FRET |
| タイプを読む | エンドポイント |
| 波長 |
Ex 340 nm Em 616 nm Em 665 nm |
| PMTと光学系 |
パルス数: 30 励起時間: 0.05 ms 測定ディレイ 0.02 ms 積分時間:0.2 ms 読み取り高さ: 7.5-7.7 mm*. |
| SpectraMax M5e | |
|---|---|
| リードモード | TRF |
| タイプを読む | エンドポイント |
| 波長 |
Ex 314 nm Em 620 nm Em cutoff 570 nm Em 665 nm Em cutoff 630 nm |
| TRFの設定 |
積分遅延: 50 µs 積分時間: 400 µs |
| PMTと光学系 | 読み取りごとのフラッシュ数:100 |
※最適な読み取り高さは、使用するマイクロプレート、アッセイ容量、およびリーダーの光学系に依存します。表2. SpectraMax i3、SpectraMax Paradigm、および SpectraMax M5e リーダーにおける最適化された装置設定
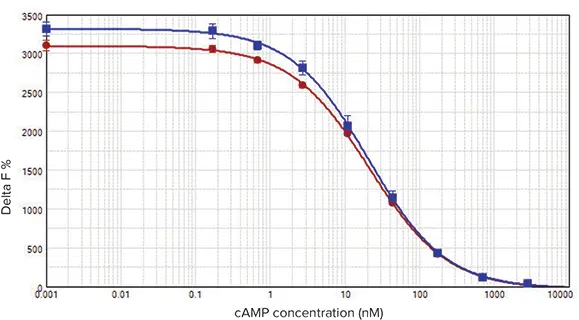
図2. 白色プレートと黒色プレートの比較
SpectraMax Paradigm プレートリーダーで測定した HTRF cAMP キャリブレーションカーブ。赤丸:Greiner 白色プレート、青四角:Greiner 黒色プレート。この例では、黒色プレートの使用によりアッセイウィンドウが 3020 から 3253 に増加しました(単位:Delta F%)。
| 測定 | SpectraMax i3プレートリーダー | SpectraMax Paradigmプレートリーダー | SpectraMax M5eプレートリーダー |
|---|---|---|---|
|
cAMP EC50 (nM) |
19.1 | 19.0 | 17.5 |
| Z'因子 | 0.92 | 0.90 | 0.90 |
| 読み取り時間(384ウェル) | 5:03 | 2:17 | 14:00 |
表3. cAMP HiRange 標準カーブの結果概要
SpectraMax i3 と SpectraMax Paradigm プレートリーダーは、同一アッセイプレートを用いた並列比較でほぼ同一の結果を示しました(図3)。このテストでは白色プレートを使用しました。アッセイウィンドウはそれぞれ 3004 と 3051、Z’ 因子は 0.92 と 0.90 でした。EC₅₀ 値は 19.1 nM と 20.0 nM で、文献値と同等です(表3)。SpectraMax M5e マルチモードマイクロプレートリーダーでも同様の Z’ 因子と EC₅₀ 値が得られます。
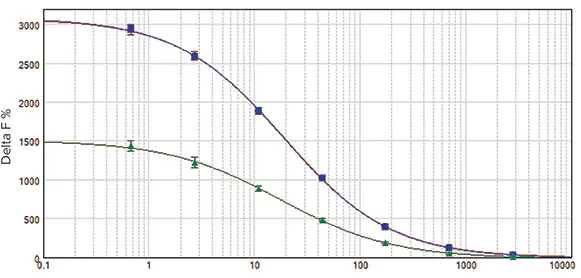
図3. HTRF cAMP検量線。
SpectraMax i3(赤丸)、SpectraMax Paradigm(青四角)、SpectraMax M5e(緑三角)で測定したキャリブレーションカーブ。SpectraMax i3 と Paradigm の結果はほぼ同一でした。SpectraMax M5e のアッセイウィンドウはやや小さいものの、アッセイ品質は非常に良好でした。
SpectraMax Paradigm プレートリーダーは、デュアル PMT 構成により両方の HTRF 発光波長を同時に読み取れるため、他のリーダーよりも読み取り時間が短縮されます(表3)。
結論
SpectraMax i3 および SpectraMax Paradigm プレートリーダーには、HTRF 認証済み検出カートリッジを搭載でき、高スループットスクリーニングに対応します。SpectraMax Paradigm プレートリーダーで使用する場合、このカートリッジは同時二重発光検出を可能にし、読み取り時間を短縮します。3 機種すべてにおいて、cAMP HiRange アッセイで優れた Z’ 因子値が得られ、これらのマルチモードシステムのロバストなアッセイ性能が示されました。SoftMax Pro ソフトウェアの事前設定済み HTRF プロトコールにより、データ取得と解析は簡素化されます。
参考文献
- http://www.htrf.com/htrf-technology
- Zhang, J. H., Chung, T. D. Y., and Oldenburg, K. R. (1999). A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J. Biomolecular Screening 4(2): 67-73.
以下のモレキュラーデバイスシステムと互換性があります。

PDF版(英語)