Application Note 汚染物質BSAアッセイ
PDF版(英語)
はじめに
ウシ血清アルブミン(BSA)は63,000ダルトンのタンパク質で、ウシ血清の主要成分です。BSAを含む子牛胎児血清は、組換え医薬品の製造のための哺乳類細胞培養培地に使用することができます。組換え医薬品の精製過程において、BSAは製品タンパク質と共精製される可能性があり、臨床使用において生物学的危険性を示す可能性があります。したがって、哺乳動物細胞に由来する最終製品中の汚染BSAをアッセイすることが必要です。BSAのアッセイ法は、プロセス全体を通して製品の精製をモニターするためにも使用できます。
本アプリケーションノートでは、市販の抗 BSA 抗体を用いた BSA アッセイの予備的なプロトコールと実施例を示します。このノートはガイドとして作成されたものであり、このアッセイのバリデーションを示すものではなく、また必ずしも最適な性能パラメータを示すものでもありません。
材料
- Molecular Devices CorporationのThreshold® System(カタログ番号0200-0500)、1311 Orleans Drive, Sunnyvale, CA 94089、TEL:408-747-1700または800-635-5577。
- Molecular Devices CorporationのImmuno-Ligand Assay Labeling Kit(カタログ番号R9002)。
- Molecular Devices CorporationのImmuno-Ligand Assay Detection Kit(カタログ番号R9003)。
- 注:ILA キットに含まれる Assay Buffer Concentrate は、コンタミ BSA アッセイでは一切使用しません。これはアッセイバッファーに BSA が含まれており、アッセイに支障をきたすためです。
- BSA フリーアッセイバッファー。BSAフリーのアッセイバッファーの処方は以下の通りです:
|
|
|
|---|---|---|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 表 1: BSA フリーアッセイバッファーの処方
- BSA フリーアッセイバッファーの 10 倍溶液を脱イオン水で 1:10 に希釈したものを 500 mL 調製し、0.22 µm のフィルターでろ過します。10X ストックは 4℃で保存します。結晶が生じた場合は、室温に温め、結晶を溶解してから 1X 溶液を調製します。バッファーへのコンタミネーションを防ぐため、滅菌済みピペットチップと脱イオン水でよく洗ったガラス器具のみを使用します。
- BSA, fraction VはBoehringer Mannheimから購入した(カタログ番号100 350)。BSA の他の供給源も試験したが(Boehringer Mannheim Molecular Biology grade、Pentex Miles Reagent Preparation grade、Sigma RIA grade)、同等の結果でした。
- オバルブミンはSigma Chemical社から購入しました(カタログ番号A-5503)。
- 抗BSAアフィニティー精製ポリクローナルニワトリ抗体はO.E.M. Concepts, Toms River, New Jersey, tel: 908-341-3570から購入しました。
- Sephadex® G-25カラムはPharmacia Biotechから購入しました(PD-10、カタログ番号17-0851-01)。
- サンプルは、Molecular Devices Corporationの顧客のご厚意によりご提供いただきました。
方法
抗体の標識と保存
ニワトリ抗 BSA 抗体は、Threshold System Operator's Manual の ILA セクションおよび ILA アプリケーションノート Optimizing the labeling of proteins の記載に従って標識しました。
ニワトリ抗 BSA 抗体は、標識前にアジ化ナトリウムを除去するため、PBS に対し 4℃で一晩透析しました。DNP-ビオチン-NHSまたはフルオレセイン-NHSハプテンを、1mg/mL抗体溶液の250μLアリコートと、遮光して室温で2時間インキュベートしました。モルカップリング比(MCR)は、タンパク質1モルあたりインキュベートされたビオチンまたはフルオレセインのモル数として定義されます。使用したMCRは20:1でした。
25mLのPBSで平衡化したPharmacia PD-10カラムに反応液を通すことにより、未反応のハプテンを抗体から分離しました。タンパク質濃度、タンパク質回収率、モル取り込み比(MIR)は、Threshold System Operator's Manual の ILA Section に記載されているように計算しました。MIR は、タンパク質 1 モル当たり共有結合したハプテンの平均モル数として定義されます。
以下の表は、4 つの独立した標識反応で得られたモル取り込み比を示しています。3つの異なるロットの抗体を使用しました。抗体のストック濃度は約1mg/mLでした。
| 標識# | MIR Biotin/Ab | MIR Fluorescein/Ab |
|---|---|---|
| 1 | 3.1 | 3.2 |
| 2 | 4.7 | 4.0 |
| 3 | 2.5 | 3.3 |
| 4 | 3.2 | 4.7 |
表2:4種類の標識で得られたモル導入比
標識後、抗体をキャリアータンパク質として 1 mg/mL のオバルブミンを含む BSA フリー Assay Buffer で 10 µg/mL に希釈しました。150μLのアリコートを滅菌したSarstedtチューブに入れ、-20℃で保存しました。
注意 抗体のピペッティングは、個別に包装された滅菌済みピペットチップを用いて行います。
試験あたりの最適な抗体濃度の決定(ローディング試験)
4種類のビオチン化および蛍光標識抗BSA抗体濃度(10、20、30、40 ng/test)を3種類のBSA濃度(0、200、2000 pg/mL)で試験し、バックグラウンド率と傾きを評価しました。勾配とは、濃度の変化に対するシグナルの変化を測定したものです。サンドイッチ形式と改良型同時インキュベーション・プロトコルを使用しました(Threshold System Operator's ManualのILAセクションを参照)。
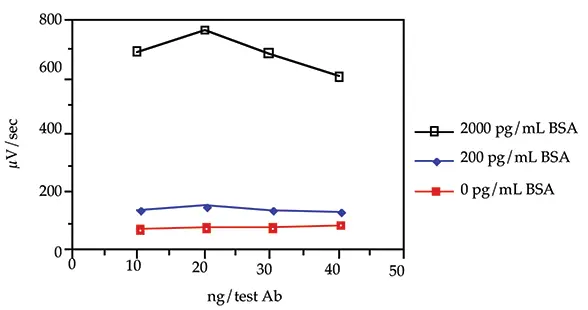
図1:負荷試験
20ng/test(200ng/mL)のビオチン化抗体と蛍光標識抗体の濃度では、バックグラウンドシグナルが最も低く(0pg/mL BSA)、BSA存在下で最大の速度が得られました(200pg/mLと2000pg/mL BSA)。30または40 ng/testの抗体を用いて観察されたµV/secのシグナルは、20 ng/testの場合よりも低かったが、これは蛍光標識抗体が1テストあたりのEnzyme Reagentの量を上回ったためです。本アプリケーションノートに記載された残りの実験では、抗体濃度20 ng/testを使用しました。
アッセイプロトコル
ステップ 1 ポリプロピレンチューブに BSA 標準曲線を調製します。個別にラップした滅菌済みピペットチップを用いて、BSAを含まないアッセイバッファーでBSA標準品(1 mg/mLストック、ベーリンガーマンハイム製BSA)を連続希釈します。標準品は BSA 10000~125 pg/mL の範囲です。推奨標準品濃度は、BSA 10000、4000、2000、1000、500、250、125 および 0 pg/mL です。
注意 このBSAアッセイには、無菌的技術と個別に包装された滅菌ピペットチップの使用が必要です。他のチップを使用するとバックグラウンドシグナルが高くなることがあります。手袋は必要ありません。
ステップ2 個々にラップされた滅菌済みピペットチップとポリプロピレンチューブを用いて、BSAを含まないアッセイバッファーで検体を希釈します。
ステップ 3 ビオチン化抗体と蛍光標識抗体をそれぞれ20 ng/test(200ng/mL)の濃度でBSAフリーのアッセイバッファーに溶解し、ポリプロピレンチューブに調製します。
ステップ 4 BSA 標準品および検体を、個別にラップした滅菌済みピペットチップを用いてポリプロピレンチューブに 100 µL 分注します。
ステップ5 ステップ3で調製した抗体100μLを、エッペンドルフのリピーターピペッターとCombitip® を用いてチューブに分注します。
ステップ6 チューブをパラフィルムで覆い、ラックを振って混合し、室温で2時間インキュベートします。
ステップ 7 2時間のインキュベーションの間に、酵素試薬をBSAフリーのアッセイバッファー4mLで再構成します。インキュベーションが終了したら、エッペンドルフのリピーターピペッターと滅菌済みコンビチップを用いて、各チューブに酵素試薬を 100 µL ずつ分注します。
ステップ8 パラフィルムでチューブを覆い、室温で1時間インキュベートします。
ステップ9 1時間のインキュベーションの間に、BSAを含まないアッセイバッファー25mLでキャプチャー試薬を再構成します。再構成したCapture Reagentの1:10希釈液を調製します(1容量のCapture Reagent + 9容量のBSA-free Assay Buffer)。インキュベーションが完了したら、希釈した Capture Reagent 1 mL をエッペンドルフ社製ピペッターと滅菌済み Combitip を用いて各チューブに分注します。
ステップ 10 反応混合物をろ過ユニットに移します。フィルターベースとフィルターブロックは新品でも再使用でもかまいません(洗浄方法については ILA 検出キットの添付文書を参照)。低真空でろ過します。
ステップ 11 ウエルが空になったら、各ウエルに洗浄液を 2 mL 分注し、高真空でろ過します。
ステップ 12 ウェルが空になったら、真空を止め、スティックを読み取ります。
アッセイ特性評価
標準曲線
標準曲線の最低検量線は、バックグラウンドシグナルより30~50µV/secのシグナル増加を生じるBSA濃度を計算することにより選択しました。この計算は負荷試験を用いて行いました(Threshold System Operator's ManualのILAセクションのSandwich Assay Optimizationを参照)。標準曲線の他の検量線は、最低検量線より約 2 log(100倍)上の範囲に分布しています。図 2 は、10000、4000、2000、1000、500、250、125、および 0 pg/mL の BSA 濃度を用いて作成した標準曲線を示しています。二次方程式がこの曲線を最もよく定義しています。
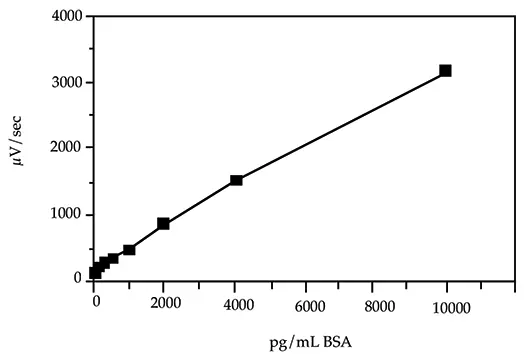
図2: BSA標準曲線
インキュベーション時間
室温での最適なインキュベーション時間を決定するために、速度論的研究を行いました。3種類の濃度のBSA(1000、200、0 pg/mL BSA)を標識抗体とともに1時間、2時間、4時間、一晩インキュベートしました。各スティックの標準曲線とオンボードキャリブレーターを一晩インキュベートしました。酵素試薬(ウレアーゼ結合体)を各チューブに分注し、すべてのチューブをさらに1時間インキュベートしました。
この速度論研究の結果を図3に示します。一晩のインキュベーションにより、試験した標準物質のシグナルは増加したが、他のインキュベーション時間と比較してバックグラウンド(0 ng/mL BSA)も増加しました。4時間、2時間、1時間のインキュベーションでは、同じバックグラウンドが生じました。しかし、インキュベーション時間が長くなるにつれて、傾きの増加が観察されました。BSAと抗体を4時間インキュベートすることで最高の感度が得られます。
しかし、このアプリケーションノートでは、BSAと抗体を2時間インキュベートし、ウレアーゼ結合体を添加した後、1時間インキュベートしました。このプロトコールにより、十分な感度と総アッセイ時間を得ることができます。
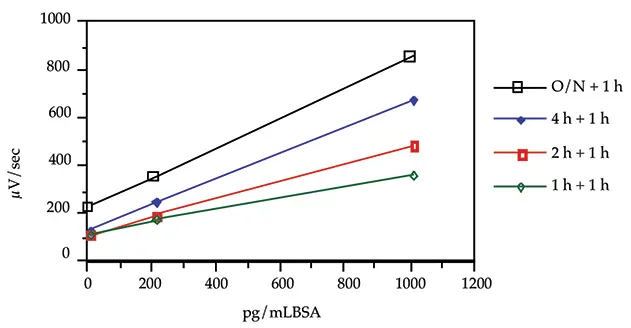
図3: キネティックスタディー
検出限界:
検出限界の評価についてはThreshold System Operator's Manualを参照。このBSAアッセイでは、125 pg/mL BSAをバックグラウンドから標準偏差4で検出できます。
アプリケーション
アッセイ性能は、子牛胎児血清を含む細胞培養で産生された組換えタンパク質を試験することで評価しました。異なるサンプルをノンスパイクおよび800pg/mLのBSAをスパイクして試験し、スパイク回収率(SR)を以下のように計算した:
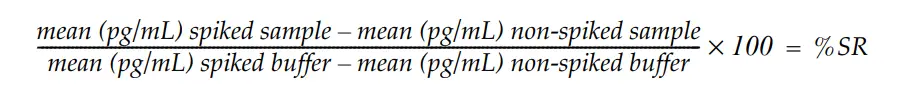
許容可能なスパイク回収率は100%+20%と定義されます。良好なスパイク回収率は、サンプルがBSAの測定に干渉せず、BSA定量が正確であることを示します。
マウスIgG1、マウスIgG2A、成長ホルモン、治療用抗体の4つの組換え医薬品が、このアッセイで汚染BSAの検査に成功しました。
マウスIgG1、マウスIgG2A、成長ホルモン、治療用抗体の4ロットが同じ実験で検査されました。サンプル濃度は5.3~6.5 mg/mLでした。表3に得られた結果を示します。
| サンプル | スパイクされたサンプル (pg/mL) | スパイクされなかったサンプル (pg/mL) | ネットスパイク (pg/mL) | % スパイク回収率 |
|---|---|---|---|---|
| BSA フリーアッセイバッファー | 635 | 0 | 635 | n/a |
| ロット 1 (ニート) | 737 | 83 | 654 | 103% |
| ロット 1 (1:2) | 648 | 0 | 648 | 102% |
| ロット 2 (ニート) | 726 | 181 | 545 | 86% |
| ロット 2 (1:2) | 688 | 0 | 688 | 108% |
| ロット 3 (ニート) | 610 | 94 | 516 | 81% |
| ロット 3 (1:2) | 480 | 0 | 480 | 76% |
| ロット 4 (ニート) | 644 | 0 | 644 | 101% |
| ロット 4 (1:2) | 659 | 29 | 630 | 99% |
表 3: 治療用抗体の BSA アッセイで得られた結果
日間の再現性を調べるため、Murine IgG1 試料を 6 日間、3 連試験しました。同じ実験内での再現性は、6 つの複製を試験することで調べました。試料の最終濃度は 1.4 mg/mL でした。表4に得られた結果を示します。
| アッセイ内再現性 | 日間再現性 | ||
|---|---|---|---|
| 日間 | 定量(pg BSA/mL) | 日間 | 定量(pg BSA/mL) |
| 1 | 1207.8 1149.9 1210.2 1187.0 1204.2 1226.0 |
1 2 3 4 5 6 |
1189.3 948.2 1146.3 1013.1 1232.5 1040.2 |
| 平均 | 1197.5 | 平均 | 1094.9 |
| 標準偏差 | 26.5 | 標準偏差 | 111.1 |
| C.V | 2.2% | C.V | 10.1% |
表4:マウスIgGサンプルのBSAアッセイの再現性と反復性
考察
濃縮アッセイバッファー、酵素試薬、キャプチャー試薬、スティック上のビオチン化メンブレン。本アプリケーションノートに記載されたプロトコールに従えば、酵素試薬、キャプチャー試薬、ビオチン化メンブレンに含まれるBSAはアッセイを阻害しません。ストレプトアビジン-抗体-BSA 複合体がメンブレン上に捕捉された後に酵素試薬を添加する逐次インキュベーションプロトコールでは、バックグラウンドシグナルが非常に高く、再現性がありません。予備的な研究から、BSAアッセイも競合フォーマットを用いて開発できることが示されています。
概要
本アプリケーションノートのデータは、3時間のインキュベーションと20ng/testの標識抗BSA抗体を用いて作成されました。これらの条件により、ダイナミックレンジは約2 log(100倍)、BSAの検出限界は125 pg/mLとなります。インキュベーション時間を短縮してより迅速なアッセイを行うことも、インキュベーション時間を長くしてより高感度なアッセイを行うこともできます。アッセイ性能のバリデーションは、試験する製品ごとに決定する必要があります。
PDF版(英語)