Application Note スライドベースの細胞解析を
SpectraMax MiniMaxで効率化
- スライドベースのサンプルから高品質な画像を取得
- さまざまな組織タイプを識別・解析
- 顕微鏡スライド、ペトリ皿、その他の非マイクロプレートフォーマットに対応したカスタムプレート寸法を作成
- 直感的なSoftMax Proソフトウェアにより、イメージングの専門知識がない研究者でも簡単に利用可能
PDF版(英語)
はじめに
細菌塗抹から組織切片まで、さまざまな生物学的サンプルは顕微鏡スライド上で一般的に研究されています。明視野および蛍光イメージングを用いることで、研究者はスライドベースのサンプルにおける細胞学的または形態学的変化を調べることができます。スライド顕微鏡は従来、顕微鏡システムを必要としていましたが、近年ではマイクロプレートリーダーシステムがスライドベースのイメージング機能を備えるよう進化しています。
SpectraMax® i3x マルチモードマイクロプレートリーダーとSpectraMax® MiniMax™ 300 イメージングサイトメーターは、専用のスライドアダプターを使用することでスライドのイメージングが可能です。透過光(TL)、緑(Ex/Em: 460/541)、赤(625/713)の蛍光チャンネルを搭載したMiniMaxサイトメーターは、SoftMax® Proソフトウェアと組み合わせることで、さまざまな組織ベースのサンプルをイメージングおよび解析できます。
このアプリケーションノートでは、MiniMaxサイトメーターがスライドベースのサンプルから高品質な画像とデータを取得する方法を紹介します。
資料
- SpectraMax i3x マルチモードマイクロプレートリーダー(モレキュラーデバイス)
- SpectraMax MiniMax® 300イメージングサイトメーター(モレキュラーデバイス)
- スライドアダプター(モレキュラーデバイス)
- FluoCells Prepared Slide #1(ThermoFisher 社)
方法
スライドアダプターを使用して顕微鏡スライドサンプルを保持しました(図1)。SoftMax Proソフトウェアで「カスタムプレート設定」を作成し、スライドアダプターの寸法に対応するため、既存のプレートタイプを編集して別名で保存しました。カスタムプレートを作成するには、「設定」をクリックし、「プレートタイプ」タブを選択して「プレート編集」をクリックします(この例では96ウェルプレートフォーマットを使用)。図2に示す寸法を入力してスライドアダプターに対応させ、カスタム名で保存します。このカスタムプレート設定は、今後のスライドベースイメージング実験で使用できます。

図1. スライドアダプター スライドアダプターは、マイクロプレートリーダーで顕微鏡スライドのイメージングを可能にするため、SBSフットプリントで特別に設計されています。
FluoCells®調製スライドをスライドアダプターに設置し、先ほど作成したカスタムプレート設定を使用してイメージングしました。使用した取得設定は表1に示します。FluoCellsスライドには蛍光染色されたウシ肺動脈内皮(BPAE)細胞が含まれています。SoftMax Proソフトウェアを使用して「%細胞被覆率」を計算しました。「フィールド解析」設定で541 nm波長を選択し、事前設定された「Cells」オプションを使用して細胞密集領域を識別しました。識別された領域は図3に示すように紫色のオーバーレイで表示されます。計算された細胞被覆率は、対応するプレートセクションおよびSoftMax Proソフトウェアのデータテーブルに表示されます。
| パラメータ | 細胞数の設定 | ||
|---|---|---|---|
| 光学構成 | SpectraMax® MiniMax 300イメージングサイトメーター | ||
| Read mode | イメージング | ||
| Read type | エンドポイント | ||
| 波長設定 |
透過光(TL) 541 nm (緑色蛍光) 713 nm (赤色蛍光) |
||
| 画像取得設定 |
TL露光:7ミリ秒 TLフォーカス調整: -460 μm* |
541露出:200ミリ秒 541 フォーカス調整: -410 μm* |
713露出:1600ミリ秒 713 フォーカス調整: -440 μm* |
| 画像解析の設定 |
分析タイプ:フィールド分析 対物レンズの波長:541イメージング |
||
*ここで示すフォーカス調整値は使用したスライドタイプに対応しています。他のスライドでは異なるフォーカス調整値が必要になる場合があります。
表1. FluoCells調製スライドの取得および解析設定
脛骨横断切片スライドは透過光(TL)設定を使用してイメージングしました(図4)。サンプルは384ウェルフォーマットで撮像され、脛骨サンプルの近位部分のみを表示しています。SoftMax ProのStainFree解析を使用して、識別された骨組織の面積(μm²)を計算しました。Image Analysisタブの下で、TL波長を使用する「フィールド解析」設定を選択しました。事前設定された「Cells」オプションを使用して、脛骨サンプルが占める領域を識別し、紫色のオーバーレイで表示しました。面積は対応するプレートセクションおよびSoftMax Proソフトウェアのデータテーブルに表示されます。この例では、図4の画像下に総骨面積を表示しています。
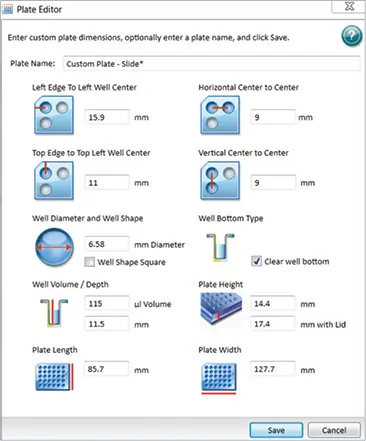
図2. スライドアダプター用カスタムプレート寸法 SoftMax Proソフトウェアで、上記の寸法を使用してスライドアダプターに対応するカスタムプレート設定を作成しました。
結果
蛍光染色されたBPAE細胞を含む調製スライドは、図1および図2に示すスライドアダプターと設定を使用してイメージングしました。これらのスライドから高品質な蛍光画像を取得でき、SoftMax Proは緑色蛍光に基づいて細胞コンフルエンシーを計算しました(図3)。
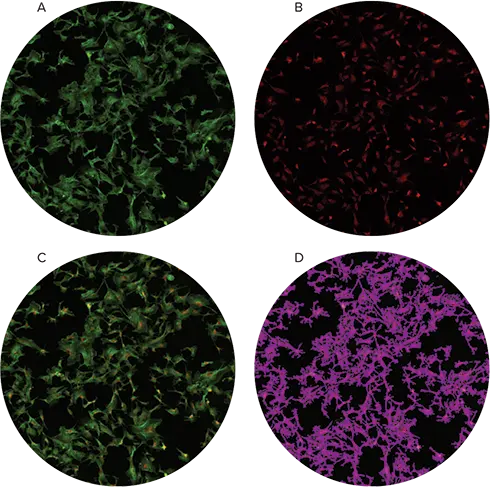
図3. FluoCells調製スライドのイメージングと解析 Alexa Fluor® 488 PhalloidinおよびMitoTracker® Red CMXRosで染色されたBPAE細胞を含む事前調製スライドをMiniMaxサイトメーターでイメージングしました。緑色蛍光チャンネル画像(A)と赤色蛍光チャンネル画像(B)をオーバーレイ(C)し、緑色蛍光チャンネルのフィールド解析によって決定された細胞コンフルエンシーをパネルDで示します。
さらに、MiniMaxサイトメーターは、同じスライドアダプターとSoftMax Proソフトウェアで作成したカスタムプレート定義を使用して組織切片をイメージングできました。以下の例では、脛骨骨サンプルをイメージングし、StainFree解析を使用してサンプル面積を計算しました(図4)。総骨面積は、骨サンプルを含む各ウェルの計算面積を合計することで求められ、骨成長の推定に利用できます。
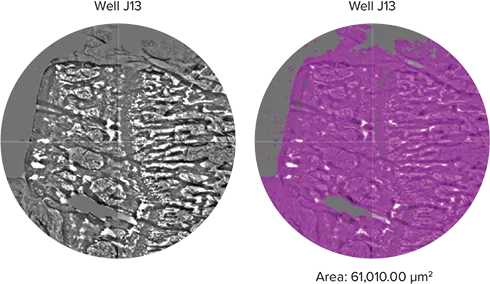
図4. 脛骨横断切片 ヒト脛骨の横断切片をスライドに載せ、TL設定でイメージングしました。左側に脛骨横断切片の一部を、右側にオブジェクトマスクを示します。
結論
プレートエディターとスライドアダプターの追加により、SpectraMax MiniMax 300 イメージングサイトメーターは、顕微鏡スライドなど異なるサンプルタイプから高品質な画像を取得できます。SpectraMax i3x マイクロプレートリーダーとMiniMaxサイトメーターを組み合わせることで、これらのサンプルを多様な方法で解析でき、研究者の研究能力を大幅に向上させます。
SpectraMax MiniMax 300イメージングサイトメーターについてさらに詳しく >>
PDF版(英語)