Application Note 画像デコンボリューションで
核内移行アッセイの解析精度を向上
- 2Dオンザフライ画像デコンボリューションにより画像の解像度を向上。
- あらかじめ設定された転座解析により、核転座を簡単に定量化できます。
- デコンボリューション画像により、データの統計的有意性を高めます。
PDF版(英語)
Matthew Hammer|アプリケーションサイエンティスト|モレキュラー・デバイス
はじめに
広視野イメージングは、細胞シグナル伝達に関与する細胞・分子プロセスの研究に広く用いられている強力なツールです。すべての広視野イメージングに共通する課題として、焦点外の光による蛍光のぼやけが挙げられますが、画像デコンボリューションアルゴリズムを用いることで、この焦点外光のアーティファクトを補正することが可能です。その結果、定量情報を保持しながら、画像の鮮明度や微細構造の可視性が向上します。
NF-κBシグナル伝達経路は、細胞シグナル伝達および遺伝子制御の研究における代表的なモデルとなっています。NF-κBはほぼすべての細胞種で発現しており、アポトーシス、細胞増殖、炎症、自然免疫および獲得免疫応答など、重要な細胞プロセスに関与しています。さらに、NF-κBの異常は自己免疫疾患やがんなどの疾患と関連していることから、創薬スクリーニングのターゲットとしても注目されています。サイトカイン、細菌抗原、ウイルス粒子、細胞毒性刺激などによって活性化されると、NF-κBは細胞質から核へ移行し、さまざまな遺伝子の転写を制御します。
本研究では、TNF-α処理時間がHeLa細胞におけるNF-κBの核内移行に与える影響を評価しました。細胞は、ImageXpress® Pico 自動細胞イメージングシステムおよびCellReporterXpress® 画像取得・解析ソフトウェアを用いてイメージングされました。画像は、Digital Confocal 2Dオンザフライ画像デコンボリューション機能と標準のWidefieldモードの両方で取得し、デコンボリューション画像による解析結果の統計的有意性の向上を示しました。
材料
- HeLa細胞
- RPMI培地(Corning)+10%FBS+1%pen/strep。
- 96ウェル黒壁透明底96ウェルマイクロプレート (Corning,)
- ブロックおよび透過化バッファー (PBS + 5%ロバ血清 + 0.2% TritonX-100)
- 抗体希釈バッファー (PBS + 1%ロバ血清 + 0.02% TritonX-100)
- TNF-α(ミリポアSigma)
- Hoechst 33342 (Invitrogen)
- NF-κB(RelA)一次抗体(ProteinTech)
- AlexaFluor 488 ロバ抗ウサギ二次抗体 (ThermoFisher)
- AlexaFluor 594 ファロイジン(ThermoFisher)
- ImageXpress Pico自動細胞イメージングシステム(モレキュラーデバイス)
- CellReporterXpress 画像取得・解析ソフトウェア(モレキュラーデバイス)
方法
HeLa細胞を黒壁・透明底の96ウェルプレートに、RPMI培地を用いて1ウェルあたり5,000細胞で播種しました。プレートは37℃、5% CO₂で24時間インキュベートし、細胞の接着と増殖を促しました。その後、TNF-α(1500 ng/mL)で0、15、30、45、60分間処理し、各条件は4反復で実施しました。
処理後、プレートをPBSで2回洗浄し、4%ホルムアルデヒドで10分間固定しました。細胞はPBSで3回洗浄後、60分間ブロッキングおよび透過処理を行い、RelA(NF-κBのサブユニット)一次抗体(1:200)およびAlexaFluor 594ファロイジン(1:50)で4℃で一晩免疫染色しました。染色液を除去後、AlexaFluor 488ドンキー抗ウサギ二次抗体(1:500)を室温で2時間添加しました。二次抗体染色の最後の30分間には、Hoechst 33342を1μL/mLで各ウェルに添加しました。撮像前にPBSで3回洗浄しました。
Digital Confocalによる高解像度イメージング
イメージングはImageXpress Picoシステムで2回行い、Digital Confocal機能を有効にしたモードと標準Widefieldモードで比較しました(図1)。40倍対物レンズを使用し、各ウェルで25箇所をイメージングしました。イメージング中に画像をステッチするプロトコールを使用し、両モードで同一の露光時間を設定しました。各チャンネルの露光時間は、DAPIが10 ms、FITCおよびTexas Redが300 msでした。
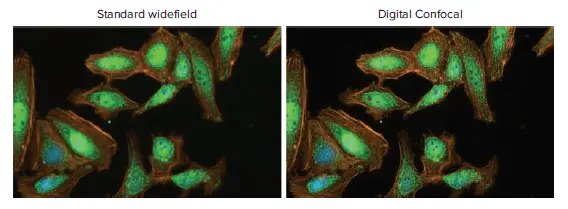
図1:TNF-αで30分処理したHeLa細胞におけるNF-κB核内移行の代表的なWidefieldおよびDigital Confocal画像 40倍対物レンズとDAPI、FITC、Texas Redチャンネルでイメージング。Digital Confocal 2Dオンザフライデコンボリューションにより焦点外光が除去され、画像解像度が向上。Hoechst 33342(核、青)、AlexaFluor 594ファロイジン(アクチン、橙)、RelA(緑)で染色。
核内移行解析
CellReporterXpressソフトウェアの事前設定済みの移行解析モジュールを使用し、NF-κBの細胞質から核への移行を測定しました(図2、図3)。Hoechst 33342で染色された核をコンパートメントとして定義し、NF-κBタンパク質をプローブとして指定しました。Pearsonの相関係数0.6以上を移行陽性と定義し、0.6以上の相関を示す細胞を陽性と判定しました。Pearsonの相関係数は、指定されたコンパートメント(この場合は核)における2つの染色のピクセル強度の重なりを示す指標で、1は完全な重なり、0は重なりなしを意味します。
TNF-α処理時間がNF-κB核内移行に与える影響
TNF-α処理時間は、NF-κB移行陽性細胞の割合に明確な影響を与えました。30分および45分処理群で移行イベントの割合が最も高く、60分処理群では最も低い結果となりました(図2、図4)。これは、TNF-α曝露45分後にNF-κBが核から細胞質へ再移行し始めたことを示唆しています。これらの結果は、Digital Confocalおよび標準Widefield画像の両方で確認されました。
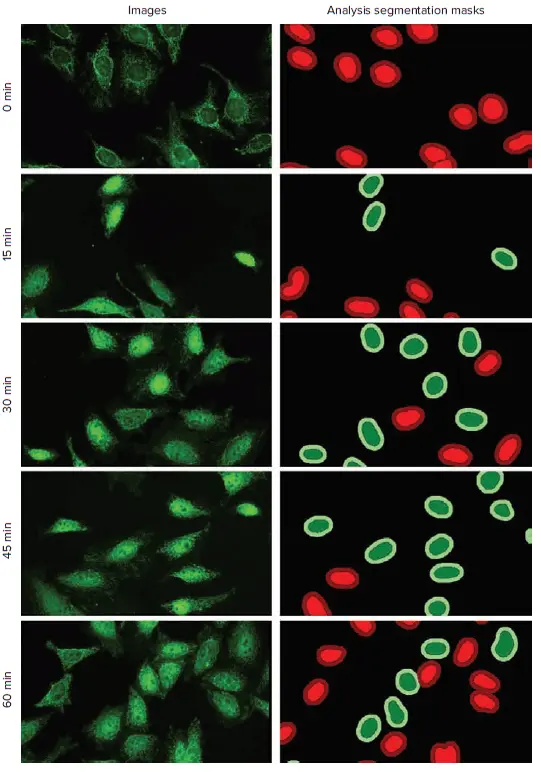
図2:TNF-α処理時間によるNF-κB核内移行の時間依存的変化 HeLa細胞を1500 ng/mLのTNF-αで0、15、30、45、60分処理。画像および解析セグメンテーションマスクはDigital Confocalモードで取得されたデータセットより。FITCチャンネル画像(RelA)を表示。CellReporterXpressの移行解析モジュールで解析:陽性内側領域(濃緑)、陽性外側領域(薄緑)、陰性内側領域(薄赤)、陰性外側領域(濃赤)。
Digital Confocalと標準Widefield画像の移行解析比較
標準WidefieldとDigital Confocalデータセット間で解析結果に顕著な違いが見られました。特に、標準Widefieldデータでは標準偏差値が高く、45分および60分処理群では移行陽性細胞の割合が高く算出されました(図4)。これは、核の上下にある細胞質からの焦点外光が偽陽性の判定につながったためです(図3A)。Digital Confocal 2Dオンザフライデコンボリューションアルゴリズムは、焦点外光を除去し、単一のz面からの光をより正確に表現します。これにより、NF-κB分子の位置をより精密に判定でき、デコンボリューション画像による解析結果の統計的有意性が向上しました。さらに、Digital Confocal画像ではコントラストとS/N比が向上し、標準Widefield画像と比較して移行イベントの正確な識別が可能となりました(図3B)。
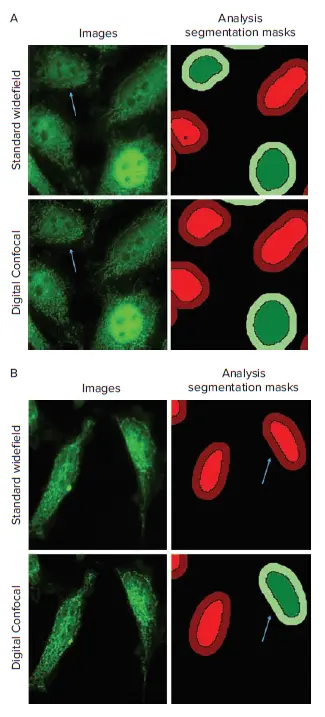
図3:標準Widefield画像とDigital Confocal画像の移行解析 Digital Confocal 2Dオンザフライ画像デコンボリューションは、広視野イメージングによる焦点外光のアーティファクトを補正し、画像解析の統計的有意性と精度を向上させます。 A. 矢印は、標準Widefield画像では移行陽性と判定され、Digital Confocal画像では陰性と判定された細胞を示しています。 B. 矢印は、標準Widefield画像では移行陰性と判定され、Digital Confocal画像では陽性と判定された細胞を示しています。画像はすべてTNF-αを30分処理した群から取得されたものです。
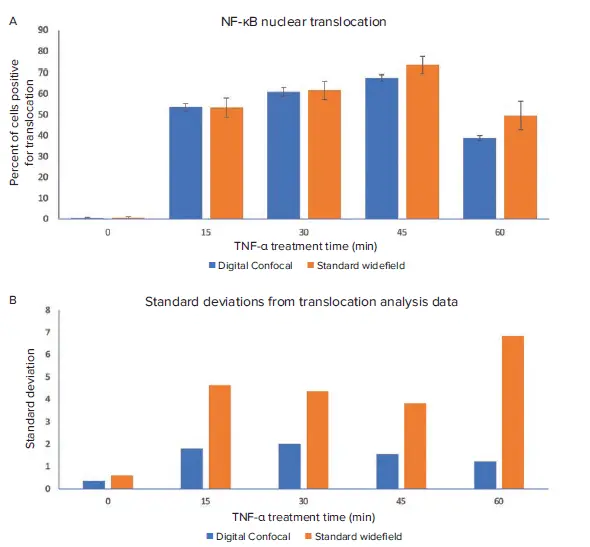
図4:TNF-α処理時間がNF-κB核内移行に与える影響 標準Widefield画像とDigital Confocal画像は、CellReporterXpressの最適化された移行解析モジュールで解析されました。 A. 両画像データセットの解析結果から得られた移行陽性細胞の割合を比較しています。 B. 各データポイントの標準偏差を示しています。Digital Confocalで取得された画像の解析では、反復間の標準偏差が有意に低く、再現性が向上していることが確認されました。
結論
細胞内の異なるコンパートメントに存在する細胞内構造や分子を正確に識別する必要があるアッセイでは、焦点外光による高バックグラウンドの影響を軽減し、特定の蛍光シグナルの識別精度を高めるオンザフライ画像デコンボリューションの活用が有効です。 本研究では、ImageXpress PicoシステムとCellReporterXpressソフトウェアを用いて、TNF-α処理によるHeLa細胞におけるNF-κBの細胞質から核への移行を評価しました。標準Widefield画像とDigital Confocal 2Dオンザフライ画像デコンボリューションによって生成された画像を比較することで、NF-κB核内移行イベントの測定におけるDigital Confocal機能の有用性が明らかになりました。 画像解像度の向上と定量情報の保持により、Digital Confocal画像による解析結果の統計的有意性が高まりました。
参考文献
- Wan, F., & Lenardo, M. J. (2010). The nuclear signaling of NF-kappaB: current knowledge, new insights, and future perspectives. Cell research, 20(1), 24–33. doi:10.1038/cr.2009.137
- Oeckinghaus, A., & Ghosh, S. (2009). The NF-kappaB family of transcription factors and its regulation. Cold Spring Harbor perspectives in biology, 1(4), a000034. doi:10.1101/cshperspect.a000034
PDF版(英語)