Application Note セルペイントの精度向上:
近赤外ラベルと高度な画像・データ解析
- 近赤外ラベルを用いてセルペイントアッセイの感度を向上させます
- IN CartaのディープラーニングSINAPモジュールで高精度な画像セグメンテーションを実現します。
- StratoMineRによる使いやすいクラウドベースのデータ解析ソフトウェア
PDF版(英語)
はじめに
画像ベースの表現型プロファイリング手法として広く利用されているセルペイントアッセイは、ハイコンテントイメージングと多パラメータの読み出しを組み合わせて、細胞における生物学的、遺伝的、化学的な摂動を研究します。この方法はますます人気が高まり、創薬プログラムからゲノムスクリーニング研究まで幅広いアプリケーションで使用されています。
標準的なセルペイントアッセイでは、核、細胞質、ミトコンドリア、ゴルジ体、ER、細胞骨格、cytoRNA、核小体といった多様な細胞小器官や構造を、5つのイメージングチャネルで撮像します。この広範な細胞染色により、複数の形態学的摂動をシングルセルレベルでモニタリングし、定量化することが可能です。しかし、公開されているセルペイントアッセイには、適切な蛍光色素の選択肢が限られていることや、イメージングシステムによる十分なスペクトル分離が難しいという制約があります。特に、ゴルジ体とアクチンは同じチャネルで撮像されるため、画像解析時に両構造を分離することが課題となります。この制約は、ヒット化合物の選択に影響を与えたり、ゴルジ体(生合成経路)や細胞骨格ネットワークに作用する化合物の効果を見えにくくする可能性があります。
そこで本研究では、NIR光源を搭載したImageXpress® Confocal HT.ai ハイコンテントイメージングシステムを活用し、アッセイの改善を試みました。具体的には、Alexa Fluor 568 PhalloidinをAlexa Fluor 750 Phalloidinに置き換えることで、細胞骨格をゴルジ体から明確に分離できるようにしました。
この多重化アッセイの複雑さから、画像解析で生成される膨大なデータを探索・解釈するためには追加の解析ツールが必要です。画像およびデータ解析を効率的に行うため、特徴抽出にはIN Carta® Image Analysis Softwareを使用し、その後のデータマイニングと解析にはHC StratoMineR™を使用しました。IN Cartaにはディープラーニング機能が搭載されており、より高精度な特徴セグメンテーションが可能です。セルペイントアッセイは、ディープラーニングSINAPモジュールを使用することで核検出が改善されます。さらに、必要に応じてミトコンドリア、ER、ゴルジ体、細胞骨格などの細胞小器官もディープラーニング機能で追加セグメンテーションが可能です。解析された画像からは、蛍光強度、空間的な数値、テクスチャ、細胞小器官の分布、共局在測定などのパラメータを抽出できます。データは直感的なクラウドベースのデータ解析プラットフォームであるHC StratoMineRにアップロードされ、さらに解析が行われます。今回のアプローチが標準的なセルペイントプロトコールに比べて優位性を示すかどうかを確認するため、5チャネルで取得した画像と6チャネルで取得した画像の表現型距離スコアを比較しました。その結果、一部の化合物で最大49%の距離スコア増加が認められました。これらの結果は、ゴルジ体と細胞骨格を別々のイメージングチャネルでイメージングすることで、セルペイントアッセイの感度が向上し、多様な細胞表現型プロファイルをより正確に反映できることを示しています。
方法
- U2OS細胞(ATCC)を1ウェルあたり2000細胞で播種しました。
- 11種類の化合物を、適切なコントロールとともに7段階の1:3希釈系列で4重複ウェルで試験しました。使用した化合物:Ca-074-Me、CCCP、クロロキン、サイトカラシンD、エトポシド、ラトランクリンB、ラパマイシン、ロテノン、スタウロスポリン、パクリタキセル、テトランドリン。
- 細胞はBrayらのプロトコールに従って染色しました。修正版プロトコールでは、phalloidin/Alexa Fluor 568の代わりにphalloidin/Alexa Fluor Plus 750(Thermo Fisher)を使用しました。
- 画像取得は、ImageXpress Confocal HT.ai(レーザー方式)またはImageXpress Micro Confocal(LED方式)ハイコンテントイメージングシステム(モレキュラーデバイス)を用い、20X Plan Apo対物レンズで実施しました。使用したフィルターは表1に示します。
- 画像解析にはIN Carta画像解析ソフトウェアを使用しました。選択した測定項目には、強度、テクスチャ、形状、空間的関係、共局在スコアに関連するパラメータが含まれます。
- セルレベルのデータはStratoMineR™(https://corelifeanalytics.com/applications/cell-painting/、Core Life Analytics)にアップロードし、さらに解析を行いました。簡単に説明すると、品質管理、プレート正規化、データ変換、特徴標準化を適用しました。次に、主成分分析(PCA)を用いてデータセットの次元を削減しました。さらに、ヒット選択やクラスタ解析などの下流解析は、主成分および表現型距離スコアに基づいて実施しました。
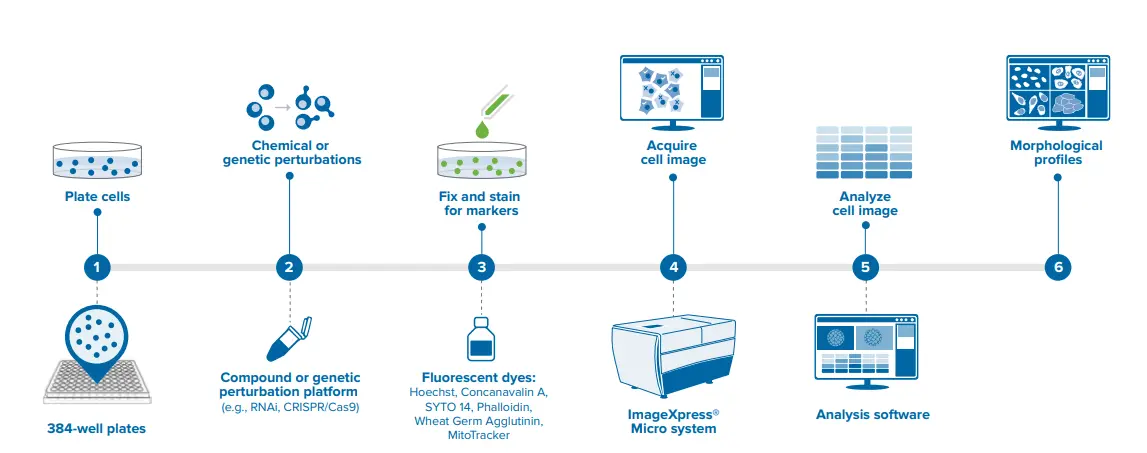
画像ベースのプロファイリングのワークフロー概要です。各ステップの詳細は上記に記載しています。
結果
イメージング
セルペイントアッセイでは、6種類の蛍光マーカーを用いて細胞を同時にラベル化し、さまざまな細胞構造をイメージングします。ゴルジ体(AGPチャネル)と細胞骨格は同じフィルターセットでイメージングされます(表1、図1)。これらの細胞内構造の分離は通常、画像解析ステップで行われます。本研究のモデルアッセイでは、U2OS細胞を11種類の化合物で24時間処理し、既報のプロトコールに従って処理しました *1,2。その後、細胞を5チャネルでイメージングしました(図1)。
ゴルジ体構造を細胞骨格から分離するため、Alexa Fluor 568 PhalloidinをAlexa Fluor 750 Phalloidinに置き換え、NIR光源を搭載したImageXpress Confocal HT.ai ハイコンテントイメージングシステムでイメージングしました(図2A)(以下、修正版アッセイと呼びます)。この方法では、未処理細胞でゴルジ体が核周囲に分布している様子が明確に確認できます。この分布は、WGA(ゴルジ体用)とphalloidin(アクチン用)を同じチャネルでイメージングした場合には容易に識別できません(図1)。この違いは、テトランドリン処理細胞でさらに顕著になります(図2B)。
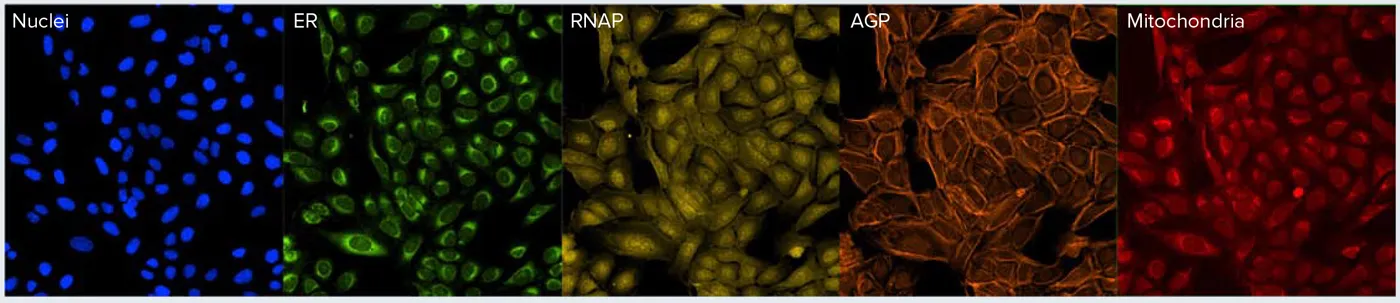
図1. セルペイントアッセイ。既報のプロトコールを用いてセルペイントアッセイ用に染色した細胞の例です。ゴルジ体とアクチン構造が同じチャネル(AGP)で取得されていることに注意してください。アクチン染色はフィラメント状構造として示されていますが、ゴルジ体は目視では容易に識別できません。
| セル コンパートメント | 染料 | Ex/Em | 使用フィルター(LED | 使用フィルター(レーザー) |
|---|---|---|---|---|
| 核(DNA) | Hoechst 3342 | 350/461 | DAPI 377/447 | DAPI 405/452 |
| 小胞体(ER) | コンカナバリン A - AlexaFluor488 コンジュゲート | 495/519 | FITC 475/536 | FITC 467.5/520 |
| 核小体(RNA) | SYTO14 |
516/549 (DNA) 521/547 (RNA) |
Cy3 531/593 | YFP 520/562 |
| ゴルジ装置(AGP) | 小麦胚芽アグルチニン AlexaFluor555コンジュゲート | 555/565 | Texas Red 560/624 | TRITC 555/598 |
| F-アクチン(AGP) | ファロイジン AlexaFluor568 | 578/600 | Texas Red 560/624 | |
| F-アクチンファロイジン | AlexaFluor750 | 758/784 | Cy7 725/794 | |
| ミトコンドリア(mito) | MitoTracker Deep Red | 644/665 | Cy5 631/692 | Cy5 638/692 |
表1. セルペイントアッセイで使用した染色と細胞コンパートメント検出用フィルターセット
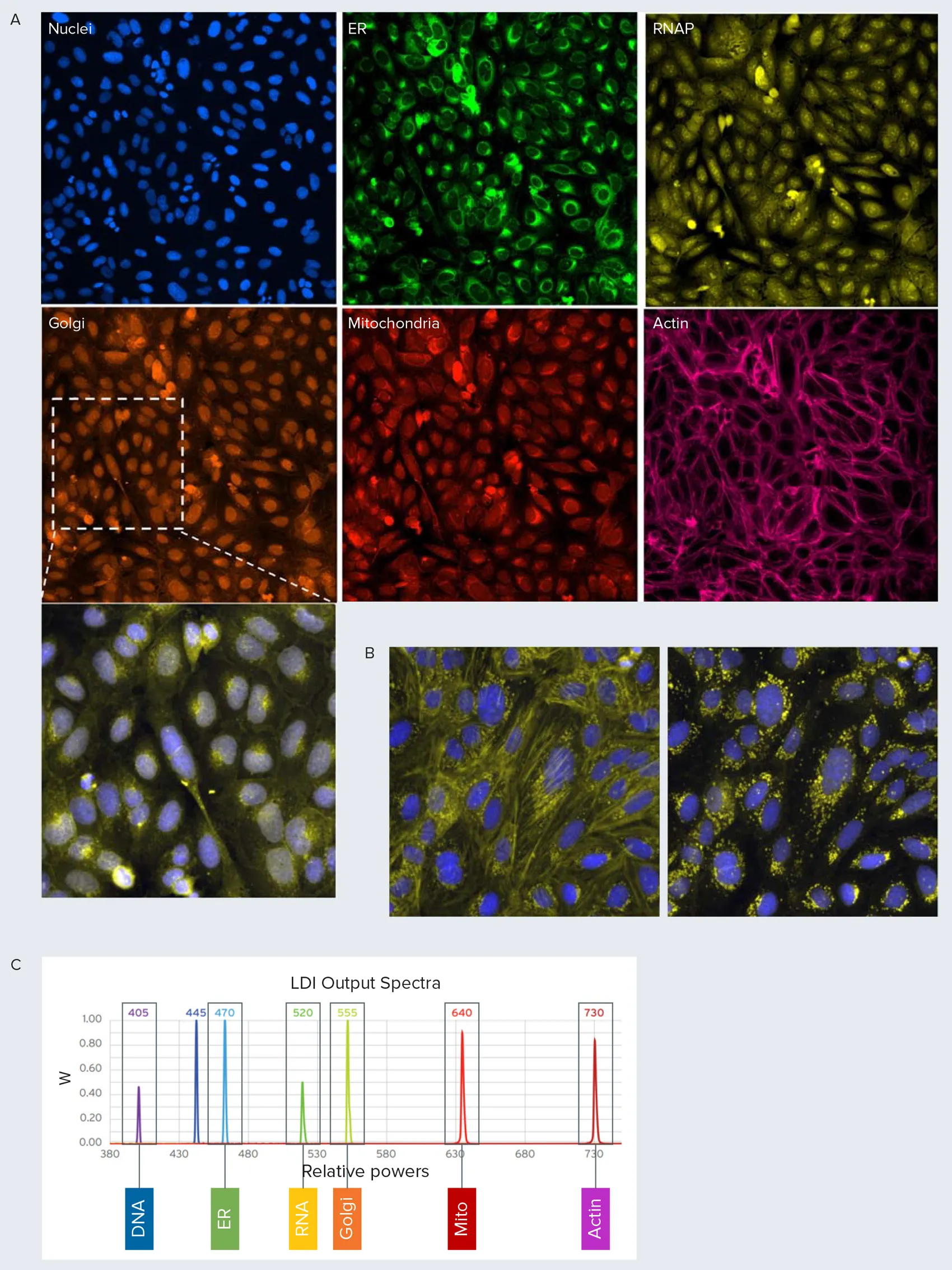
図2. 修正版セルペイントアッセイ。Far-red光源を用いてスペクトル分離を改善した修正版プロトコールです。A) 修正版プロトコールでは、アクチンをラベル化するためにPhalloidin Alexa Fluor 750を使用しました。コントロールウェルの例を示します。白枠のインセットは、核(青)とゴルジ体(黄)チャネルの合成画像です。ゴルジ体の点状構造が核周囲に分布している様子が明確に確認できます。B) テトランドリン処理細胞の画像です。左はアクチンとゴルジ体チャネルをマージした再構成画像(黄)、右はゴルジ体(黄)と核(青)のみの画像です。修正版プロトコールではゴルジ体分布へのテトランドリンの影響がより明確に示されています。C) レーザー光源とその相対出力を示します。各光源で検出される細胞コンパートメントを表示しています。
特徴抽出とデータ解析
標準的なセルペイント染色セットと修正版染色セットで染色した細胞の違いを定量化するため、画像をIN Carta Image Analysis Softwareで解析しました(図3)。抽出した測定値はHC StratoMineRにアップロードし、さらにデータ解析を行いました。標準アッセイと修正版アッセイから抽出したデータに対して主成分分析(PCA)を実施しました。興味深いことに、5チャネル画像のPCA1ではAGPチャネルの測定値が主要な特徴成分を構成していましたが、修正版6チャネル画像のPCA1ではアクチンチャネルの測定値が主要な特徴を構成していました(図4)。この結果は、修正版アッセイがアクチンとゴルジ体の表現型プロファイルの分解能を改善し、作用機序(MOA)の理解に有用であることを示唆しています。
さらに、標準アッセイと修正版アッセイの表現型プロファイルを距離スコアに基づいて比較しました。このスコアは、サンプルがネガティブコントロールからどれだけ離れているかを示し、スクリーニングアッセイでのヒット選択に利用できます。ゴルジ体経路に影響を与えることが知られている化合物では距離スコアの増加が認められました(表2)。これらの結果は、ゴルジ体と細胞骨格を別々のイメージングチャネルで取得することで、セルペイントアッセイの感度が向上し、細胞表現型プロファイルをより正確に反映できることを示しています。
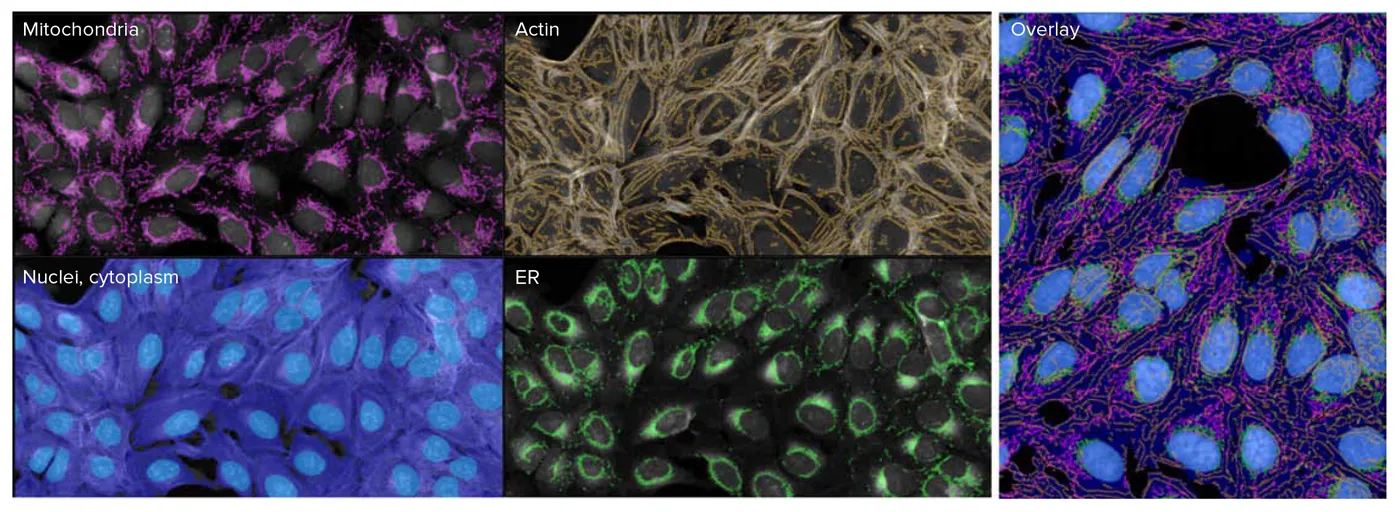
図3. IN Cartaソフトウェアで特徴抽出を行い、さまざまな細胞構造をセグメンテーションしました。ここでは、すべての処理で核を高精度にセグメンテーションするために組み込みの核モデルを使用しました。6チャネルで取得した画像では、細胞ごとに487の特徴が抽出されました。IN Cartaソフトウェアで特徴マスクをオーバーレイした例を示します。
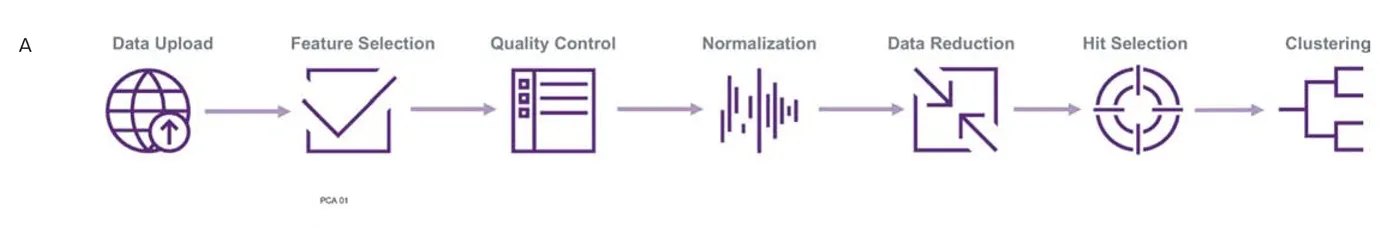
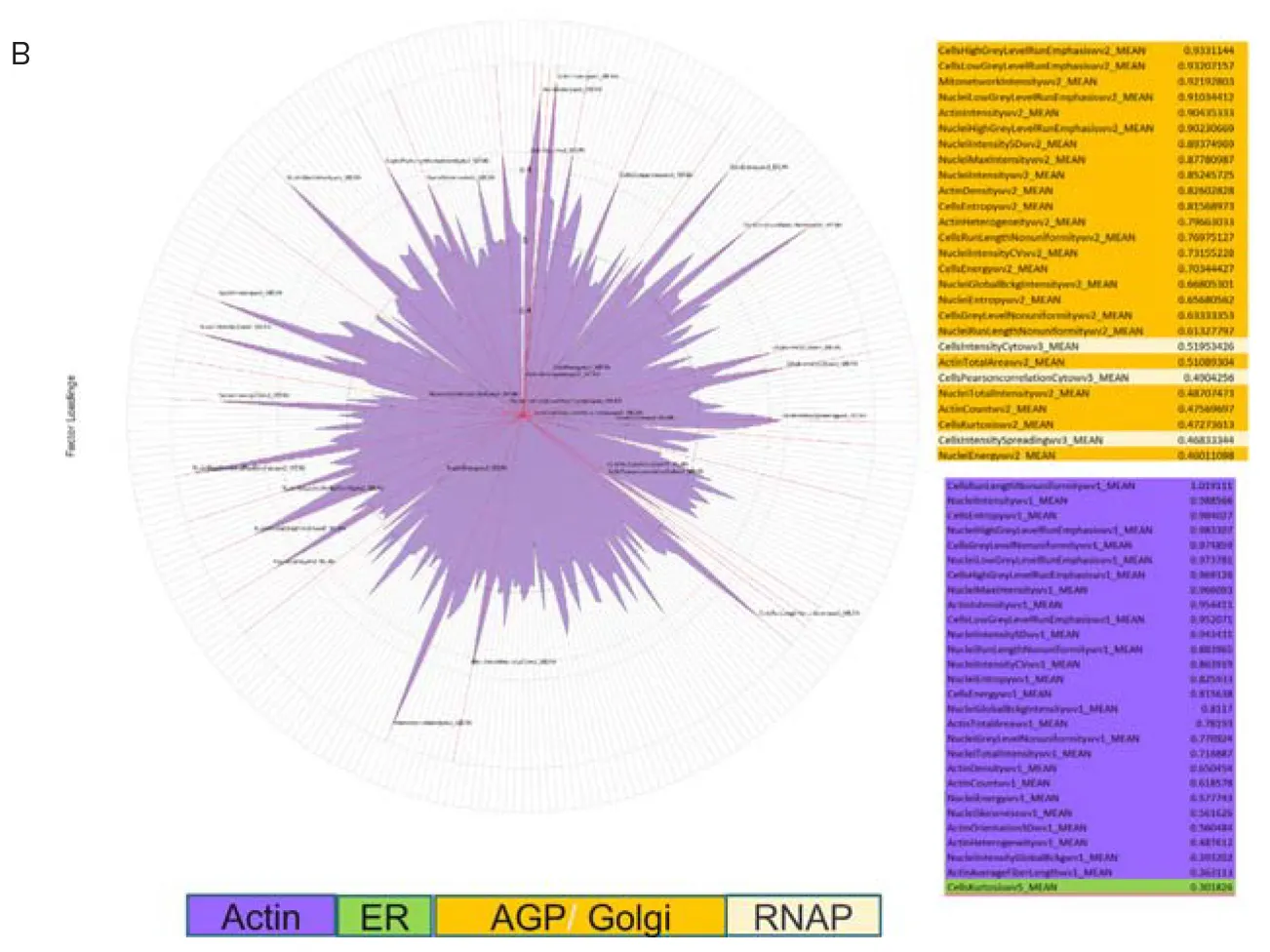
図4. HC StratoMineRによるデータ解析 A) HC StratoMineRは、ハイコンテント多パラメータデータ解析の典型的なワークフローをユーザーにガイドするWebベースのプラットフォームです。B) PCA(一般化加重最小二乗法)を用いてデータを15成分に縮約しました。PCA1への特徴寄与を示すポーラープロットを表示しています。特徴は対応する細胞コンパートメントに基づいて色分けされています。5チャネル(上)と6チャネル(下)のセルペイントイメージングでのPCA1特徴を比較してください。特徴寄与の違いに注目してください。
| 化合物 | 距離スコアの変化(%) |
|---|---|
| クロルキン | 49 |
| テトランドリン | 48 |
| CCCP | 11 |
表2. セルペイントで5チャネルと6チャネルを用いて取得したデータセット間の距離スコアの変化
結論
- 本研究の結果は、近赤外レーザーの使用によりセルペイントアッセイの感度が向上することを示しています。この方法により、ゴルジ体表現型の分離においてより高感度なアッセイを開発できました。
- 追加のチャネルは、プロジェクト固有のバイオマーカーを追加することで標準的なセルペイントアッセイを拡張することも可能にします。
参考文献
- Bray MA et.al., Nat Protoc. 2016 Sep;11(9):1757-74
- Gustafsdottir SM et.al., PLoS One. 2013 Dec 2;8(12):e80999.
- Omta WA, et.al., Assay Drug Dev Technol. 2016 Oct;14(8):439-452
IN Carta 画像解析ソフトウェアについて詳しくはこちら>>
PDF版(英語)