Application Note SPECTRAmax GEMINI XS 蛍光マイクロプレートリーダーを用いた
動物細胞の LIVE/DEAD 生存能力/細胞毒性アッセイ
PDF版(英語)
はじめに
Anne T. Ferguson, Ph.D.
モレキュラーデバイス
このアプリケーションノートでは、モレキュラーデバイスの SPECTRAmax® GEMINI XS マイクロプレートリーダーを使用した、動物細胞用 LIVE/DEAD® 生存率/細胞毒性アッセイキットの性能についてご説明します。このアッセイは、カルセインAM(cal AM)とエチジウムホモダイマー(EthD-1)という2種類の蛍光色素を用いて、生細胞と死細胞を同時に染色します。カルAMは電気的に中性で、非蛍光性のエステラーゼ基質であり、生細胞に拡散し、どこにでもある細胞質エステラーゼによって酵素的に切断されます。これにより、生きた細胞内に保持されている遊離のカルセイン蛍光色素が放出されます。この色素は強い緑色の蛍光を発し、波長485nmで励起すると波長525nmでピークを示します。対照的に、EthD-1は極性の核酸染色剤で、死細胞膜には浸透しますが、生細胞膜には浸透しません。いったん核酸にインターカレートされると、525nmで励起したときに625nmの赤色蛍光が40倍に増加します。
本研究ではまず、各染料の最適な励起(Ex)波長と発光(Em)波長を決定します。次に、これらのEx波長とEm波長を用いて、生細胞と死細胞の純粋な集団において2つの色素がどの程度区別されるかを決定し、両方の色素が存在する場合の干渉を予測します。
LIVE/DEAD Viability/Cytotoxicityは、全細胞集団における生細胞と死細胞の比率の変化をモニターするように設計された高感度アッセイです。その結果、細胞死を誘導する化合物のスクリーニングに有用であり、アポトーシス、細胞媒介免疫、細胞増殖の研究のための基礎研究ツールでもあります(*1~*7)。LIVE/DEAD Viability/Cytotoxicityの利点としては、生細胞染色がMTTやチミジン取り込みアッセイのように細胞代謝や増殖に依存しないこと、チミジン取り込みアッセイや51Crリリースアッセイとは異なり非放射性アッセイであることが挙げられます(*8, *9)。
材料
- LIVE/DEAD Viability/Cytoxicity Kit (Molecular Probes, cat# L-3224) Tel: 1-541-465- 8300
- Chinese Hamster Ovary (CHO) cells
- 96 well black microtiter plates with clear bottoms (Costar, cat# 3603). Tel: 1-800-492- 1110
- PBS (Phosphate buffered saline, 136.8mM NaCl, 2.5mM KCl, 0.8mM Na2PO4 , 1.47mM KH2PO4 , 0.9mM CaCl2 , 0.5mM MgCl2 pH 7.4)
- 10% Triton X-100 in PBS
- 0.526mM EDTA in PBS
- Ham’s F12 medium Cat# 9058, Fetal Bovine Serum (FBS) Cat# 3000 (Irvine Scientific) Tel: 1-800-437-5706
方法
細胞の調製
CHO細胞は10% FBSを含むHam's F12培地で培養しました。細胞をPBSで3回洗浄した後、PBS中0.526mM EDTA 3mlで20分間処理しました。剥離した細胞を回収し、PBSで希釈しました。アリコートを血球計数器で数えました。
細胞の濃度は、PBS中で2.5 x 105cells/mlに調整します、これは2.5 x 104 cells/100µlの開始濃度に相当します。死細胞の調製には、細胞の半分を10% Triton X-100の1:100希釈液で10分間処理しました。生細胞と死細胞の両方をPBSで1:3に連続希釈し、2.5 x 104~103 cells/100µlの濃度範囲を得ました。マイクロプレートの各カラムに生細胞または死細胞の希釈液を8反復するように細胞をプレーティングしました。陰性対照/バックグラウンドは100µlのPBSでした。
11.4µM cal AM/5.7µM EthD-1のPBS溶液を調製し、100µlのアリコートをコントロールウェルを含むマイクロタイタープレートの各ウェルに添加しました。各ウェルの色素の最終濃度は、5.7µM cal AM/2.85µM EthD-1でした。細胞は、組織培養インキュベーター中、37℃で30分間、色素とともにインキュベートされ、その後、GEMINI XSを用いて分析されました。
研究成果
励起および発光波長の最適化
図1Aに示すように、2.5 x 104 個/ウェルの生細胞および死細胞を含むプレートの一部をスペクトルモードでスキャンし、cal AM色素の最適なExおよび Em波長を決定しました。次に、プレートのこの部分をスキャンして、EthD-1色素の波長を最適化しました(図1B)。生細胞と死細胞の間で最大の違いを示したEx/Em波長の組み合わせが、今後の実験用に選択されました。これらには、cal AM染色生細胞用の515nmカットオフフィルターを用いたEx485nm/Em525nm、およびEthD-1染色死細胞用の590nmカットオフフィルターを用いたEx525nm/Em620nmが含まれます。これらの設定は、アッセイの性能を評価するために使用されました。
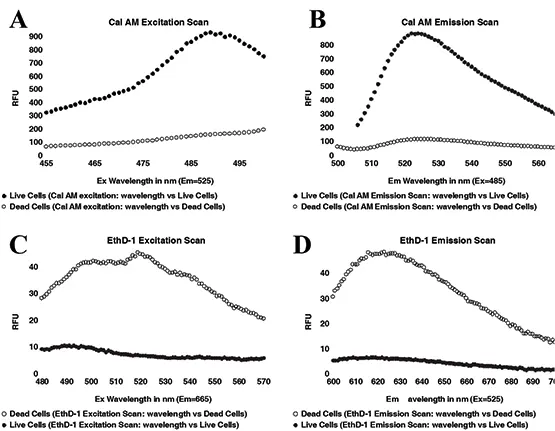
図1: cal AM/EthD-1染色細胞の励起および発光スペクトルスキャンです。スキャンはPMTを "auto"、キャリブレーションを "on "に設定し、ウェルあたり20リードで行いました。
アッセイ性能
ウェルスキャン機能を使用し、各ウェルの10カ所で読み取りを行いました。シグナル/バックグラウンド比は、2.5×104細胞で得られたRFU値を陰性コントロール(PBSのみ)の値で割ることにより算出しました。cal AMの値は6.2、EthD-1の値は8.1であった。生細胞、死細胞、PBSのみを含むすべてのウェルを、各染料に最適なEx/Em条件下でスキャンし、直線性を決定しました(表1A、B)。すべての細胞希釈液のCV%は10%以下でした。生細胞の直線曲線を、同数の死細胞を用いて得られた直線曲線と比較し、両者とも485/525(cal AMに最適)でスキャンしました(図2A)。このスキャンでは、死細胞のバックグラウン ドシグナルは最大2.5 x 104 cells/wellまで一定でした。さらに、生細胞と死細胞の蛍光を525/620で比較しました(図2B)。対照的に、103から2.5×104個/ウェルの生細胞では、シグナルの増加はわずかでした。言い換えれば、2.5×104個の生細胞/ウェルは、2.5×103個の死細胞/ウェルとほぼ同等の蛍光シグナルを発します。これは、蛍光干渉の結果であるか、生細胞集団の中に少数(10%)の死細胞が混入している可能性があります。これらの2つの図は、生細胞と死細胞の間には蛍光シグナルに有意な差があり、混合色素で染色すると2つの細胞集団を容易に区別できることを示しています。
| A | B | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表1: Cal AMとEthD-1の組み合わせで染色した生細胞と死細胞の希釈から得られた生データです。A, Ex485/ Em525; B, Ex525/Em620; Live*=生細胞; dead=*死細胞; Std. Dev.=標準偏差;CV%=変動係数です
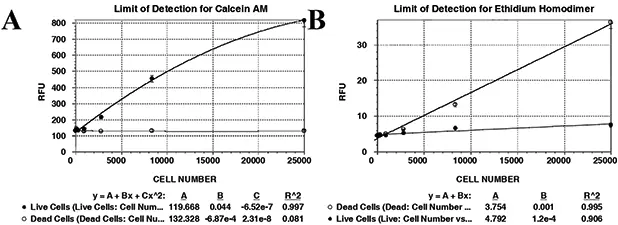
図2:生細胞と死細胞の区別。Cal AM/EthD-1染色細胞は、結果セクションに記載したように、最適なEx/Emおよびカットオフ設定の下、ウェルスキャンモード(フィルパターン;10リード/ウェル)で分析しました。平均RFU値は細胞数に対してプロットし、標準偏差はエラーバーとして示しました。A, cal AMを検出するためにスキャンした生細胞(黒丸の実線)と死細胞(開丸)で得られた蛍光シグナル(RFU)を示します。B, 生細胞と死細胞をスキャンしてEthD-1を検出した蛍光シグナルを示します。これらのグラフは、生細胞と死細胞のシグナルの違いを示しています。
結論
LIVE/DEAD Viability/Cytoxicity アッセイは、生細胞と死細胞を簡単かつ迅速に検出する方法です。最適化された波長設定を用いることで、 SPECTRAmax GEMINI XS マイクロプレートリーダーはこのアッセイを用いて生細胞と死細胞を区別することができます。このデータから、生細胞を分析する場合には死細胞からの干渉はほとんどないことが示唆されますが、死細胞を分析する場合には生細胞からの干渉がある可能性があります。このアッセイは、cal AM色素を用いた生細胞数の相対的減少を測定することを重視する増殖阻害および細胞死アッセイに特に適しているはずである。生細胞と死細胞の標準曲線は、SoftMax® Proソフトウェアとその統合された計算式を使用して簡単に作成できます。
参考文献
- Wagner, M. M., Paul, D. C., Shih, C., Jordan, M. A., Wilson, L., and Williams, D. C. In vitro pharmacology of cryptophycin 52 (LY355703) in human tumor cell lines. Cancer Chemother. Pharmacol. 43: 115-125 (1999).
- Adler, M., Shafer, H., Hamilton, T., and Petrali, J. P. Cytotoxic actions of the heavy metal chelator TPEN on NG108-15 neuroblastoma-glioma cells. Neurotoxicity 20: 571-582 (1999).
- Papadopoulos, N. G., Dedoussis, G. V., Spanakos, G., Gritzapis, A. D., Baxevanis, C. N., and Papamichail, M. An improved fluorescence assay for the determination of lymphocyte-mediated cytotoxicity using flow cytometry. J. Immunol. Methods 177: 101- 111 (1994).
- Wang, X. M., Terasaki, P. I., Rankin, G. W., Chia, D., Zhong, H. P., and Hardy, S. A new microcellular cytotoxicity test based on calcein AM release. Human Immunology 37: 264-270 (1993).
- Hausner, J. M. L., Buehrer, B. M., and Bell, R. M. Role of ceramide in mitogenesis induced by exogenous sphingoid bases. J. Biol. Chem. 269: 6803-6809 (1994).
- Jacobson, M. D., Weil, M. and Raff, M. C. Role of Ced-3/ICE-family proteases in staurosporine-induced programmed cell death. J. Cell Biology 133: 1041-1051 (1996).
- Weil, M., Jacobson, M. D., Coles, H. S. R., Davies, T. J., Gardner, R. L., Raff, K. D., and Raff, M. C. Constitutive expression of the machinery for programmed cell death. J. Cell Biology 133: 1053-1059 (1996).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. J. Immunol. Methods 65: 55-63 (1983)
- Oral, H. B., George, A. J., and Haskard, D. O. A sensitive fluorometric assay for determining hydrogen peroxide-mediated sublethal and lethal endothelial cell injury. Endothelium 6: 143-151 (1998).
PDF版(英語)