Application Note FLIPR Tetraシステムを用いた
Tango GPCRアッセイによるGPCR活性測定
PDF版(英語)
はじめに
Lovisa Frostne,1 Linda Sundström1 and Cerys Huggins Ph. D.2
- リードジェネレーション部門、アストラゼネカR&D、モルンダル、スウェーデン;
- モレキュラーデバイス 660-665 エスクデール・ロード、ウィナーシュ・トライアングル、ウォーキンガム、UK
Gタンパク質共役受容体(GPCR)は創薬研究において最も重要な治療用タンパク質の一つです。GPCRは膜に局在するタンパク質で、細胞シグナリングや様々な生理機能の調節において極めて重要な役割を果たしています。GPCRがリガンドによって活性化されると、受容体の構造が変化し、細胞内のGタンパク質が活性化されます。活性化されたGタンパク質は、カルシウムを含む様々な細胞内メッセンジャーのカスケードを誘導する可能性があります。細胞ベースアッセイは、創薬の初期段階におけるスクリーニングや化合物のプロファイリングに欠かせない手法です。モレキュラーデバイスのFLIPR® Tetraシステムを用いたカルシウム流動アッセイは、Gq共役型GPCRターゲットの主要なアッセイの一つです。
活性化されたGPCRは脱感作として知られるプロセスによって遮断されますが、これは特異性キナーゼ(GRK)による活性化受容体のリン酸化と、それに続くアレスチンタンパク質のリン酸化受容体への結合の結果です。活性化されたレセプターに結合したアレスチンタンパク質は、反応性が再感作プロセスも開始します。GPCR活性化後のß-アレスチン結合をアッセイする能力は、セカンドメッセンジャー経路に依存しないGPCRシグナル伝達の指標を研究者に提供するだけでなく、オーファン受容体を含むサブタイプに関係なく、ほとんどのGPCRの活性化を測定する手段を提供する可能性があります。
Tango™ GPCRアッセイ技術は、プロテアーゼでタグ付けされたß-アレスチンと、その細胞質尾部で外来転写因子と融合したリコンビナントGPCRを発現する細胞を用います。受容体と転写因子の間には、非ネイティブプロテアーゼの特異的切断配列があります。アゴニストが結合して受容体が活性化されると、プロテアーゼタグを付加したβ-アレスチンがGPCRに動員します。プロテアーゼはGPCRから転写因子を切断し、転写因子は核に移動してβ-ラクタマーゼレポーター遺伝子の発現を促進します(図1)。
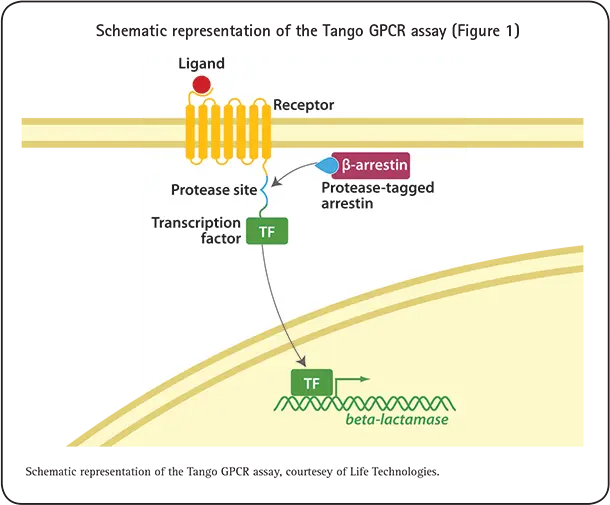
その後のβ-ラクタマーゼ発現の活性化により、標的レセプターとプロテアセタグ化されたアレスチンパートナーとの相互作用の程度を定量的に測定することができます。Tango GPCRアッセイは、クマリンとフルオレセインという2つの蛍光色素を封じ込めたエンジニアリング蛍光基質を利用します。β-ラクタマーゼ非存在下では、基質分子は無傷のままであり、この状態でクマリンを励起すると、フルオレセイン部分への蛍光共鳴エネルギー移動(FRET)が起こり、緑色の蛍光が発光します。TangoアッセイのエンジニアリングGPCRが活性化され、β-ラクタマーゼが産生されると、このクマリン-フルオレセイン基質が切断され、2つの蛍光体が分離してFRETが妨害され、クマリンからの青色蛍光シグナルが生じます。
従来、Life Technologies社のTango GPCRアッセイは、マイクロプレートリーダーを使って読み取っていました。しかし、これらのシステムは一般的にPMTベースであり、ランプのフラッシュ数にもよりますが、384ウェルのマイクロプレート全体を読み取るのに3-5分かかります。また、PMT検出器の数によって速度が制限されるため、スループットにも限界があります。スループットを向上させるため、FLIPR Tetraシステムを使用してプレートを読み取りました。この機器は、GPCRやイオンチャネルをモニターするためのツールとして業界で有名であり、Tangoアッセイに必要なプレートの下から読み取る機能を備えています。このシステムは、創薬プロセスにおける初期のリード化合物を同定するための、信頼性と柔軟性に優れたハイスループットスクリーニングソリューションをご提供します。Tango GPCRアッセイはエンドポイントアッセイであり、カルシウム流動アッセイや膜電位アッセイのような高速カイネティックアッセイに不可欠なFLIPR Tetraシステムの流体移動機能は必要ありません。しかし、ScreenWorks® ソフトウェアとEMCCDカメラを併用することで、機器は最大1536ウェルプレートの全ウェルを同時に、しかも従来のプレートリーダーよりもはるかに高速で読み取ることができます。さらに、この機器は、FRETアッセイで必要とされるデュアルエミッションレシオメトリック検出を容易に組み込むことができます。これが、Tango GPCRアッセイの測定においてFLIPR Tetraシステムを検討する最大の理由です。最後に、FLIPR Tetraシステムがロボットシステムに統合工学的に組み込むことができるということは、Tango GPCRアッセイ技術とFLIPR Tetraシステムの1536ウェルフォーマットでのuHTSキャンペーンを組み合わせる可能性があるということです。このアプリケーションプロトコールは、FLIPR TetraシステムでTango GPCRアッセイを384ウェルおよび1536ウェルフォーマットで実施するための基本プロトコルをご提供します。
- FLIPR Tetraシステムには、蛍光アッセイ用のEMCCDカメラオプションと、蛍光および発光アッセイ用のICCDカメラオプションがあります。
材料
- Tango GPCR-X-bla U2OS 細胞 (Life Technologies)
- Tango GPCR-Y-bla U2OS 細胞 (Life Technologies)
- 増殖培地(完全) McCoyの5A培地(Life Technologies)に10% FBS(Hyclone)、0.1mM ・NEAA(Life Technologies)、25mM Hepes(Life Technologies)、1mM ピルビン酸ナトリウム(Life Technologies #200μg/mLのZeocin™(Life Technologies)、50μg/mLのHygromycin(Life Technologies)、100μg/mLのGeneticin ®(Life Technologies)。
・凍結培地: 上記の完全培地、20% FBS(Life Technologies)、10% DMSO(Sigma-Aldrich ) - PBS(Life Technologies)
- アキュターゼ(PAA)
- LiveBLAzer™-FRET B/G Loading kit: LiveBLAzer-FRET B/G 基質(C C4- AM)、溶液 A、溶液 B および溶液 C 用 DMSO(Life Technologies)
- 溶液 D(Life Technologies)
- アッセイ培地 FreeStyle™ Expression Medium(Life Technologies)
- 黒色、透明底 384 ウェルアッセイプレート(Corning CellBind)
- 黒色、透明底 1536 ウェルプレート(Corning CellBind)
- 透明384ウェルプレート(Greiner)
- 透明1536ウェルプレート(Greiner)
- FLIPR Tetra システム(モレキュラーデバイス)、EMCCDカメラ、440-480 nmおよび515-575 nmエミッションフィルター付き。
方法
細胞の調製
細胞を解凍し、供給元の推奨する方法に従って増殖させました。凍結保存のため、細胞は10層ファクトリー(Corning) コンフルエンス80%で、細胞をAccutaseで回収し、完全培地に再懸濁し、Cedex cell counter(Innovatis)を用いて計数し、1000 rpm(RT)で10分間遠心した後、凍結培地に再懸濁し、20 x 106 cells/mlの濃度で1 mL凍結バイアル(Nunc)に分注し、1℃/分の速度で凍結し、-180℃で保存しました。
アッセイ当日または使用前日に、凍結保存した細胞(1mL)を37℃の水浴中で融解し、温めたAssay培地(材料参照)9mLに加えました。その後、細胞を1000rpmで4分間遠心し、細胞ペレットをAssay培地に再懸濁し、Cedexセルカウンターを用いて計数しました。細胞は、適宜、アッセイ培地で2.5 x 105または4.5 x 105 cells/mLに希釈しました。
アゴニストアッセイの調製
Tango GPCRアッセイは、以下に述べるような修正を加えながら、製造元の説明書に従って実施しました。関連するマイクロプレートフォーマットおよびアッセイフォーマットに対する化合物、細胞、アッセイ試薬の正確な量は、表1および表2に記載されています。細胞は、アッセイ開発過程で最も適切と判断された接着細胞 または懸濁細胞のいずれかを使用しました。理想的には、作業しやすく、時間の節約になり、マイクロプ レートの消費量を減らし、キャリーオーバーや細胞混入のリ スクを減らすことができる懸濁液の細胞を使用することです。
アゴニストアッセイの準備 - 懸濁細胞
LabCyte® Echo 555リキッドハンドラーを用いて、適切なリガンド(DMSO中)と適切なコントロールの濃度反応系列を384ウェルの黒色透明底マイクロプレートに調製しました。次に、必要な数のTango GPCRX bla U2OS細胞(表1)を、Multidrop® Combi(Thermo Scientific)を用いてアッセイプレートに加えました。その後、アッセイプレートを37℃、5% CO2、湿度95%で5時間インキュベートしました。このインキュベーション工程の後、クマリン-フルオレセイン基質を封じ込めたTango MixをMultidrop Combiを用いて添加し、室温、暗所で1.5-2時間インキュベートしました。
| 表1. 懸濁細胞を用いたアゴニストアッセイに使用したTango GPCR-Xアッセイの成分と容量 |
|
|---|---|
| マイクロプレートフォーマット | |
| 384ウェル | |
| 受容体リガンド(DMSO) | 0.2 µL |
|
細胞 (2.5 x 10 5 cells/mL) |
40 µL |
|
タンゴミックス |
8 µL |
アゴニストアッセイの調製-接着細胞
GPCR-Yについては、必要な数のTango GPCR-Y bla U2OS細胞(表2)を、Multidrop Combi(Thermo Scientific)を用いて384ウェルまたは1536ウェルの黒色透明底マイクロプレートに分注しました。その後、セルプレートを37℃、5% CO2、湿度95%で18時間インキュベートしました。
LabCyte Echo 555リキッドハンドラーを用いて、384ウェルまたは1536ウェルの透明マイクロプレートに、適切なリガンド(DMSO中)と適切なコントロールの濃度反応系列を調製しました。この化合物プレートをMultidrop Combi(Thermo Scientific社製)を用いてアッセイ培地であらかじめ希釈し、FLIPR Tetra システムを用いてセルプレートに移しました。その後、アッセイプレート(以前はセルプレートと呼ばれていた)を37℃、5%CO2、湿度95%で5時間インキュベートしました。このインキュベーション工程の後、クマリン-フルオレセイン基質を含むTango MixをMultidrop CombiまたはFLIPR Tetra システムを用いて添加し、その後、アッセイミクロプレートを室温、暗所で1.5~2時間インキュベートしました。
| 表2. 接着細胞を用いたアゴニストアッセイに使用したTango GPCR-Yアッセイの成分と容量(マイクロプレートフォーマット別) | ||
|---|---|---|
| マイクロプレートフォーマット | ||
| 384ウェル | 1536ウェル | |
| 細胞(4.5 x 105 cells/mL) | 20 μL | 4 μL |
| 受容体リガンド(アッセイ培地) | 10 μL | 1 μL |
| タンゴミックス | 6 μL | 1 μL |
アンタゴニストアッセイの調製-接着細胞
必要な数のTango GPCR-Y bla U2OS細胞(表3)を、Multidrop Combiを用いて384ウェルの黒色透明底マイクロプレートに分注し、アッセイ前に37℃、5%CO2、湿度95%で18時間インキュベートしました。
LabCyte Echo 555リキッドハンドラーを用いて、適切な化合物(DMSO中)と適切なコントロールの濃度反応シリーズを384ウェル透明マイクロプレートに分注しました。アッセイ培地をMultidrop Combiを用いて化合物プレートに分注しました。上記の混合液5µLをBiomek NXを用いてセルプレートに移しました。アッセイプレート(以前はセルプレートと呼ばれた)を37℃、5%CO2、湿度95%で15分間インキュベートした後、EC80濃度の受容体リガンドを適量加えました。次にアッセイプレートを37℃、5%CO2、95%湿度で5時間インキュベートしました。このインキュベーション工程の後、Multidrop CombiまたはFLIPR Tetraシステムを用いてTango Mixを添加し、室温、暗所で1.5~2時間インキュベートしました。
| 表3. 接着細胞を用いたアンタゴニストアッセイセットアップに使用したTango GPCR-Yアッセイの成分と容量 | |
|---|---|
| マイクロプレートフォーマット | |
| 384ウェル | |
|
細胞 (4.5 x 10 5 cells/mL) |
20 μL |
| 化合物(アッセイ培地) | 5 μL |
|
受容体リガンド (EC 80 ) |
5 μL |
|
タンゴミックス |
6 μL |
機器セットアップとデータ解析
Tango Mixでインキュベートした後、アッセイプレートをFLIPR Tetraシステムにセットしました。ScreenWorksソフトウェアで表4に示すパラメーターを用いてプロトコルを作成し、サンプルを室温で測定しました。Ex 390-420 nm/Em 440-480 nmの測定では、遊離したクマリンを検出するために青色チャンネルの蛍光を測定し、Ex 390-420 nm/Em 515-575の測定では、緑色チャンネルのFRETシグナルを測定しました。
ScreenWorks ソフトウェアでは、2つの異なる「Read Mode」に対して異なるカメラゲイン設定を選択できることは注目に値します。アッセイ開発中に、必要とされる異なる光学系の組み合わせに対して同じまたは異なるカメラゲイン設定を行うことが、Signal:Backgroundや薬理学に影響を及ぼすかどうかを調べましたが、影響はありませんでした。しかし、各波長に対して同じゲイン設定を使用することで、読み取り時間を短縮できることに留意してください。
蛍光測定は1.7秒ごとに5秒間行いました。ScreenWorksソフトウエアを用いて、3回の測定値の平均RFUを算出しました。データはアストラゼネカ社内で開発されたソフトウェアパッケージにエクスポートされ、濃度反応曲線の作成、標準偏差、EC50、Z'-factorの算出に使用されました。
| 表4. FLIPR TetraシステムとTango GPCRアッセイのセットアップパラメータ | |
|---|---|
| パラメータ | 設定 |
| 読み取りモード | 蛍光 |
| 読み取りモード | 蛍光 |
| 励起/発光 | |
| 読み取りモード1 | 390-420/440-480 |
| 読み取りモード2 | 390-420/515-575 |
| EMCCDカメラゲイン | 150 |
| 励起強度 | 100 |
| 露光時間 | 0.4秒 |
| 読み取り間隔 | 1.7 秒 |
| 読み取り回数 | 3 |
測定結果
活性化GPCRにおけるß-アレスチン相互作用は、Tango GPCRアッセイテクノロジーとFLIPR Tetraシステムを組み合わせて測定することができます。蛍光は、クマリンとフルオレセインの発光スペクトルに対応する2つの異なる発光波長で相対蛍光単位(RLU)として測定されます。RLUを3時点で測定し、それぞれのWavelengthについて平均し、Em 460/530 nmの比を計算しました。多数の複製サンプルの比(460/530 nm; 青/緑)を平均し、アゴニスト/アンタゴニスト濃度に対してプロットし、4-Parameter Logistic Modelを用いて濃度反応曲線を作成し(図2,3,4)、EC50/IC50値を算出しました。この研究はn≧3を表しています。EC50/IC50は、文献やマイクロプレートリーダーを用いて得られた値と一致しています。
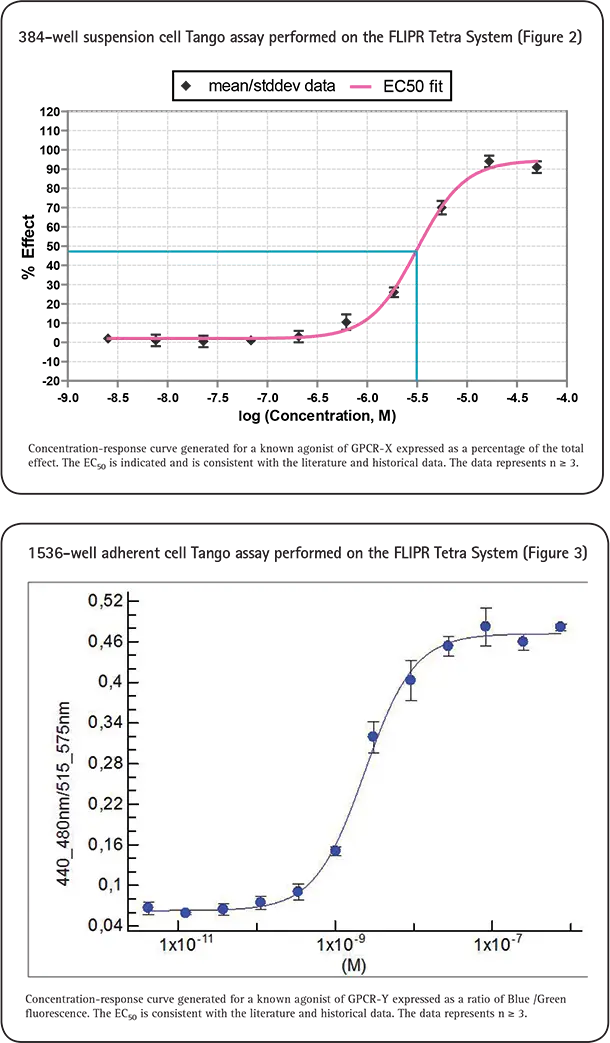
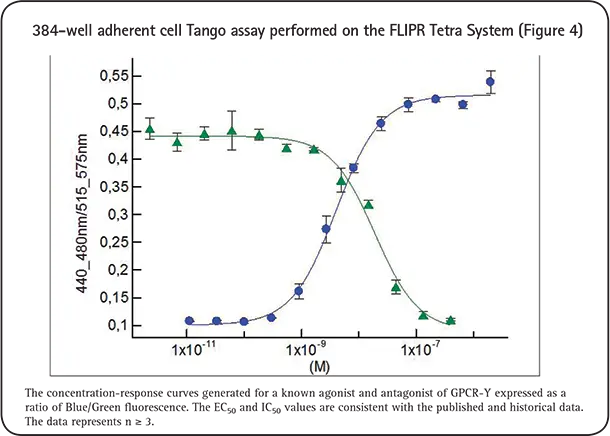
このデータは、FLIPR Tetraシステムを用いてハイスループットでTangoアッセイを実施するという私達の決断を後押しするものでした。図5は、384ウェルフォーマットでアンタゴニストスクリーンを行った30枚のプレートのデータです。
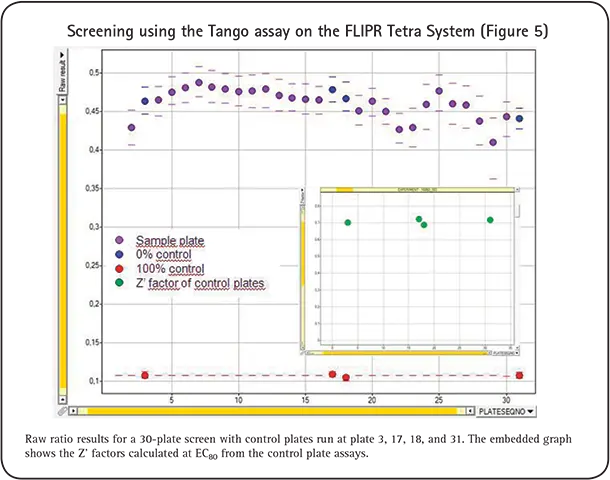
結論
FLIPR Tetraシステムは、カイネティックの速いGPCRやイオ ンチャネルアッセイのuHTSやHTSに長年使用されてきました。現在使用しているマイクロプレートリーダーでは、フォーマットやスループットに限界があるため、FLIPR TetraシステムでTangoアッセイをモニターできるかどうかを検討しました。FLIPR Tetraシステムでは、励起LEDとエミッションフィルターの選択が可能であるため、この可能性が現実のものとなりました。さらに、CCDカメラによる検出方式は、FLIPR Tetraシステムがプレート全体を一度に読み取ることができるため、PMTベースのマイクロプレートリーダーよりもスループットが大幅に向上しました。さらに、FLIPR Tetraシステムとロボットシステムとの統合工学により、Tango AssayのHTSキャンペーンの実施が現実味を帯びてきました。
本研究では、FLIPR Tetraシステムを用いて、接着細胞と浮遊細胞、384および1536フォーマットの両方でTango GPCRアッセイを測定できることを実証しました。これらの実験から得られたデータは、蛍光マイクロプレートリーダーで得られたデータとの相関から、TangoアッセイのモニタリングにFLIPR Tetraシステムを使用することが支持されました。
謝辞
低温細胞の調製を手伝ってくれたMariska Van GiezenとLouise Wallin(AstraZeneca LG DECS)に感謝します。GPCR-Y Tangoアッセイに協力してくれたAmalia Ignberg(AstraZeneca LG DECS)に感謝します。編集協力:Carole Crittenden(モレキュラーデバイス)
PDF版(英語)