Application Note ハイコンテントイメージングで
ミトコンドリア動態を解析
- ミトコンドリアの形状や構造変化を高品質な画像でより鮮明に可視化できます
- ミトコンドリアのフェノタイプ変化を、より効率的かつ正確に定量・測定できます
- 疾患メカニズムを理解し、さまざまな細胞モデルで化合物の毒性を評価できます
PDF版(英語)
Oksana Sirenko, PhD |上級研究員|モレキュラーデバイス
Jayne Hesley |シニア・アプリケーション・サイエンティスト|モレキュラーデバイス
はじめに
ミトコンドリアは細胞の主要なエネルギー源であり、細胞代謝の調節に重要な役割を果たします。ミトコンドリアは、環境条件や細胞の要求に応じて構造を変化させることができます。ミトコンドリアのダイナミクスは、分裂(fission)、融合(fusion)、マイトファジー(mitophagy)、生合成(biogenesis)など、ミトコンドリア形態を調節する複数のプロセスによって駆動されます。
分裂は、より多くの円形で小型のミトコンドリアを生成します。一方、融合は、より少数の細長く大型のミトコンドリアを生成します。ミトコンドリアの分裂と融合という相反するプロセスは、ミトコンドリアの品質管理と正常な細胞恒常性の維持に関与しており、どちらも正常な細胞機能に不可欠です *2,*3。
マイトファジーは損傷したミトコンドリアを除去するプロセスであり、正常なミトコンドリアリサイクルの重要な要素です *3。損傷または老化したミトコンドリアは非対称分裂を行い、健全な成分は新しいミトコンドリアに送達され、損傷した成分は脱分極した小型成分に分離され、マイトファジーによって迅速に除去されます *4。生合成は、新しいミトコンドリア成分を合成するプロセスです。
ミトコンドリアダイナミクスの病的変化は、生体エネルギーの障害やミトコンドリア依存性細胞死を引き起こし、虚血性心筋症、糖尿病、肺高血圧症、パーキンソン病、ハンチントン病、骨格筋萎縮、アルツハイマー病など、幅広い病態と関連しています *1,*5。ニューロンは解糖系の能力が限られており、エネルギー消費が高いため、ミトコンドリア機能の変化に特に敏感です *6。心筋細胞もミトコンドリアの体積分率が非常に高く、ミトコンドリアダイナミクスの変化に特異的に敏感です *7,*8。さらに、がんにおいてもミトコンドリアダイナミクスの変化は重要な役割を果たし、融合は細胞のアポトーシスシグナルへの感受性を低下させ、有酸素解糖(ワールブルグ効果)を誘導し、アポトーシス細胞死を減少させることでがん細胞の増殖を促進する可能性があります *9。
ミトコンドリアダイナミクスの変化は、ストレスに対する正常な生理学的応答である場合もあります。運動中の骨格筋に関する研究では、エネルギー恒常性の維持におけるミトコンドリア断片化の役割が示唆されています。回復期には融合が活性化され、慢性的な運動ではミトコンドリア生合成が促進されます *10。
近年、ミトコンドリア構造のリモデリングを研究するためにハイコンテントイメージング法を使用することへの関心が高まっています。共焦点イメージングと水浸対物レンズは、画像品質を向上させ、ミトコンドリア構造の視覚化を改善します。また、画像解析ツールを利用することで、異なるフェノタイプの数値的特徴付けが可能です。本研究では、細胞ベースアッセイにおけるミトコンドリアダイナミクスの研究に使用できる、ミトコンドリアのフェノタイプおよび構造再編成のためのフェノタイプアッセイについて説明します。
材料
ヒト神経芽細胞腫PC12細胞はATCCから入手しました。Hoechst 33342およびMitoTracker Orange CMTMRosはThermo Fisherから購入しました。化学化合物はSigmaから購入しました。
方法
ヒト神経芽細胞腫PC12細胞をGreiner社製384ウェルプレートにウェルあたり3,000細胞で播種しました。翌日、細胞を18時間処理しました。処理には、ミトコンドリアに影響を与えることが知られている複数のベンチマーク化合物を使用しました:クロロキン(0~100 μM)、ロテノン(0~10 μM)、バリノマイシン(0~1 μM)、メチル水銀(0~10 μM)。各化合物は7段階の濃度で半対数希釈し、4連複製でサンプルサイズn=8で試験しました。処理後、生細胞をミトコンドリア染料Mitotracker Orange CMTMRosと核染料Hoechst 33342(それぞれ0.2 μMおよび0.5 μM)で30分間染色し、ImageXpress® Micro Confocalシステム(モレキュラーデバイス)で撮像しました。生細胞の画像は共焦点モードと40X水浸対物レンズを使用して取得しました。各ウェルで3~4サイトを撮像しました。アッセイ性能を向上させるため、0.6~1 μm間隔で3~4枚の画像平面のzスタックを取得しました。核はDAPIチャンネル、ミトコンドリアはTRITCチャンネルで撮像し、それぞれ100 msおよび400 msの露光時間を設定しました。画像はMetaXpress®ハイコンテント画像取得・解析ソフトウェアのカスタムモジュールエディターで解析しました。詳細は結果セクションで説明します。概要として、Find Fibersモジュールを使用して細長いミトコンドリアを識別し、Granularityモジュールでより円形の粒子を識別しました。細胞境界をアウトライン化し、細胞ごとのオブジェクト数をカウントしました。二次解析はExcelまたはSoftMax® Proソフトウェアのカーブフィッティングツールを使用して行いました。Z’値は次の式で計算しました:
\[ Z' = 1 - 3 \times \frac{\text{STDEV}_{\text{control}} + \text{STDEV}_{\text{experiment}}}{\text{AVE}_{\text{control}} - \text{AVE}_{\text{experiment}}} \]
結果
ミトコンドリアの完全性と形状を特徴付けることは、疾患メカニズムの理解や毒性評価に重要です。ミトコンドリアの数、明るさ、サイズ、長さ、形状は、ミトコンドリアリサイクル中に変化し、細胞の健康状態や代謝変化を示したり、アポトーシス過程の前兆となる可能性があります。私たちは、コントロールPC12神経芽細胞腫細胞のミトコンドリアフェノタイプと、ミトコンドリアに影響を与えることが知られている化合物による変化を比較しました。クロロキンはミトコンドリアリサイクルを阻害し、ロテノンは酸化的リン酸化の阻害剤、バリノマイシンはカリウムイオノフォアであり、ミトコンドリア膜電位を破壊します。細胞は各化合物のさまざまな濃度で18時間処理されました。MitoTracker OrangeとHoechst核染料で染色された細胞の画像は、40X水浸対物レンズを用いた共焦点モードでイメージングされ、個々のミトコンドリアを鮮明に表示して詳細に観察、形状変化をモニタリングできました。
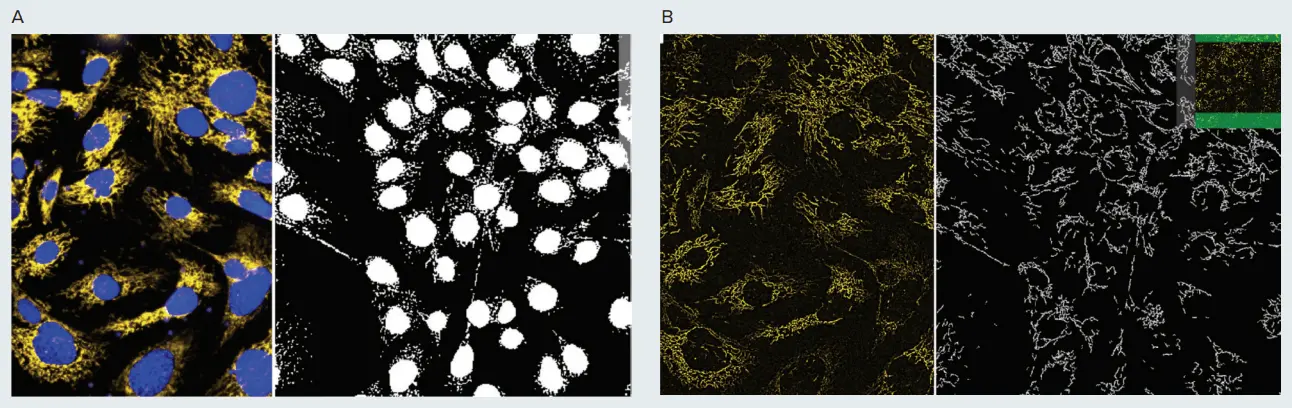
図1. ミトコンドリア形状の表現型解析 PC12神経芽細胞腫細胞をMitoTracker OrangeおよびHoechstで15分間染色し、IXM-Cを用いて40Xウォーターイマージョン対物レンズの共焦点モードでイメージングしました。画像はMetaXpress Custom Module EditorのGranularity(A)およびFind Fibers(B)モジュールを使用して解析しました。A. 核は青で、健全なミトコンドリアは黄色で表示されています。分割画像の右側には、核およびミトコンドリア(グラニュール)のマスクが白で示されています。B. 黄色のミトコンドリア画像は、画像シャープ化アルゴリズム(Top Hat)で前処理されています。右側の分割画像には「ファイバー」構造のマスクが表示されています。
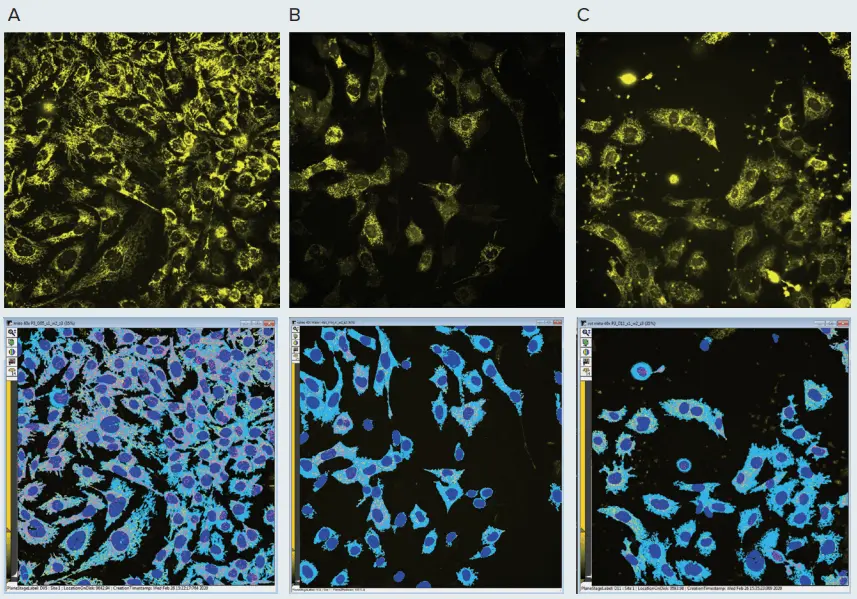
図2. 化合物によるミトコンドリアへの影響。上段は、コントロールPC12神経芽細胞腫細胞(A)またはミトコンドリアに損傷を与えることが知られている化合物(valinomycin(B)、rotenone(C))を100 nMで18時間処理した細胞のMitoTracker CMTMRosミトコンドリア染色(黄色)を示しています。細胞はIXM-Cを用いて40Xウォーターイマージョン対物レンズの共焦点モードでイメージングしました。画像の輝度は、ミトコンドリアの視認性を高めるために調整されています。ミトコンドリア形状の変化に注目してください:valinomycinではミトコンドリアの糸状構造が小さな粒子に断片化し、rotenoneではミトコンドリアが絡まり崩壊しています。画像はMetaXpress Custom Module Editorで解析しました。下段の解析マスクは、ミトコンドリアのグラニュール(ピンク)、ファイバー構造(黄色)、核(濃青)、細胞体(淡青)を示しています。
図1および図2は、ミトコンドリアの画像、コントロールサンプル、および化合物処理サンプルを示しています。例えば、図2に示されるミトコンドリア表現型の変化に注目してください。コントロール細胞では長いミトコンドリアファイバーが見られますが、valinomycin処理ではミトコンドリアが断片化し、より小さなドットとして観察されます。rotenone処理では、ミトコンドリアが断片化し核周囲に凝集しました。重要な点として、valinomycinおよびrotenoneはミトコンドリアの膜電位を低下させ、蛍光強度の減少として反映されました(図2)。chloroquineの影響は目視では明確ではありませんでしたが、画像解析による形態変化で確認できました(後述)。化合物の影響には濃度依存性が認められました(図2)。低濃度では形態変化が明確に観察され、高濃度ではミトコンドリア膜電位の喪失、構造の破壊、細胞死の進行が見られました。
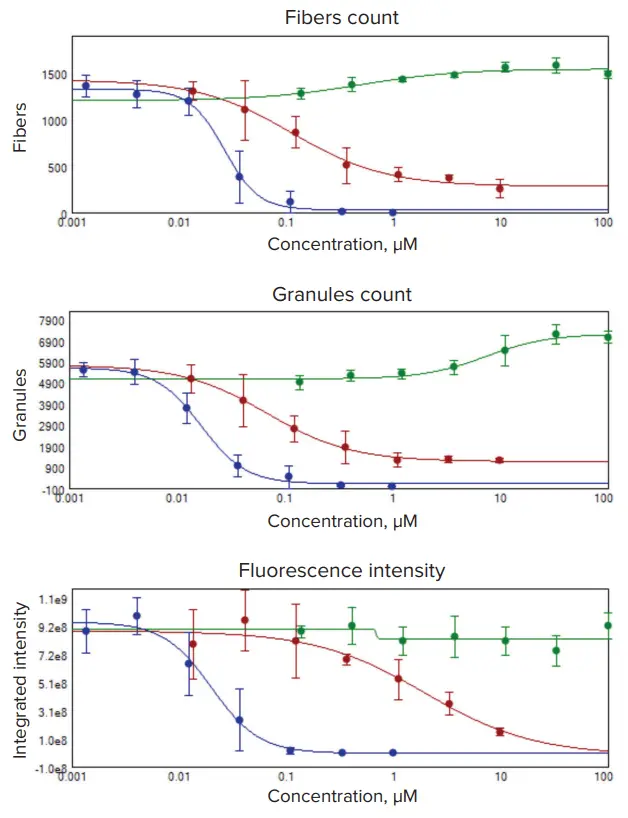
図3. 濃度依存性。PC12神経芽細胞腫細胞を、ミトコンドリアリサイクルを阻害するchloroquine、酸化的リン酸化阻害剤rotenone、ミトコンドリア膜電位を破壊するカリウムイオノフォアvalinomycinで処理しました。細胞は、指定濃度の化合物で4連のサンプルを用いて18時間処理しました。染色およびイメージングは図1および図2と同様に行いました。画像解析では、ミトコンドリア構造を「ファイバー」(上段)または「グラニュール」(中段)として識別しました。EC₅₀値は、4連サンプルの濃度依存性データから4パラメータカーブフィットで算出しました。追加のプロットは、ミトコンドリア染色の蛍光強度変化を示します。chloroquineは緑、rotenoneは赤、valinomycinは青で表示されています。
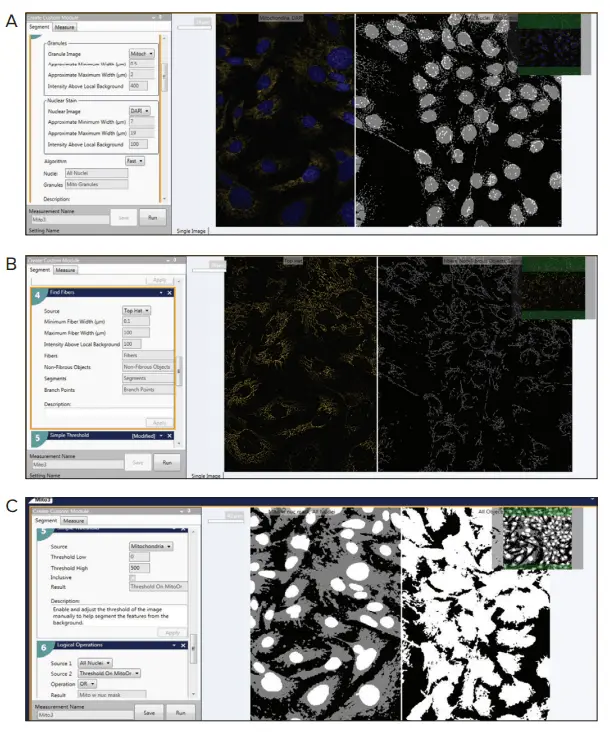
図4. Custom Module Editor(概要)Custom Module Editorは、ミトコンドリアの表現型をカウントおよび解析し、ミトコンドリアのヘルス、代謝、リサイクル、化合物の影響、疾患状態の評価を目的として設計されています。
このモジュールには以下のステップが含まれます:
- Granularityモジュール:ミトコンドリア粒子の検出
- Top Hatフィルターによる画像前処理
- Find Fibersモジュール:ミトコンドリア粒子および分裂・融合の検出
- Simple Threshold:細胞体の識別
各オブジェクトの測定値は、画像全体または細胞ごとに適用できます。測定項目はアプリケーションに依存しますが、特に興味深い測定値は以下の通りです:
- 核数(セルカウント)
- 核の平均面積/平均強度
- 総グラニュール数(サイトごと)
- 細胞ごとのグラニュール数
- グラニュール面積平均、総面積、強度平均または積分強度平均
- 総ファイバー数(画像ごと)
- 細胞ごとのファイバー数
- ファイバー長平均、総長、強度平均
|
EC₅₀ , nM |
繊維数 | 顆粒数 |
|---|---|---|
| ロテノン | クロロキン | バリノマイシン |
| 112 ± 30 | 488 ± 1000 | 26 ± 2.3 |
| 68 ± 10 | 7260 ±2000 | 17 ± 2.0 |
表1. EC₅₀値は図3のカーブから算出しました
形態測定値はMetaXpressソフトウェアのツールを使用して取得しました。Custom Module Editorを活用し、「グラニュール」または「ファイバー」と定義できるオブジェクトを検出・特徴付けしました。グラニュールはGranularityモジュールで定義し、ファイバー構造やセグメントはFind Fibersモジュールで決定しました。構造は、最小・最大幅や局所背景に対する強度などのユーザー定義基準で決定されます。画像前処理(シャープ化)は、ファイバーの定義を改善するためのオプションステップとして使用しました(図1)。オブジェクトの数、面積、強度、長さ、形状は、細胞単位または画像単位で平均値や合計値として定義できます(図2)。これらの測定値は、ミトコンドリア構造ダイナミクスの特徴付け(図4)、用量反応や化合物の有効濃度の算出(図3)に利用できます。特に、ミトコンドリア毒性が知られる化合物処理では、ミトコンドリア膜電位の低下(粒子数や強度の減少)に加え、ファイバー長の総量や平均値の変化が認められ、valinomycin処理で顕著でした(図4)。一方、ミトコンドリアリサイクルを阻害するchloroquine処理では、ミトコンドリアの蓄積によりファイバー数が増加しました。
| コントロール | ロテノン | クロロキン | バリノマイシン | |
|---|---|---|---|---|
| 細胞数 | 44.5c ± 9.5 | 30 ± 5.5 | 46 ± 8.7 | 57 ± 11 |
| 繊維数(合計) | 2606 ± 250 | 564 ± 47 | 3791 ± 287 | 32 ± 44 |
| 繊維長平均 (µm) | 4.4 ± 0 | 3.9 ± 0.1 | 5.3 ± 0.3 | 2.7 ± 0.2 |
| 繊維(細胞当たり) | 131 ± 34.7 | 8 ± 1 | 383 ± 57.4 | 1 ± 0.9 |
| 繊維長合計(細胞当たり) | 431 ± 87.3 | 68 ± 15.3 | 3457 ± 912 | 54 ± 11 |
| 顆粒(合計) | 4739 ± 413 | 963 ± 131 | 8088 ± 887 | 105 ± 54 |
| 顆粒(細胞あたり) | 97 ± 24.8 | 5 ± 1.3 | 529 ± 94 | 2 ± 1.2 |
| 顆粒面積和(細胞当たり) | 114 ± 39.6 | 18 ± 0.7 | 609 ± 231 | 0 |
| 顆粒平均強度 | 1009 ± 47.8 | 1342 ± 73.1 | 1068 ± 43.1 | 944 ± 23.1 |
表2. コントロールおよび化合物処理サンプルの測定値比較。データは、コントロール、chloroquine(10 µM)、rotenone(300 nM)、valinomycin(10 nM)の結果を示します。
表2は、コントロールおよび化合物処理サンプルの測定値比較を示します。データは、chloroquine(20 µM)、rotenone(300 nM)、valinomycin(100 nM)の中間濃度で取得しました。rotenoneおよびvalinomycin処理後には、ミトコンドリアファイバーの数と長さが濃度依存的に減少し、chloroquineでは逆の効果が見られました。Granularity解析で決定されたグラニュールの数と面積も、valinomycinおよびrotenoneで減少しました。この方法は多様な測定値を導き出すことができ、複雑な生物学的変化におけるシグナル伝達経路や化合物の影響を多面的に評価するために利用できます。
| Z'値 | WI 40X | Air 40X |
|---|---|---|
| 全繊維 | 0.52 | 0.42 |
| 顆粒 | 0.55 | 0.41 |
| セグメント合計 | 0.5 | 0.38 |
表3. 水浸対物レンズは画像品質を改善し、空気対物レンズと比較して粒子数の識別精度を向上させ、結果としてZ値が高くなりました。
アッセイ開発中に、水浸対物レンズと空気対物レンズの画像品質および解析への影響を比較しました。特に、水浸対物レンズを使用することで画像品質が向上し、通常Z’値が増加しました(表3)。今回の解析はファイバーとグラニュールを排他的に扱っていないため、推奨プロトコールに従ってファイバーとグラニュールの値を独立してカウントしました。使用したCustom Moduleの説明は図5に示されています。これは特定の細胞タイプや疾患モデルに合わせて調整・改良することが可能です。
結論
本稿では、ハイコンテントイメージングと高度な画像解析を用いたミトコンドリアダイナミクス解析の方法を紹介しました。本手法は、ミトコンドリアの表現型変化を定量化でき、疾患表現型や化合物の影響を特徴付けるために、正常および病理学的な構造変化の研究に利用できます。自動イメージングは、さまざまな細胞モデルにおける創薬や化合物の毒性評価にも適用可能です。
参考文献
- Roberta A. Gottlieb, M.D., and Daniel Bernstein, M.D. Mitochondrial Remodeling: Rearranging, Recycling, and Reprogramming. Cell Calcium. 2016 Aug; 60(2): 88–101.
- Yisang Yoon, Eugene W Krueger, Barbara J Oswald, Mark A McNiven. The Mitochondrial Protein hFis1 Regulates Mitochondrial Fission in Mammalian Cells Through an Interaction With the Dynamin-Like Protein DLP1. Mol Cell Biol , 23 (15), 5409-20 2003
- McLelland GL, Soubannier V, Chen CX, McBride HM, Fon EA. Parkin and PINK1 function in a vesicular trafficking pathway regulating mitochondrial quality control. EMBO J. 2014;33:282–295.
- Twig G, Elorza A, Molina AJ, Mohamed H, Wikstrom JD, Walzer G, Stiles L, Haigh SE, Katz S, Las G, et al. Fission and selective fusion govern mitochondrial segregation and elimination by autophagy. EMBO J. 2008;27:433–446.
- Archer SL. Mitochondrial dynamics--mitochondrial fission and fusion in human diseases. N Engl J Med. 2013;369:2236–2251.
- Qi X, Disatnik MH, Shen N, Sobel RA, Mochly-Rosen D. Aberrant mitochondrial fission in neurons induced by protein kinase C{delta} under oxidative stress conditions in vivo. Molecular biology of the cell. 2011;22:256–265.
- Yu T, Sheu SS, Robotham JL, Yoon Y. Mitochondrial fission mediates high glucose-induced cell death through elevated production of reactive oxygen species. Cardiovasc Res. 2008;79:341–351.
- Sang-Bing Ong , Sapna Subrayan, Shiang Y Lim, Derek M Yellon, Sean M Davidson, Derek J Hausenloy. Inhibiting Mitochondrial Fission Protects the Heart Against Ischemia/Reperfusion Injury. Circulation , 121 (18), 2012-22 2010
- Suen DF, Norris KL, Youle RJ. Mitochondrial dynamics and apoptosis. Genes Dev. 2008;22:1577–1590.
- Konopka AR, Suer MK, Wolff CA, Harber MP. Markers of Human Skeletal Muscle Mitochondrial Biogenesis and Quality Control: Effects of Age and Aerobic Exercise Training. The journals of gerontology. Series A, Biological sciences and medical sciences 2013.
PDF版(英語)