Application Note SpectraMax i3xプレートリーダー(インジェクターモジュール搭載)で
Gqタンパク質共役受容体の活性化モニタリング
- EC 50およびIC 50の値は、ハイスループット・スクリーニング・システムで以前に発表された値と密接に一致
- デッドボリュームを最小限に抑えることで、コストのかかる化合物を節約
- SoftMax Proソフトウェアを使用して、リアルタイムセルモニタリングを簡単に設定可能
- FLIPRカルシウムアッセイとの互換性
PDF版(英語)
はじめに
Gqタンパク質共役型受容体の活性化は、一般的に、蛍光プレートリーダー上のカルシウム感受性色素を用いて、生細胞でリ アルタイムにモニターされます。プレートリーダー内の自動リキッドハンドリングは、一般にアゴニスト化合物をマイクロプレート内の細胞に供給するために必要であり、その間に検出システムは化合物による蛍光強度値の変化をリアルタイムで読み取ります。得られたカイネティック測定の解析から、アゴニストやアンタゴニストのEC50値やIC50値など、化合物の反応プロファイルに関する情報が得られます。
このアプリケーションノートでは、SpectraMax®i3xマルチモードマイクロプレートリーダー(SpectraMaxインジェクターモジュール付き)を使用して、2つの異なる細胞株でカルシウムアッセイを行う方法について説明します。CHO M1WT3細胞は、M1ムスカリンGq共役型受容体を安定的にトランスフェクションしたチャイニーズハムスター卵巣細胞です。ヒト星細胞腫細胞株である1321N1は、内因性ムスカリン性コリン作動性受容体を発現しています。SoftMax® Proソフトウェアを使用したデータ解析により、両細胞株について正確なEC50値およびIC50値が得られ、ハイスループットスクリーニングシステムを使用した以前の結果に匹敵する結果が得られました。ソフトウェアのグラフィカル・ユーザー・インターフェースであるAcquisition Editorは、アッセイのインジェクターと検出パラメーターのセットアップを容易にしました(図1)。
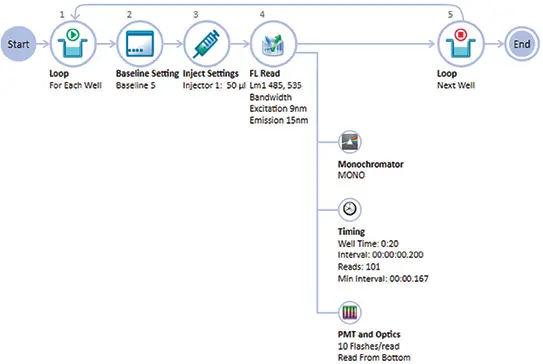
図1. SpectraMax i3xプレートリーダーを使用したカルシウムアッセイの採 取計画。SoftMax ProソフトウェアのAcquisition Editorは、ドラッグアンドドロップのグラフィカルなインターフェースで、アッセイのセットアップを簡単に行うことができます。
材料
●CHO M1WT3細胞(ATCC)
●1321N1細胞(ECACC)
●アゴニスト化合物
・塩化カルバモイルコリン(カルバコール;Sigma)
・塩化アセチルコリン(Sigma)
●アンタゴニスト化合物
・アトロピン(Sigma)
●FLIPR ® Calcium 6 Assay Kit(モレキュラーデバイス、カタログ番号R8190)
●1 M HEPES (Thermo)
●ReadiUse ™ 水溶性プロベネシド(AAT Bioquest)
●SpectraMax i3x マルチモードマイクロプレートリーダー
・SpectraMax インジェクターモジュール
●FlexStation® 3 マルチモードマイクロプレートリーダー
方法
細胞調製
CHO M1WT3細胞を96ウェル黒壁透明底プレートに50,000 個/ウェル、100μLずつ播種しました。37℃、5% CO2で一晩培養しました。
1321N1細胞を「アッセイレディ」試薬として使用しました。手短に言えば、1バイアル分の凍結細胞(1mL当たり1,000万個)を37℃の水浴中で急速解凍し、10mLのDMEM培地に再懸濁しました。細胞を1,000RPMで5分間遠心し、培地を捨て、新鮮なDMEMに1mL当たり30万個懸濁しました。次に、黒壁透明底96ウェルプレートに、1ウェル当たり100μLで30,000個の細胞を播種しました。37℃、5% CO2で一晩培養しました。
両細胞株とも、カルシウムアッセイは細胞をマイクロプレートに播種した翌日に行いました。
試薬の調製
29.4 mLの1X HBSSに0.6 mLの1M HEPESを加え、30 mLのアッセイバッファーを調製しました。このアッセイバッファーは他のアッセイ試薬の調製に使用しました。25mMプロベネシドストック溶液は、1バイアル分のプロベネシドを10mLのアッセイバッファーに溶解して作製しました。25mMプロベネシド1mLとアッセイバッファー10mLからなる溶液を、色素ローディングバッファー(カルシウム6アッセイキットに付属)1バイアルを再構成するために使用し、バイアルを30秒間ボルテックスして混合しました。
色素負荷
細胞を封じ込めたマイクロプレートの各ウェルに、100 µL の Dye Loading Buffer を添加しました。その後、プレートを37℃、5% CO2で2時間インキュベートしました。アッセイ前に細胞は洗浄しなかったです。
化合物の調製
アゴニストアッセイのために、カルバコール(CHO M1WT3細胞)またはアセチルコリン(1321N1細胞)の5倍ワーキングストックをアッセイバッファーで調製しました。作業ストックの1:3希釈系列を4mLポリプロピレンチューブに入れました。各化合物について、8つの濃度からなる完全な濃度反応曲線を作成しました。
拮抗薬のアトロピンは1:3希釈系列として調製しました。ワーキングストックを適切な最終濃度になるようにアッセイプレートのウェルに加え、プレートを30分間平衡化しました。その後、インジェクターを用いてEC80濃度のアゴニストをウェルに供給しました。
細胞ベースアッセイのセットアップ
SpectraMax i3xプレートリーダーを用い、SpectraMaxインジェクターモジュールでアゴニスト濃度反応曲線を1化合物濃度ずつ測定しました。各曲線について、キャリーオーバーを最小にするため、低濃度から高濃度へとアッセイを実行しました。インジェクター1を化合物でプライミングし、色素をロードしたセルプレートを機器にセットし、3反復のアッセイを実行しました。各ウェルにつき、5X 化合物ワーキングストック 50 µL を、ウェル内の 200 µL の細胞、培地、Dye Loading Buffer に注入し、最終的な化合物濃度を 1X としました。
その後、インジェクターを逆回転させてラインから化合物を除去し、次の高濃度の化合物でプライムしました。新しいプレートセクションが作成され、アッセイは次の複製ウェルセットで実行しました。このプロセスを各濃度の化合物について、濃度反応曲線が完成するまで繰り返し、各レプリケートセットごとに新しいプレートセクションを作成しました。
SoftMax ProソフトウェアのAcquisition Planを使用して、装置とインジェクターの設定を定義しました(図1)。
アンタゴニスト試験は、ダイローデッドセルを含むアッセイプレートのウェルにアンタゴニスト希釈系列を手動でプレーティングし、30分間平衡化した後、SpectraMax i3xプレートリーダーでカイネティックアッセイを実行し、すべてのアッセイウェルに単一のEC80濃度のアゴニストを注入することにより行いました。
対照として、同じ色素負荷細胞プレートの追加ウェル をFlexStation 3 マルチモードマイクロプレートリーダーでアッセイした。FlexStation 3 マルチモードマイクロプレートリーダーは、統合型マルチチャンネルピペッターを用いて化合物 をウェルに供給します。FlexStation 3プレートリーダーの装置設定を表1に示します。
| Parameter | Setting |
|---|---|
| Read type | Flex |
| Read mode |
Fluorescence Bottom read |
| Wavelengths |
Ex 485 nm Em 525 nm Cutoff 515 nm |
| Sensitivity |
Readings: 3 PMT: Medium/p> |
| Timing |
Run time: 90 sec Interval: 2.1 sec |
| Compound transfer |
Initial volume: 150 µL Transfers: 1 Pipette height: 150 µL Volume: 50 µL Rate: 2 Time Point: 19 sec |
| Triturate |
Not used |
表1. カルシウム測定におけるFlexStation 3プレートリーダーの設定
結果
SpectraMax i3x プレートリーダーでは、インジェクターモジュールを使用して各化合物希釈液を別々のプレート読み取りステップで送出することにより、一貫したアゴニスト濃度反応曲線が得られました。キャリーオーバーの問題を回避するため、化合物は低濃度から高濃度へと注入されました。アンタゴニストアッセイは、細胞とアンタゴニ スト化合物を封じ込めたウェルに、EC80濃度のアゴニストを1回だけ注入するものであり、1回のプレート読み取りで行われました。
アゴニストであるカルバコールは、SpectraMax i3xプレートリーダーでは32.8 nM、FlexStation 3プレートリーダーでは21.7 nMのEC50値で、CHO M1WT3細胞に発現するM1ムスカリン受容体を活性化しました(図2)。アトロピンはこの活性化に拮抗し、IC50値はそれぞれ0.54 nMと1.4 nMでした(図3)。1321N1細胞に発現するムスカリン性アセチルコリン受容体(mAChR)は、アセチルコリンによってEC50値0.50μMおよび0.24μMで活性化され(図4)、アトロピンによってIC50値0.24nMおよび0.62nMで拮抗されました(図5)。表2は、両細胞株で得られた濃度応答値をまとめたものです。
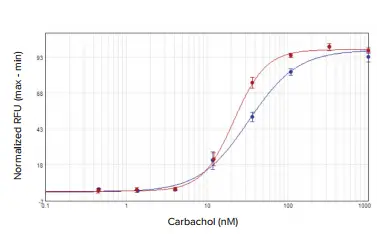
図2. CHO M1WT3アゴニスト濃度反応曲線。細胞をカルバコールで処理し、インジェクターモジュール付き SpectraMax i3x プレートリーダー(青)または FlexStation 3 プレートリーダー(赤)でカルシウム反応を測定しました
| SpectraMax i3xプレートリーダー | FlexStation 3プレートリーダー | ||
|---|---|---|---|
| アゴニストEC50 | CHO M1WT3 カルバコール | 32.8 nM | 21.7 nM |
| 1321N1 アセチルコリン | 0.54 nM | 1.4 nM | |
|
アンタゴニスト IC50 |
CHO M1WT3 アトロピン | 0.50 nM | 0.24 nM |
|
1321N1 アトロピン |
0.24 nM | 0.62 nM |
表2. インジェクターモジュール付きSpectraMax i3xプレートリーダーおよびFlexStation 3プレートリーダーで得られたEC50およびIC50値の要約
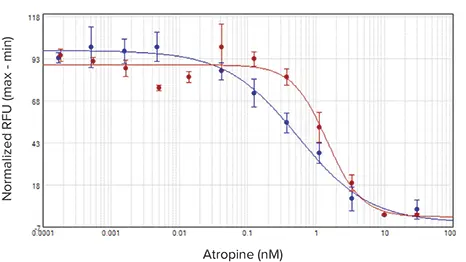
図3. CHO M1WT3アンタゴニストIC50曲線。細胞はアンタゴニストであるアトロピンの濃度を増やしながら処理し、EC80濃度のアゴニストであるカルバコール添加に対する反応をアッセイしました。インジェクターモジュール付きSpectraMax i3xプレートリーダー(青)とFlexStation 3プレートリーダー(赤)の結果を示します。
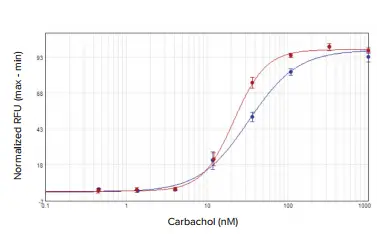
図4. 1321N1アゴニスト濃度反応曲線。細胞をアセチルコリンで処理し、SpectraMax i3x プレートリーダー(インジェクターモジュール付き)(青)またはFlexStation 3 プレートリーダー(赤)でカルシウム反応を測定しました
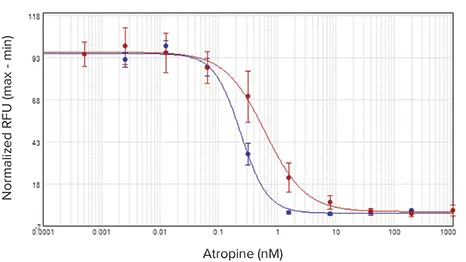
図5. 1321N1アンタゴニストIC50曲線。アンタゴニストであるアトロピンの濃度を増加させながら細胞を処理し、EC80濃度のアゴニストであるアセチルコリンの添加に対する反応をアッセイしました。インジェクターモジュール付きSpectraMax i3xプレートリーダー(青)とFlexStation 3プレートリーダー(赤)の結果を示します。
結論
SpectraMax インジェクターモジュールを用いると、EC50値と IC50値が、ハイスループット・スクリーニング・システムで既に発表された値とほぼ一致する濃度応答曲線が得られました。SoftMax ProソフトウェアのAcquisition Viewを使用することで、化合物の送達パラメーターとリアルタイムの細胞モニタリングが簡単に設定できました。インジェクターベースのシステムによる結果は、ピペッター搭載のFlexStation 3プレートリーダーやFLIPR Tetra® システムで取得されたデータとほぼ一致しました。
SpectraMax i3x マルチモードマイクロプレートリーダーの詳細はこちら >>
PDF版(英語)