Application Note 3Dスフェロイドモデルを用いた
T細胞浸潤アッセイのモニタリング
- ハイコンテントイメージングシステムで、4D(3D+タイムラプス)データセットを簡単に取得
- 3Dスフェロイドモデルのライブ表現型変化をリアルタイムでモニタリング
- 機械学習アプローチを活用し、スフェロイドを高精度に分類
- 時間経過に伴う表現型の主要な特徴を解析
PDF版(英語)
Zhisong Tong | リサーチサイエンティスト | モレキュラーデバイス
はじめに
T細胞療法は、私たちの免疫系ががん細胞を排除するのを助けるよう設計された治療法です。これには、CAR-T細胞(キメラ抗原受容体を導入したT細胞)、腫瘍浸潤リンパ球(TIL)、その他の遺伝子改変T細胞が含まれます。近年、細胞治療の分野は急速に拡大しており、2017年には血液がんに対する初のCAR-T細胞療法が承認され、この分野における重要なマイルストーンとなりました *1。しかしながら、T細胞のがん細胞に対する応答を特異的に高める新規免疫療法の開発は、依然として困難な課題です。その主な要因として、免疫療法の開発過程全体を通じて評価可能な堅牢なin vitroモデルの不足が挙げられます。
これまでのモデルは、浮遊細胞や2D単層細胞の使用に限られていました *2。固形腫瘍に対するCAR-T細胞の応用は、腫瘍の不均一性、免疫抑制性の微小環境、CAR-T細胞が認識可能な特異的腫瘍抗原の欠如などの課題により、進展が遅れていました。そのため、腫瘍を効果的に標的化・殺傷できるCAR-T細胞(例:CRISPRを用いたスクリーニング)の探索は、現在も活発に研究が進められている分野です *3。
現在、CAR-T細胞による細胞傷害性を評価する手法としては、フローサイトメトリーやイメージングベースの技術が用いられています *4。さらに、T細胞と腫瘍オルガノイド(tumoroid)の相互作用をin vitroで評価する研究も複数報告されています。本稿では、CAR-Tアッセイの概念実証モデルとして、T細胞と共培養した3D腫瘍スフェロイドの作製ワークフローを紹介します。活性化した末梢血単核球(PBMC)をスフェロイドに添加し、ハイコンテントイメージングを用いて経時的にその活性をモニタリングしました。ワークフローの最適化に向けて、関心のある生物学的オブジェクトを正確にセグメント化するためのディープラーニングベースの画像解析手法を開発し、明視野画像のみを用いてT細胞によるスフェロイドの表現型変化を定量化するために機械学習を活用しました。
本研究の結果、AIベースの解析ワークフローを用いることで、T細胞の有効性を予測可能であることが示されました。まず、スフェロイド全体およびそのエッジを認識し、マスクを生成するための堅牢なディープラーニングモデルを構築しました。マスクから抽出された測定値を用いて機械学習によるスフェロイドの分類を行い、コントロール群と比較して明確な表現型変化が観察され、T細胞の効果を解析することができました。さらに、分類に寄与する特徴を明らかにするため、面積、形状係数、総輝度、グレーレベルの不均一性などの特徴量を定量化し、各処理群間で比較しました。
方法
実験概要
本研究では、未処理スフェロイド(コントロール)、非刺激PBMCと共培養したスフェロイド、刺激PBMCと共培養したスフェロイドの発達を比較しました。細胞死誘導剤として知られるスタウロスポリンで処理したスフェロイドも、コントロールとして含めました(図1A、1B)。T細胞とスフェロイドの相互作用は、72時間の培養期間中、2時間ごとにタイムラプスハイコンテントイメージングで記録しました。
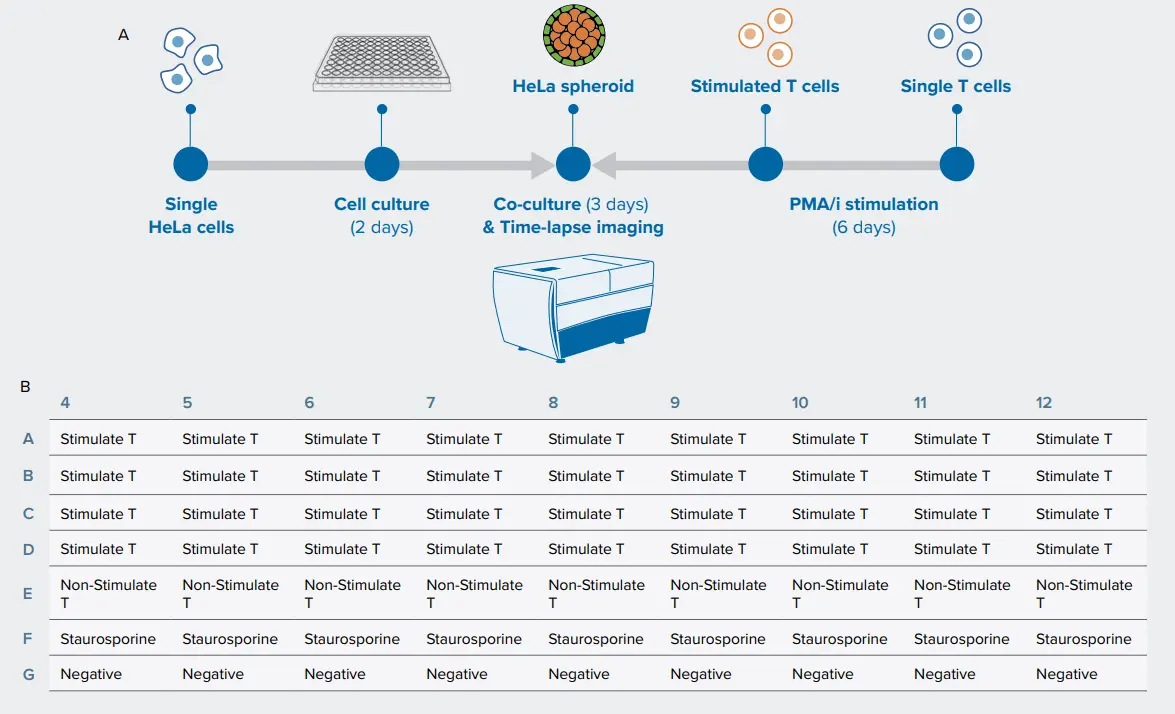
図1. (A) ワークフロー:HeLa細胞を96ウェルの丸底プレートに播種し、2日間培養してスフェロイドを形成しました。2日後、解凍したPBMC/T細胞をPMA/iで6時間刺激した後、スフェロイドに添加して共培養を開始しました。その後、スフェロイドおよびT細胞を対象に、2時間ごとにタイムラプスライブイメージングを実施しました。(B) アッセイのプレートマップ
細胞培養
3Dスフェロイド: HeLa細胞株を継代し、Corning社製の96ウェル丸底超低接着プレートに1ウェルあたり2,000細胞の密度で播種し、37℃で2日間培養して3Dスフェロイドを形成しました。
T細胞: 凍結保存されたPBMC(ALLCELLS社)からT細胞を解凍し、\( \frac{25\,\mathrm{ng}}{\mathrm{mL}} \)のPMAおよび\( \frac{1\,\mathrm{µg}}{\mathrm{mL}} \)のイオノマイシンで6時間刺激しました *5。その後、CellTracker Green(Thermo Fisher Scientific)で標識し、HeLa細胞数に対して10:1の比率で96ウェルスフェロイドプレートに播種しました。
スフェロイドのイメージング
ImageXpress® Micro Confocal ハイコンテントイメージングシステムとMetaXpress®ソフトウェアを用いて、透過光(TL)チャネルおよび蛍光チャネルで画像を取得しました。10X対物レンズおよび10 µmのフォーカスステップで3Dスタックおよび2D投影画像を取得し、37℃・5% CO₂環境下で2時間ごとにタイムラプスイメージングを実施しました。MetaXpressソフトウェア(バージョン6.7.2)では、タイムラプス(4D)モードで取得した3DスタックをIN Carta® 画像解析ソフトウェアと互換性のある形式で直接保存できます。
画像解析
SINAP(ディープラーニングベースのセグメンテーションモジュール)を用いて、すべてのタイムポイントおよび処理条件に対応可能なスフェロイドの正確なセグメンテーションモデルをカスタムで学習させました。50枚以上のアノテーション済み画像を用いて、既存のオルガノイドベースモデルをFine-tuneモードで100エポック学習させました。類似モデルが存在しない場合は、デフォルトモデルをベースにして、より多くのトレーニングデータを追加することで再学習が可能です。マスクはTLチャネルの2D投影画像に基づいて生成され、ラベルフリー解析を実現しています。
データ解析
各スフェロイドから抽出された測定値をもとに、Phenoglyphs(機械学習ベースの分類ツール)でモデルを構築し、スフェロイドを5つのクラスに分類しました。処理条件ごとの主要な特徴量の傾向は、Pythonのmatplotlibを用いてプロットしました。
結果
T細胞によるHeLaスフェロイドの表現型変化
T細胞のin vitro評価における課題に対処するため、ハイコンテントイメージングと解析を用いて、T細胞と腫瘍細胞の相互作用を3Dアッセイ形式で解析する画像解析手法を開発しました(図1)。HeLa細胞を用いてスフェロイドを形成し、48時間後に活性化PBMCを添加、以降3日間にわたり2時間ごとにイメージングを行いました(図3C〜3K)。
3日間の共培養後、透過光画像においてスフェロイドにさまざまな表現型変化が観察されました(図2)。スタウロスポリン処理群を除くすべての処理群で、スフェロイドのサイズ(面積)および光学的密度(暗さ)の増加が確認されました。また、非刺激PBMCと比較して、刺激PBMCがスフェロイド内部により多く浸潤している様子が観察され(図3C〜3J)、スフェロイドのエッジの崩壊も確認されました(図2Cおよび図5)。
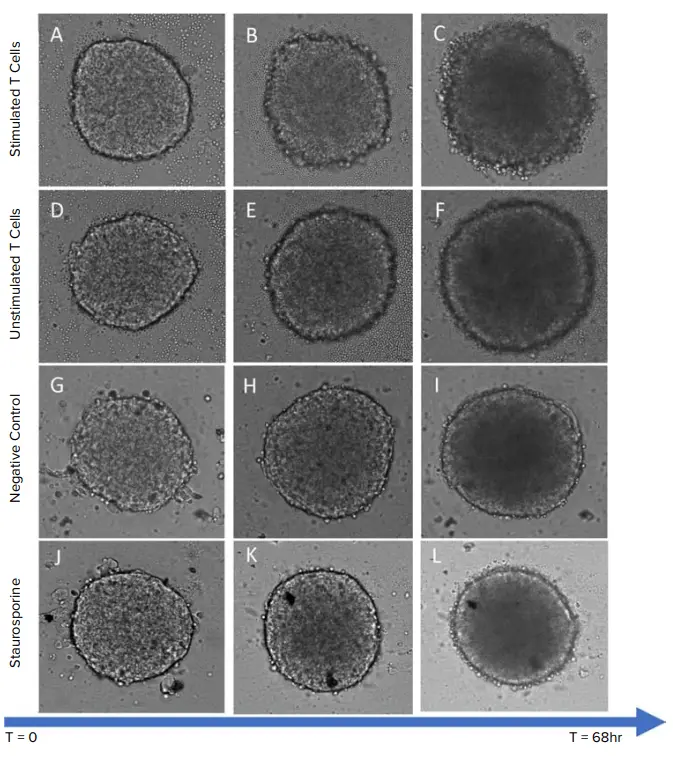
図2. TL画像によるHeLaスフェロイドの比較 刺激T細胞で処理したスフェロイド:(A) 初期段階、(B) 中期段階、(C) 後期段階、非刺激T細胞で処理したスフェロイド:(D) 初期段階、(E) 中期段階、(F) 後期段階、T細胞無処理のスフェロイド:(G) 初期段階、(H) 中期段階、(I) 後期段階、スタウロスポリン処理スフェロイド:(J) 初期段階、(K) 中期段階、(L) 後期段階
機械学習によるスフェロイド分類
T細胞アッセイのワークフローを改善するため、明視野画像のみを用いてスフェロイドの表現型変化を評価するカスタム解析パイプラインを開発しました。このアプローチにより、細胞を事前に染色する必要がなくなり、時間と試薬コストの削減が可能になります。TLチャネルの2D投影画像(Best Focus Plane)を用いて、スフェロイド領域をマスク化するためのSINAPモデルを学習・生成しました。刺激T細胞、非刺激T細胞、T細胞無処理の各群および異なるタイムポイント間でのばらつき(図2)を考慮し、すべての条件から画像をアノテーションしてバランスの取れたトレーニングセットを作成しました。また、未処理スフェロイドは処理群と比較して境界が滑らかであることが観察されたため(図3A〜3C)、スフェロイド本体とエッジのセグメンテーションマスクを別々に作成しました。得られたマスクから抽出した測定値は、Phenoglyphs(図4D)に入力され、スフェロイド分類モデルの構築に使用されました。他のAIベースの解析と同様に、Phenoglyphsにおける解析パイプラインは以下のように構成されています。
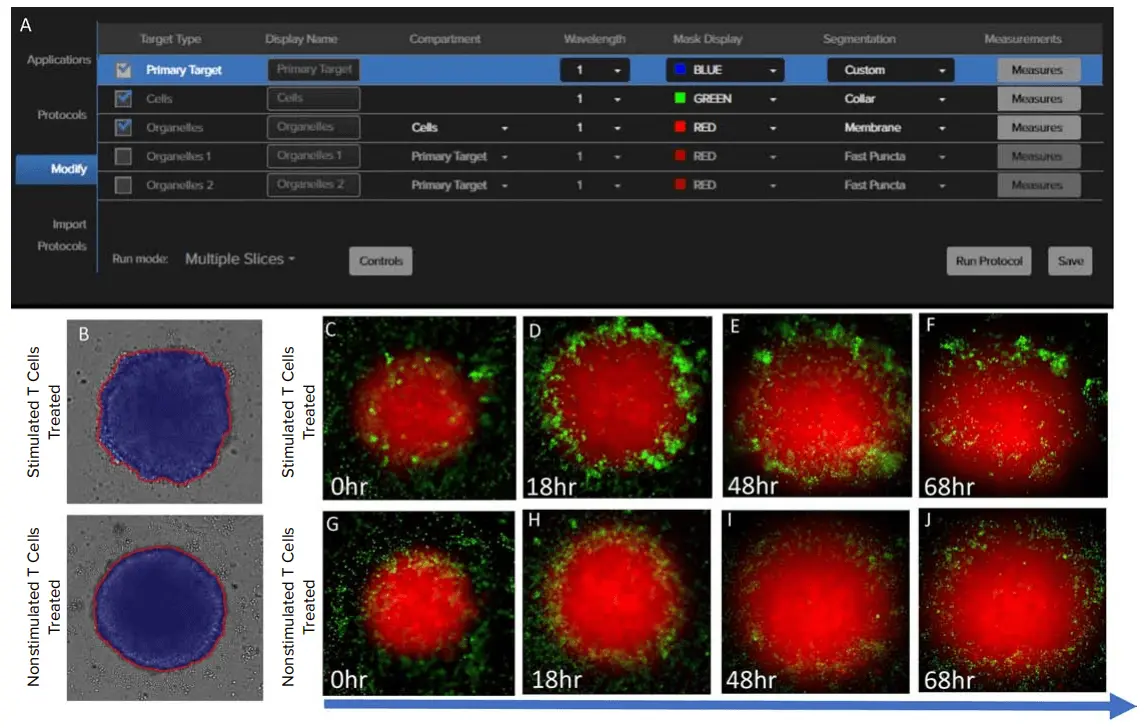
図3. (A) IN Cartaソフトウェアにおいて、スフェロイドおよびそのエッジのマスクを生成するために使用された「Primary Target」「Cells」「Organelles」モデル。(B) 刺激T細胞および非刺激T細胞で処理したスフェロイド(後期段階)のマスク画像。スフェロイド本体(青)とエッジ(赤)を示しています。(C–F) 刺激T細胞で処理したスフェロイドの蛍光画像(ミトトラッカー:赤、T細胞:セル・トラッカー緑)をブレンド表示。各時間点:0時間(C)、18時間(D)、48時間(E)、68時間(F)。(G–J) 非刺激T細胞で処理したスフェロイドの蛍光画像(同上)。各時間点:0時間(G)、18時間(H)、48時間(I)、68時間(J)。/p>
ステップ1:クラスタリングツールを用いた測定値のラベリングとトレーニングセットの作成
Phenoglyphsでは、まずクラスタリングツールを用いて適切なクラスにラベルを付け、分類モデルの学習に使用するトレーニングセットを作成します。このクラスタリングは、選択された測定項目に基づいて行われます(この測定項目は、次の分類モデル学習ステップで使用するものと同一である必要はありません)。図2に示すように、スフェロイドは時間の経過とともに暗くなり、透明度が低下する傾向があるため、輝度に関連する特徴量がクラスタリングにおいて重要な役割を果たすと考えられました。そこで、すべての特徴量を用いたクラスタリングと、輝度関連の特徴量に限定したクラスタリングを比較した結果、後者の方が処理条件間の分離性が高く、特に**刺激T細胞による後期処理群(図4A:ピンクおよびシアンラベル)および非刺激T細胞による後期処理群(図4B)**において顕著でした。その後、以下の5つのカテゴリに分類してトレーニングセットを作成し、必要に応じて画像の再割り当ても行いました:初期段階、中期段階、刺激T細胞による後期段階、非刺激T細胞による後期段階、T細胞無処理の後期段階。
ステップ2:上位20項目の選定と分類モデルの学習
クラスタリング後、ラベリングされたデータに対してランキングツールを用いて、すべての測定項目を重要度スコアでソートしました。過学習を防ぐため、95%の相関閾値を設定し、上位20項目を選定して分類モデルの学習に使用しました(このステップで使用する測定項目は、クラスタリング時とは異なります)。学習済みモデルは全データセットに適用され、新たな代表画像(exemplars)が表示されます。ここで、画像を別のクラスに再割り当てしたり、外れ値を除外することが可能です。再割り当てを行うと、画像に関連付けられた測定値も同様に再分類されます。この再割り当てと再学習のプロセスは、満足のいく結果が得られるまで複数回繰り返すことがあります(図4C)。
ステップ3:分類された画像の検証
最終的な目標は、スフェロイドを正確に処理条件ごとに分類することです。学習済みモデルを用いて、最終タイムポイントにおけるすべてのスフェロイドを分類したところ、65ウェル中63ウェルを正確に予測し、約97%の精度を達成しました(図4E)。この結果は、T細胞の浸潤に起因するスフェロイドの進展を、AIベースのラベルフリー解析で高精度に予測可能であることを示しています。
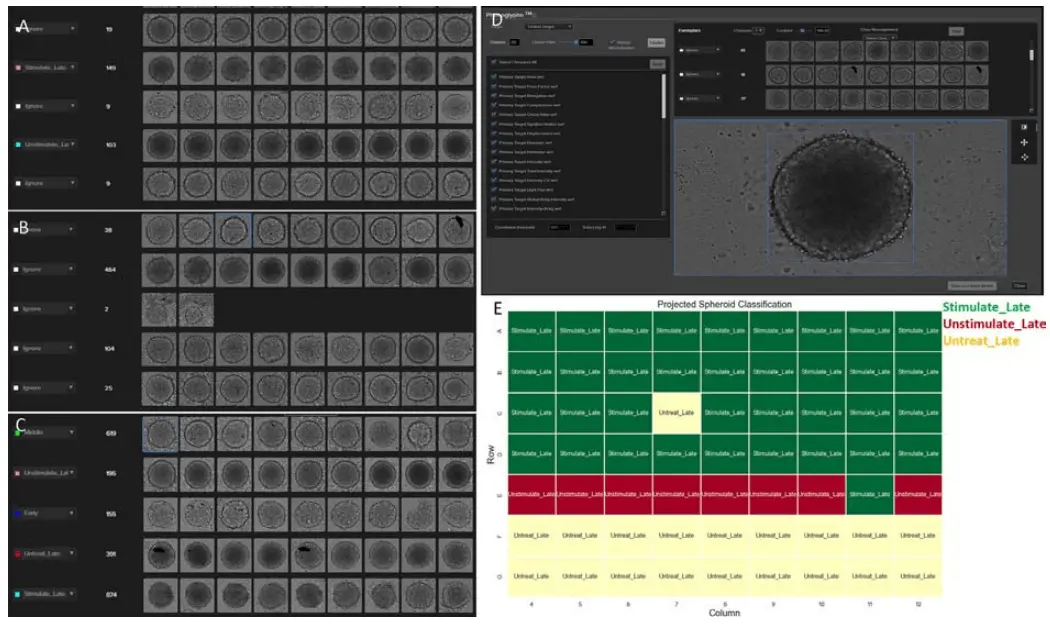
図4. (A) 輝度関連の特徴量に基づいて生成されたクラスタリング(50クラスのうち一部を表示)。(B) すべての特徴量に基づいて生成されたクラスタリング(50クラスのうち一部を表示)。(C) 学習済みPhenoglyphsモデルによって生成された最終分類結果。(D) IN Carta Phenoglyphs分類ツールのスクリーンショット。(E) Phenoglyphsモデルによるスフェロイド分類の予測結果
表現型関連特徴量の測定
本研究では、単一の測定値に依存せず、多変量の特徴量に基づく機械学習分類器を構築しました。これは、アッセイ環境が複雑であり、特定の測定値だけでは分類が困難であるためです。たとえば、輝度の測定値は、ある条件下では閾値を適切に設定することで画像を区別できるかもしれませんが、光量の設定が変わるとその有効性が失われる可能性があります。そのため、機械学習ベースの多変量分類アプローチは、表現型解析における汎用的な手法といえます。一方で、単一の測定値の傾向も、生物学的現象の理解や将来のクラスタリング項目の選定に役立つ可能性があります。そこで、スフェロイドの表現型に対する処理の影響を時間経過とともに評価するため、上位20項目の中から以下の4つの主要な特徴量をプロットしました(図5):面積(Area)、形状係数(Form Factor)、総輝度(Total Intensity)、グレーレベル非均一性(Grey Level Non-Uniformity, GLNN)。ここでは、刺激T細胞群(青線)の曲線が他の群と乖離するタイミングに注目しました。具体的には:形状係数では約22時間後から乖離が始まり、総輝度では約50時間後、GLNNでは約38時間後に乖離が見られました。面積は、刺激・非刺激群間での差が最も小さい特徴量でした。これらの傾向は、T細胞の浸潤が18時間頃から始まったという観察結果(図3C–3J)と一致しています。
スフェロイド面積の変化。刺激・非刺激T細胞で処理したスフェロイドの面積は、最初の40時間ではネガティブコントロールとほぼ同等でした。しかしその後、T細胞処理群のスフェロイド面積はコントロール群よりも有意に大きくなりました(図5A)。これは、T細胞の存在がスフェロイド構造の一体性に影響を与えた可能性を示唆しています。これまでの観察では、スフェロイドの面積が大きくなることは、3D構造の崩壊と関連しており、ウェル内で細胞が緩く集まった状態になることがありました。一方、スタウロスポリン処理群では、時間経過によるサイズ変化はほとんど見られず、スフェロイドの成長が抑制されていることが示唆されます。
形状係数(Form Factor)。形状係数は、オブジェクトの円形度を示す指標で、0〜1の範囲を取り、1に近いほど円形に近いことを意味します。図5Bでは、刺激T細胞群がネガティブコントロール群およびスタウロスポリン群と比較して、有意な形状変化を示しており、Studentのt検定によりp値はそれぞれ0.001でした。この傾向は、刺激T細胞処理スフェロイドのエッジが他群と比べて不規則で、膨らみ構造を形成しているという観察結果(図3B)と一致しています。
総輝度(Total Intensity)。総輝度は、オブジェクト内のすべてのピクセル値の合計であり、一般的にオブジェクトが大きいほど値も大きくなります。図5Cの結果は、図5Aの面積の傾向と一致しており、この理論を支持しています。また、すべての測定は**透過光チャネル(TL)**で行われており、より密で不透明な構造は光を遮るため、ピクセル値が小さくなります。これは、スフェロイドが培養時間の経過とともに不透明になるという観察結果とも一致しており、細胞密度の増加が原因と考えられます。
グレーレベル非均一性(GLNN)。GLNNはテクスチャ解析の一種で、オブジェクト内のグレーレベルの類似性を評価します。値が小さいほど、輝度の均一性が高いことを意味します。図5Dでは、T細胞処理群のスフェロイドは最も均一性が低く、スタウロスポリン処理群は最も均一性が高い傾向を示しました。
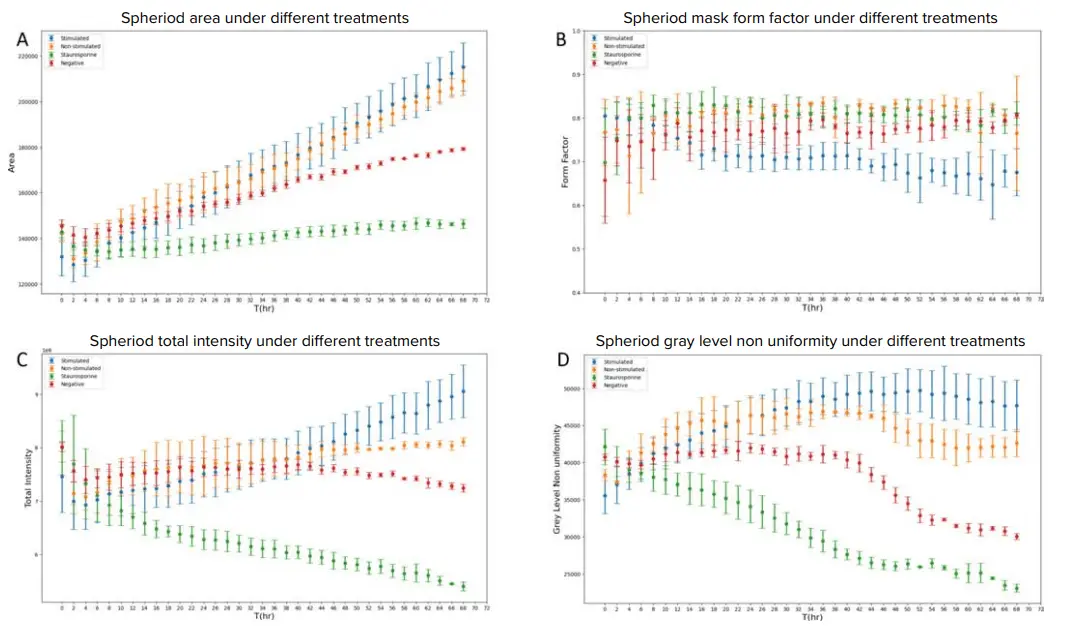
図5. (A) 各処理条件におけるスフェロイド面積の推移、(B) スフェロイドの形状係数の推移、(C) スフェロイドの総輝度の推移、(D) スフェロイドのグレーレベル非均一性の推移
結論
- タイムラプスハイコンテントイメージングを用いて、T細胞処理された3Dスフェロイドの成長および表現型変化をモニタリングしました。
- SINAPモデルを用いて、スフェロイド全体およびそのエッジに対するマスクを生成することに成功しました。
- Phenoglyphsにてスフェロイドを5つのクラスに分類するモデルを学習させました。
- 時間経過に伴う4つの主要な特徴量の傾向は、今後の類似実験における有用な指標となることが示されました。
PDF版(英語)