Application Note 単一プラットフォーム上での
心筋細胞に対する多変量アッセイ
- マイクロプレートリーダーアッセイとイメージングサイトメトリーの組み合わせにより、生物学的関連性の高いデータを取得
- ユーザーによるアプリケーションカートリッジの装着で、将来のアプリケーションニーズに対応可能
- 直感的なSoftMax Proソフトウェアにより、イメージングの専門知識は不要
PDF版(英語)
はじめに
Cathy Olsen, PhD | シニアアプリケーションサイエンティスト | モレキュラーデバイス
Jayne Hesley | アプリケーションサイエンティスト | モレキュラーデバイス
Oksana Sirenko, PhD | リサーチサイエンティスト | モレキュラーデバイス
幹細胞由来のヒト心筋細胞は、表現型特性および電気生理学的プロファイルにおいて、ヒトの心筋細胞に類似しています。培養下の心筋細胞は拍動性のシンシチウムを形成し、ネイティブな心筋細胞と同様の挙動を示します。細胞の同期的な収縮に伴う細胞内カルシウム濃度のオシレーションは、カルシウム感受性色素を用いてモニタリング可能であり、処理によるオシレーションパターンの変化は、時間経過に伴う蛍光シグナルの変化として観察できます。
心筋細胞の収縮に関連する細胞内カルシウムフラックスの変化は、FLIPR® TetraシステムやSpectraMax® Paradigm® マルチモードマイクロプレートリーダーでモニタリング可能であることが示されています。現在では、SpectraMax® i3/i3x マルチモードマイクロプレートリーダーにSpectraMax® MiniMax™ 300 イメージングサイトメーターを組み合わせることで、心筋細胞の拍動検出と細胞生存率の蛍光イメージングを1台の装置で実現できます。化合物による拍動率の変化は、細胞生存率と相関させることで、心毒性のより正確な評価が可能となります。
方法
心筋細胞に対する化合物の影響を評価するため、SpectraMax i3/i3xリーダーを用いてEarlyTox™ 心毒性キットによる心拍動アッセイを実施しました。iCell Cardiomyocytes(Cellular Dynamics International社製のヒトiPSC由来心筋細胞)は、384ウェルマイクロプレートで培養され、同期的に拍動する層が形成されました。細胞は**Screen-Well Cardiotoxicity Library(Enzo Life Sciences)**の化合物(10 µM)で24時間処理され、拍動および生存率への影響を評価しました。
心筋細胞の拍動パラメータは、SpectraMax i3/i3xリーダーのキネティック蛍光測定モードでウェルごとに取得され、SoftMax® Proソフトウェア内のPeak Proアルゴリズムで解析されました。ピーク数、ピーク頻度、ピーク振幅、ピーク幅、減衰時間など、16項目の解析パラメータが算出されました。本例では、25秒間の測定中に記録されたピーク数を用いて、化合物が心拍動に与える影響を定量化しました。
ピーク数の減少を引き起こした化合物の毒性に関する追加情報を得るため、拍動測定後にCalcein AM(緑色蛍光の生存率染色液)でライブ染色を行いました。細胞は、SpectraMax i3/i3xリーダーにフィールドアップグレード可能なMiniMaxサイトメーターでイメージングされました。SoftMax Proソフトウェアには、細胞数、細胞増殖、マーカー発現などの解析手法が搭載されており、化合物毒性による細胞生存率の変化は、細胞増殖解析プロトコールを用いて、各ウェル内のCalcein AM染色細胞が占める面積を測定することで評価しました。
心筋細胞の拍動と生存率イメージングの統合解析により、細胞に対する異なる影響を示す化合物を識別することができました。コントロールウェルの平均ピーク数は25秒間で12回であり、ピーク数が著しく減少したウェルはソフトウェアによって容易に識別されました。
一部の化合物は一般的な細胞毒性を示し、ピーク数の大幅な減少と生存細胞面積の縮小を引き起こしました。一方で、他の化合物は細胞生存率に影響を与えることなく心筋細胞の拍動に悪影響を及ぼし、低いピーク数と高い生存細胞面積が同時に観察されました。
プレートビューは、化合物が拍動パターンおよび細胞生存率に与える影響の相関を視覚的に確認するための便利な手段です。図1では、心拍動(上段)および生存細胞面積(下段)のデータをプレートビューで示しています。図2では、心筋細胞に異なる影響を与えた化合物について、個別のキネティックトレースおよび代表的な画像を詳細に示しています。

図1. 心拍動および細胞生存率データのマルチウェルビュー 上段:SCREENWELL® Cardiotoxicity Libraryの化合物で処理した心筋細胞の代表的なキネティックトレース。下段:同一アッセイプレートにおける細胞生存率イメージング結果のヒートマップ。生存細胞がウェル内を覆う割合(%)として表示され、青色のウェルは低い生存率、赤色のウェルは高い生存率を示します。DMSO処理のコントロールウェル(重複)は緑色で囲まれています。ピーク数の減少はあるが生存率の低下が見られないジゴキシン処理ウェルは黄色で、ピーク数と生存率の両方が著しく低下したスタウロスポリン処理ウェルは青色で囲まれています。
ジゴキシンなど、ピーク数を著しく減少させる一部の化合物は、細胞生存率にはほとんど影響を与えないことが示されました。例えば、不整脈治療に広く使用されるジゴキシンは、25秒間の測定で約12回の拍動を1〜2回にまで減少させましたが、生存細胞面積はDMSO処理コントロールの82%に対して71%と、大きな差はありませんでした。ドーパミン逆作動薬ハロペリドールも、拍動プロファイルに明確な影響を与えましたが、生存率には影響を与えませんでした。一方、スタウロスポリンのような化合物は、細胞生存率とピーク数の両方を大きく低下させました(図2参照)。

図2. ピークデータと細胞生存率の比較 DMSO(コントロール)、ジゴキシン、ハロペリドール、スタウロスポリンで処理した細胞のキネティックトレースと細胞画像の詳細ビュー。ジゴキシンおよびハロペリドールは、拍動細胞のピーク数を減少させましたが、生存率には有意な影響を与えませんでした。スタウロスポリンは、拍動と生存率の両方に悪影響を与えました。
化合物ライブラリスクリーニングの結果に基づき、拍動率および細胞毒性に影響を与えた化合物を選定し、詳細な検討を行いました。代表的な化合物を心筋細胞に1:3の希釈系列で添加し、IC₅₀値を算出しました。 心筋細胞の収縮は、従来通りEarlyTox 心毒性染色液を用いて可視化し、SpectraMax i3/i3xリーダーで拍動プロファイルを測定しました。
データはSoftMax Proソフトウェア内のPeak Proアルゴリズムで解析されました(図3左)。拍動測定後、同じ細胞をCalcein AMで染色し、MiniMaxサイトメーターでイメージングして細胞生存率を評価しました。濃度反応曲線は、化合物濃度に対する生存細胞面積としてプロットされました(図3右)。
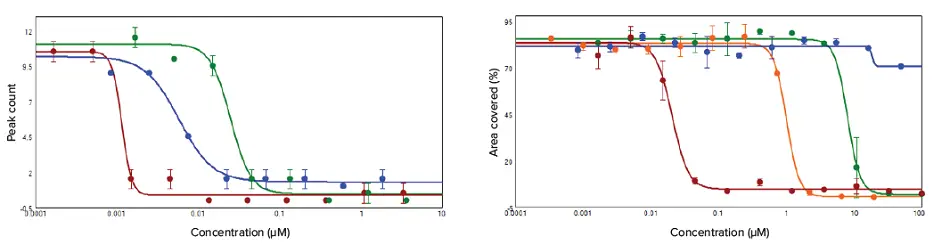
図3. ピーク数および細胞生存率の濃度反応曲線 左:バリノマイシン(赤)、ジゴキシン(青)、**アミオダロン(緑)**で処理した細胞のピーク数に基づく濃度反応曲線。右:バリノマイシン(赤)、ジゴキシン(青)、アミオダロン(緑)、**スタウロスポリン(オレンジ)**で処理した細胞の生存率に基づく濃度反応曲線。
結論
SpectraMax i3/i3xプレートリーダーとSpectraMax MiniMaxサイトメーターの組み合わせにより、心筋細胞の拍動検出と細胞生存率の蛍光イメージングを1台の装置で実現でき、SoftMax Proソフトウェアによる統合データ解析が可能です。化合物による拍動率の変化や異常リズムは、細胞生存率と相関させることで、より正確な心毒性評価が可能となります。複数の代表的化合物に対して、SpectraMax i3/i3xプレートリーダーでの心筋細胞拍動に対する濃度依存的な影響が実証されました。
MiniMaxサイトメーターは、心筋細胞の拍動をモニタリングした同一ウェル内で細胞毒性のイメージングに使用されました。カルシウムフラックスや細胞生存率といった機能的な出力を同一ウェルで測定することで、化合物が心筋細胞機能および全体的な細胞毒性に与える影響に関する補完的な情報が得られます。
SpectraMax i3/i3xプレートリーダーとMiniMaxサイトメーターは、イメージングの利点とマルチモードプレートリーダーアッセイの柔軟性をシームレスに統合します。SoftMax Proソフトウェアは、データ取得から解析までのシンプルなワークフローを提供します。
PDF版(英語)