Application Note HTRFサイトカインアッセイの細胞生存率による正規化
- 高感度なHTRFテクノロジーでサイトカイン分泌を正確に評価
- MiniMaxサイトメーターを用いた非染色での細胞播種のモニタリング
- EarlyTox Cell Integrityアッセイによるアッセイ済み細胞の生存率を確認し、アッセイの品質を評価
PDF版(英語)
Fabienne Charrier-Savournin博士、Fanny Pleniere、Stephanie Douzon|シスビオ・バイオアッセイ社
Caroline Cardonnel博士、Laurence Monnet|フィールドアプリケーションサイエンティスト|モレキュラーデバイス
はじめに
炎症性サイトカインおよび抗炎症性サイトカインは、自己免疫疾患、炎症性疾患、感染症において中心的な役割を果たします。また、代謝疾患やがん領域、特に抗腫瘍免疫応答においても重要な因子です。Cisbio Bioassays社の均一系時間分解蛍光(HTRF)技術は、さまざまなサイトカインおよびケモカインの定量に対応する柔軟なプラットフォームを提供します。HTRFは、特に末梢血単核球(PBMC)などの生理学的モデルを用いた細胞ベースの実験において、サイトカインおよびケモカインの分泌をモニタリングするのに最適です。一般的に、サイトカイン分泌の調節には、分泌を誘導または抑制する薬理学的化合物が用いられます。これらの薬剤の作用機序をより深く理解するためには、特に細胞生存率への影響を含めた効果を慎重に解析することが重要です。
本アプリケーションノートでは、SpectraMax i3x® マルチモードプレートリーダーとSpectraMax® MiniMax® 300 イメージングサイトメーターを用いて、サイトカイン分泌と細胞生存率を同時に評価する方法を紹介します。このシステムにより、ウェル単位または細胞単位でHTRF測定および細胞生存率の評価が可能となり、細胞の形態をモニタリングすることでアッセイの品質も確認できます。
本稿では以下の内容について解説します:
(i) 処理したPBMCからのサイトカイン分泌の誘導方法
(ii) HTRFを用いたサイトカインの測定方法
(iii) モレキュラーデバイスのEarlyTox™ Cell Integrity Kitを用いたPBMCの生存率評価方法
(iv) サイトカイン濃度をPBMCの生存率に基づいて正規化する方法
材料と方法
凍結保存されたヒトPBMCを解凍し、96ウェルの黒色側壁・透明底マイクロプレートに、1ウェルあたり5万個および10万個の細胞を播種しました。培地には200 µLのRPMI + 10%胎牛血清(FCS)を使用しました。細胞処理前には、MiniMaxサイトメーターの透過光チャネルを用いてPBMCの播種状態を撮像によりモニタリングしました。
細胞処理
IL-6、IL-8、TNFα、IL-1βの分泌を調節するため、PBMCに対して、炎症性サイトカインの分泌を抑制することが知られているグルココルチコイドであるデキサメタゾンを濃度を変えて添加し、さらにサイトカイン分泌を誘導するためにLPS(\( \frac{0.2\,\mathrm{µg}}{\mathrm{mL}} \))を加え、16時間共処理しました。また、IL-2およびIFNγの分泌を調節するためには、デキサメタゾンを濃度を変えて添加し、さらにPMA(\( \frac{0.5\,\mathrm{ng}}{\mathrm{mL}} \))およびイオノマイシン(\( \frac{1\,\mathrm{µg}}{\mathrm{mL}} \))を加えて、同様に16時間共処理しました。
HTRFサイトカインアッセイ
HTRFサイトカインアッセイは、細胞培養後のサイトカイン分泌量を定量するために実施されました。一晩インキュベートした後、各ウェルから上清16 µLを384ウェルの低容量マイクロプレート(Greiner #784075)に移し、HTRF法に基づくサイトカインアッセイを行いました。サンプルは希釈せずにそのまま、または1:10もしくは1:20に希釈して測定し、各アッセイの線形範囲内で定量できるように調整しています。サイトカイン濃度は、RPMI培地に10% FCSを加えた条件で調製した標準液を用いた標準曲線から補間して算出しました。使用したHTRFサイトカインキットは、IFN-γ(62HIFNGPEG)、IL-2(62HIL02PEG)、IL-1β(62HIL1BPEG)、IL-6(62HIL06PEG)、IL-8(62HIL08PEG)、TNF-α(62HTNFAPEG)です。
アッセイの読み取りには、SpectraMax i3x プレートリーダーを使用し、SoftMax® Pro ソフトウェアにあらかじめ設定されたプロトコールに従って測定を行いました。
なお、HTRFサイトカインアッセイの結果を細胞生存率に正規化するためのワークフロー全体については、以下のURLよりご覧いただけます:moleculardevices.com/ htrf-workflow
EarlyTox Cell Integrityアッセイ
上清除去後の細胞に対して、EarlyTox™ Cell Integrity Kitを用いて細胞生存率を評価しました。EarlyTox Cell Integrity Kit(モレキュラーデバイス、製品番号:R8213)は、2種類のDNA結合性色素を使用します。細胞膜透過性のLive Red Dyeはすべての細胞の核を標識し、細胞膜非透過性のDead Green Dyeは死細胞のみを標識します。細胞の生存率は、Minimaxサイトメーターの2色蛍光イメージング機能(緑:励起460 nm/蛍光541 nm、赤:励起625 nm/蛍光713 nm)と、SoftMax Pro ソフトウェアの細胞解析機能を用いて評価しました。
データ解析
データはSoftMax Proソフトウェアを用いて作成・分析しました。
・HTRF比率の算出およびデータのリダクション処理は、Cisbio社のガイドラインに従い、あらかじめ設定されたプロトコールにより自動的に実施されました。(参考URL:http://www.cisbio.com/usa/drug-discovery/htrf-ratio-and-datareduction)
・グラフには平均値および標準偏差(SD)を表示しています。
・正規化手順 = \( \frac{\text{(}\frac{\mathrm{サイトカイン濃度pg}}{\mathrm{mL}}\text{)}}{\text{生存細胞数}} \)
結果
細胞処理前のPBMC播種の確認
細胞処理に先立ち、ヒトPBMCを透過光チャネルで撮像し、適切に播種されていることを確認しました。PBMCは直径が6 µm未満であるため、透過光画像では個々の細胞を識別するのが困難です。そこで、画像ごとの被覆面積の割合から細胞密度を算出する、ユーザー定義のカスタム解析を実装しました。この解析により、ウェルあたり5万個のPBMCでは19.7%の被覆面積、10万個では35.9%の被覆面積が得られ、比率は1.82となりました(データは未掲載)。これらの結果は、本カスタム解析が視野内の対象物を正確に識別し、ウェルごとの面積被覆率を正確に算出できることを示しています。
デキサメタゾン処理後のLPSまたはPMA/イオノマイシンによるサイトカイン放出の変調
予想通り、LPSはIL1β、IL6、IL8、TNFαの分泌を効率的に誘導しました(図1)。一方、\( \frac{5\,\mathrm{ng}}{\mathrm{mL}} \)のPMAと\( \frac{1\,\mathrm{µg}}{\mathrm{mL}} \)のイオノマイシンによる共刺激では、IL2およびIFNγの最大放出が誘導されました。
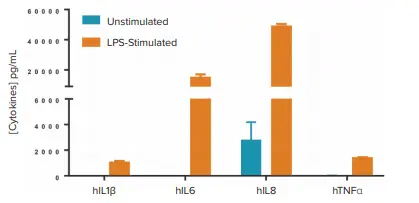
図1. SpectraMax i3x プレートリーダーを用いたHTRFアッセイによるLPS刺激後のサイトカイン分泌の測定
興味深いことに、\( \frac{2\,\mathrm{µg}}{\mathrm{mL}} \)のイオノマイシン存在下では、IL2およびIFNγの分泌が有意に減少しました(データ未掲載)。
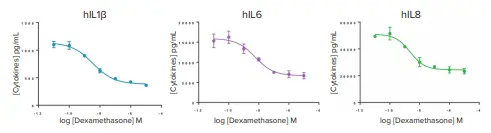
デキサメタゾン処理により、LPSまたはPMA/イオノマイシン刺激によって誘導されるサイトカイン放出が有意に抑制されました(図2)。
| IL1β | IL6 | IL8 | TNFα | IL2 | IFNγ | |
|---|---|---|---|---|---|---|
| S/B | 3.0 | 2.4 | 2.1 | 2.4 | 1.5 | 2.0 |
|
IC₅₀ dexa (M) |
3.491E-09 | 5.824E-09 | 2.304E-09 | 6.048E-09 | 1.456E-08 | 3.282E-08 |
図2. デキサメタゾンによるサイトカイン分泌への影響。TNFα、IL2、IFNγの用量反応曲線は未掲載
LPS、デキサメタゾン、PMA/イオノマイシン処理による細胞生存率への影響(EarlyTox Cell Integrity アッセイによる評価)
EarlyToxデータ解析では、赤色チャネルにおける細胞サイズおよび蛍光強度のしきい値に基づくセルカウントと、生存細胞および死細胞の識別に依拠しました。SoftMax Pro ソフトウェアの分類機能を用いて、核が赤色のみで標識された細胞を生存細胞、赤色および緑色の両方で標識された細胞を死細胞として分類しました。識別された対象物は、ソフトウェア上で生存細胞は赤色マスク、死細胞は青色マスクとして可視化されました(図3および図4)。
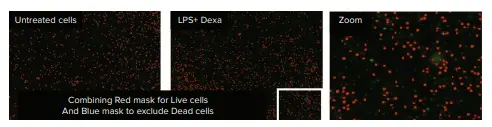
図3. LPS+デキサメタゾン処理を行ったPBMC。SoftMax Pro ソフトウェアの分類機能を使用した結果、細胞は生存細胞(赤色マスク)として認識され、死細胞(青色マスク)は検出されませんでした。
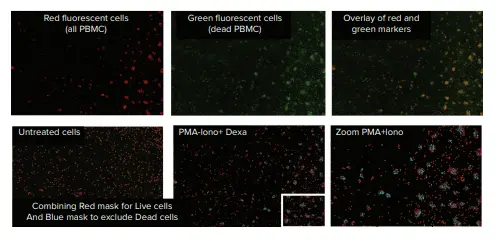
図4. PMA+イオノマイシン処理を行ったPBMC。SoftMax Pro ソフトウェアの分類機能を使用した結果、細胞はクラスター状に生存細胞(赤色マスク)または死細胞(青色マスク)として識別されました。
LPS+デキサメタゾン処理は、未処理細胞と比較して、細胞の生存率や形態に顕著な影響を与えませんでした(図3)。一方、PMAおよびイオノマイシンによる刺激処理では、細胞クラスターの形成が誘導され、死細胞の割合は10〜13%に達しました(図4および表1)。
| 50,000細胞数/ウェル | 100,000細胞数/ウェル | |||
|---|---|---|---|---|
| 生細胞数/ウェル | 死んだPBMC | 生細胞数/ウェル | 死んだPBMC | |
| コントロール | 12,133 | 0 | 29,658 | 0 |
| LPS | 15,210 | 0 | 30,600 | 0 |
| PMA(\( \frac{5\,\mathrm{ng}}{\mathrm{mL}} \))/ イオノマイシン(\( \frac{1\,\mathrm{µg}}{\mathrm{mL}} \)) |
16,794 | 10 | 24,376 | 13 |
表1. EarlyTox Cell Integrity アッセイの結果:LPSまたはPMA/イオノマイシン処理によるPBMCの細胞生存率(死細胞の割合)への影響
PMAおよびイオノマイシンが細胞の生存率や形態に与える影響をさらに詳しく調べるため、PBMCに対してそれぞれの化合物を段階的に増量して処理を行いました。解析には、前述の方法論を適用しました(画像は未掲載)。図5に示すように、両化合物の濃度が上昇するにつれて細胞死が有意に増加し、両薬剤が細胞毒性を媒介することが示されました。さらに、我々のデータでは、PMAはイオノマイシンの約2倍の細胞毒性を示すことが明らかになりました(\( \frac{50\,\mathrm{ng}}{\mathrm{mL}} \)のPMAでは死細胞が15%、\( \frac{2\,\mathrm{µg}}{\mathrm{mL}} \)のイオノマイシンでは7%)。
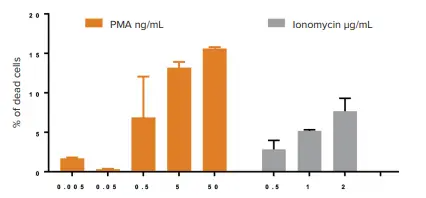
図5. PMAおよびイオノマイシンを個別に添加した際の細胞毒性効果
サイトカイン産生の細胞生存率への正規化
PBMCの生存率とサイトカイン分泌データの統合は、生物学的応答を正確に解析するための最終段階となります。正規化を行うために、HTRF法で測定されたサイトカイン濃度を、EarlyTox Cell Integrity アッセイで算出された生存細胞数で除しました。
図6では、サイトカイン濃度を生存細胞数あたりで表現しており、薬理学的ウィンドウおよびIC₅₀は表2に示されています。予想通り、デキサメタゾンは有意な細胞毒性を示さなかったため、正規化前後で薬理学的結果に大きな差は見られませんでした。
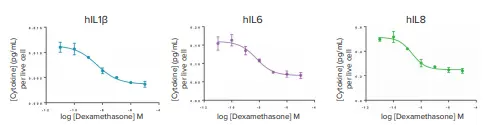
図6. 正規化されたサイトカイン分泌に対するデキサメタゾンの影響。TNFα、IL2、IFNγの用量反応曲線は未掲載
| LPS刺激PBMC(生存率100) | PMA/Iono刺激PBMC(生存率85) | |||||
|---|---|---|---|---|---|---|
| IL1β | IL6 | IL8 | TNFα | IL2 | IFNγ | |
| S/B | 3.1 | 2.4 | 2.1 | 2.3 | 1.4 | 1.7 |
|
IC₅₀ |
3.9 E-09 | 6.0 E-09 | 2.2 E-09 | 5.4 E-09 | 2.8 E-08 | 2.6 E-08 |
表2. 刺激されたPBMCにおける薬理学的ウィンドウ(シグナル/バックグラウンド)およびIC₅₀値
PMA/イオノマイシン刺激によるIL2またはIFNγ分泌を細胞生存率で正規化したところ、これまで検出されなかったPMAの濃度依存的な効果が明らかになりました(図7)。この結果は、サイトカイン分泌(または他のバイオマーカー)を生存細胞数に対して正規化することで、重要な生物学的応答を明らかにできることを示しています。
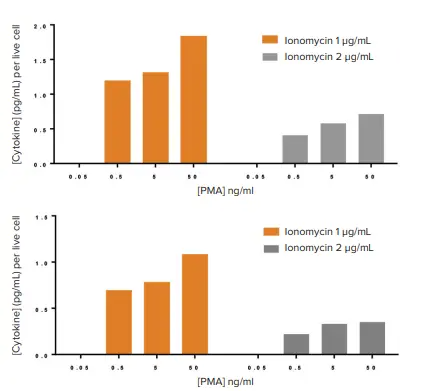
図7. 正規化されたサイトカイン分泌に対するPMA/イオノマイシン濃度の影響。上段:生存細胞数に対して正規化されたhIL2分泌。下段:生存細胞数に対して正規化されたhIFNγ分泌
結論
この研究により、PMAおよびイオノマイシンが細胞毒性を示す一方で、デキサメタゾンは顕著な細胞毒性を示さないことが明確に示されました。EarlyTox Cell Integrity キットを用いて得られた細胞生存率の結果からは、PMAまたはイオノマイシンの濃度依存的な影響が視覚的に確認されました。
Cisbio Bioassaysは、PBMCのような浮遊細胞からのサイトカイン分泌を評価し、薬剤のサイトカイン放出に対する細胞毒性を測定するための、使いやすく高感度な手法を提供しています。SpectraMax i3x プレートリーダーとMiniMaxサイトメーターの組み合わせにより、HTRFによるサイトカイン定量と、EarlyTox Cell Integrity キットを用いた細胞生存率の評価が可能となります。
PDF版(英語)